| |
| Med Sci (Paris). 2015 June; 31(6-7): 600–603. Published online 2015 July 7. doi: 10.1051/medsci/20153106009.Les guanylate binding proteins : de nouveaux acteurs de l’immunité antibactérienne du cytosol des cellules hôtes Pierre Wallet,1** Brice Lagrange,1*** and Thomas Henry1* 1Centre international de recherche en infectiologie (CIRI), Inserm U1111, 21, avenue Tony Garnier, 69365Lyon, France MeSH keywords: Animaux, Bactéries, Cytosol, Protéines de liaison à l'ADN, Francisella tularensis, Protéines G, Interactions hôte-pathogène, Humains, Immunité innée, Tularémie, immunologie, pathogénicité, microbiologie, physiologie, génétique |
L’immunité innée cytosolique Le système immunitaire inné permet une réponse immédiate en réponse à une infection, pour éliminer les pathogènes avant qu’ils n’établissent une infection durable. L’activation du système immunitaire inné nécessite une étape préalable de détection de l’infection via la reconnaissance de motifs moléculaires associés aux microbes (MAMP). Cette tâche de reconnaissance des motifs moléculaires associés aux microbes est réalisée par les récepteurs de reconnaissance de motifs moléculaires (PRR) de l’hôte. Les PRR membranaires ont pour rôle de surveiller le milieu extracellulaire ainsi que les endosomes, alors que les PRR cytosoliques détectent les pathogènes capables de se multiplier dans le cytoplasme des cellules hôtes. L’immunité dite cytosolique comprend l’ensemble des voies de détection des pathogènes cytosoliques ainsi que les réponses effectrices antimicrobiennes permettant de lutter contre les pathogènes envahissant ce compartiment cellulaire [1]. Les pathogènes qui se multiplient dans le cytosol des cellules de mammifères incluent de nombreux virus, des parasites (Trypanosoma cruzi) et un certain nombre de bactéries pathogènes dont Shigella flexneri, Listeria monocytogenes ou Francisella tularensis. Nous nous intéresserons, dans cette Nouvelle, à une voie particulière de l’immunité cytosolique : l’inflammasome [2, 11]. L’inflammasome est un complexe multiprotéique qui se forme suite à la détection, par des PRR cytosoliques, de signaux de danger ou d’infection, et qui déclenche l’activation de la caspase-1. La caspase-1 est une caspase inflammatoire qui entraîne la maturation et la sécrétion des interleukines pro-inflammatoires IL-1β et IL-18. Ces deux cytokines ont pour rôles majeurs d’attirer les cellules immunitaires au site de l’infection et de déclencher une cascade de signalisation augmentant les capacités bactéricides des cellules recrutées. L’activation de la caspase-1 par l’inflammasome entraîne aussi la mort de la cellule infectée par un mécanisme atypique et très rapide de mort cellulaire programmée appelé pyroptose [12]. Ce « suicide » des cellules infectées est essentiel pour éliminer la niche de réplication des pathogènes intracellulaires et, ainsi, limiter leur dissémination dans l’organisme. Les inflammasomes sont retrouvés essentiellement dans les cellules immunitaires, mais aussi dans certaines cellules épithéliales. |
Francisella tularensis et l’inflammasome AIM2
Francisella tularensis est une bactérie à Gram négatif et l’agent d’une zoonose nommée tularémie. Francisella tularensis est extrêmement infectieuse et virulente. La dose létale chez l’homme est estimée à moins de 10 bactéries. Les symptômes de la tularémie débutent comme ceux d’une grippe classique. Selon la voie d’entrée de la bactérie, ils évoluent différemment, allant de la conjonctivite à la pneumonie. Ces pathologies s’accompagnent le plus souvent d’une hypertrophie ganglionnaire. Francisella est une bactérie intracellulaire facultative dont les réservoirs naturels seraient les amibes et les rongeurs. Elle se transmet à l’homme via des piqûres de vecteurs tels que les tiques ou certains moustiques. Dans l’hôte, Francisella infecte principalement les cellules immunitaires phagocytaires telles que les macrophages. Une fois phagocytée, la bactérie s’échappe rapidement de son phagosome, par un mécanisme encore inconnu, pour se retrouver libre dans le cytosol. Elle détourne les sources d’énergies du cytosol de la cellule hôte [3] afin de se multiplier activement. Une fois qu’elle s’est échappée du phagosome, Francisella est rapidement détectée dans le cytosol par l’immunité innée cytosolique. La première étape de reconnaissance est dépendante d’un PRR particulier, l’enzyme cGAS (cGAMP-synthase), qui lorsqu’elle détecte de l’ADN dans le cytosol, synthétise un second messager intracellulaire, le dinucléotide cyclique cGAMP [4]. Ce dernier active la synthèse d’interféron (IFN)-β via l’adaptateur STING (stimulator of interferon genes). L’IFN-β permet l’induction coordonnée de centaines de gènes appelés gènes inductibles par l’interféron (ISG). Nombre de ces gènes ont une fonction antimicrobienne documentée [5]. Plus tardivement au cours de l’infection, le récepteur de l’inflammasome AIM2 (absent in melanoma 2) détecte de l’ADN génomique bactérien dans le cytosol du macrophage et déclenche l’activation du complexe de l’inflammasome AIM2, la sécrétion des cytokines pro-inflammatoires et la mort par pyroptose de la cellule infectée [6]. L’ADN étant normalement confiné dans la bactérie, sa reconnaissance par le récepteur cytosolique AIM2 implique qu’elle ait été libérée par la lyse des bactéries. Les mécanismes conduisant à la lyse bactérienne dans le cytosol sont inconnus. On ne sait pas s’il s’agit d’un événement accidentel (des événements de lyse bactérienne ont lieu à faible fréquence lors de la croissance bactérienne en milieu de culture axénique) ou d’un processus actif, c’est-à-dire provoqué par une activité immune antibiotique du cytosol de la cellule hôte. Nos propres observations, ainsi que celles d’autres équipes, ont démontré un lien entre l’IFN-β et l’inflammasome AIM2, ce qui suggère que l’activité bactériolytique du cytosol est une conséquence de l’immunité cytosolique inductible par l’IFN [7]. |
Les protéines GBP2 et GBP5 induisent l’activation de l’inflammasome AIM2 Afin de savoir si, parmi les centaines de gènes induits par l’IFN-β, certains avaient un rôle dans l’activation de l’inflammasome AIM2 induite par l’infection par Francisella, nous avons étudié l’impact sur ce processus de l’inhibition par siARN de l’expression de 500 ISG dans les macrophages. Ce crible a mis en évidence que la diminution d’expression de deux protéines - guanylate binding protein 2 et 5 (GBP2-GBP5) - bloque l’activation de l’inflammasome AIM2 lors d’une infection par Francisella [8]. Nos résultats ont été validés dans des macrophages issus de souris génétiquement invalidées pour Gbp2 et Gbp5. Elles appartiennent à une large famille de GTPases proches de la dynamine (une GTPase impliquée dans la dynamique de fission/fusion des vésicules membranaires intracellulaires). Elles avaient préalablement été impliquées dans la lutte contre les pathogènes intracellulaires vacuolaires (résidant dans un compartiment membranaire). L’action antimicrobienne des GBP vis-à-vis de ces pathogènes s’exerce directement sur la membrane de la vacuole qui entoure et protège ces pathogènes, ce qui conduit à la perte de l’intégrité de cette vacuole [9]. En comparant des macrophages sauvages et déficients en GBP infectés par Francisella, nous n’avons pas observé d’impact des GBP sur l’échappement de Francisella du phagosome. Cette observation indique que les GBP, outre leur action sur les pathogènes, se multipliant dans les phagosomes, peuvent avoir une action antimicrobienne sur ceux qui se répliquent dans le cytosol. |
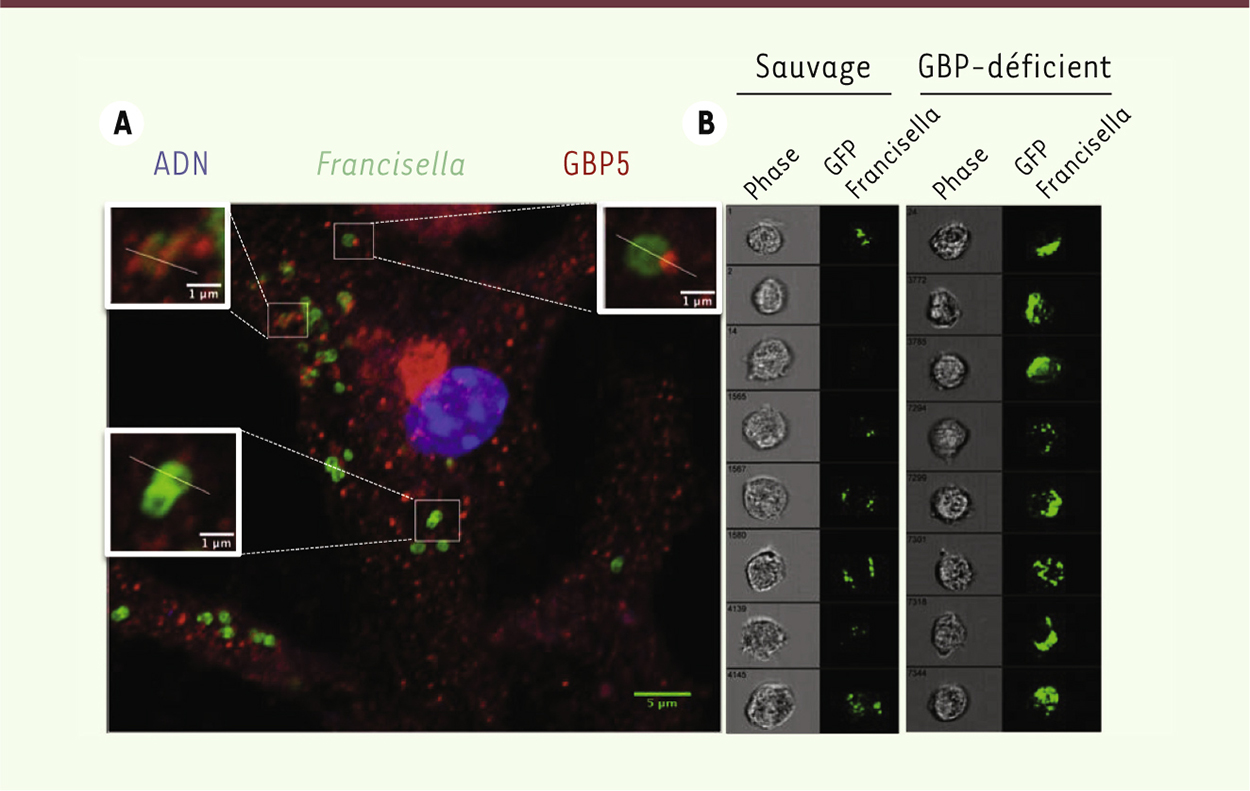
Les GBP contrôlent la réplication intracellulaire Par des techniques d’immunofluorescence, nous avons montré que GBP2 et GBP5 colocalisent avec Francisella dans le cytoplasme de la cellule hôte (Figure 1), ce qui signifie que les GBP ciblent les bactéries du cytosol. En utilisant de nouvelles techniques de cytométrie en flux couplées à de la microscopie à fluorescence sur cellule unique (Figure 1), nous avons montré que les GBP contrôlent la réplication intracellulaire de Francisella. Ainsi, la concentration intracellulaire de Francisella est beaucoup plus élevée dans les macrophages déficients en GBP que dans les macrophages sauvages. Ces données indiquent donc que les GBP restreignent la réplication bactérienne : (1) directement en bloquant la réplication bactérienne et en induisant la lyse de la bactérie dans le cytoplasme, et (2) indirectement, en induisant l’activation de l’inflammasome AIM2 qui, à son tour, induit l’élimination de la niche réplicative de Francisella. Nous avons confirmé ces résultats, in vivo, dans un modèle murin de tularémie. Nous avons montré que la bactérie dissémine plus efficacement dans la rate et le poumon des souris déficientes en GBP. De plus, ces dernières ne survivent que 4 jours alors que les souris sauvages survivent 10 jours après infection. Il s’agit de la découverte des premières protéines cytosoliques à action antibiotique. Les GBP, induites par l’IFN-β, lysent Francisella, entraînent le relargage d’ADN bactérien dans le cytosol, et permettent ainsi l’activation de l’inflammasome AIM2 (voir modèle Figure 2) [8, 10].
 | Figure 1.
Les GBP ciblent les bactéries cytosoliques et limitent leur réplication intracytosolique. A. Immunofluorescence de macrophages infectés par Francisella montrant les différentes formes de colocalisation entre GBP5 (marquage rouge) et Francisella (marquage vert). L’ADN du macrophage est visualisé par un marquage DAPI (bleu). B. Microscopie en flux sur cellule unique (macrophages sauvages ou déficients en GBP infectés pendant 12h avec Francisella exprimant la GFP, green fluorescent protein). Le signal GFP correspondant aux bactéries est beaucoup plus fort dans les macrophages déficients en GBP que dans les macrophages sauvages, indiquant le rôle antimicrobien des GBP. |
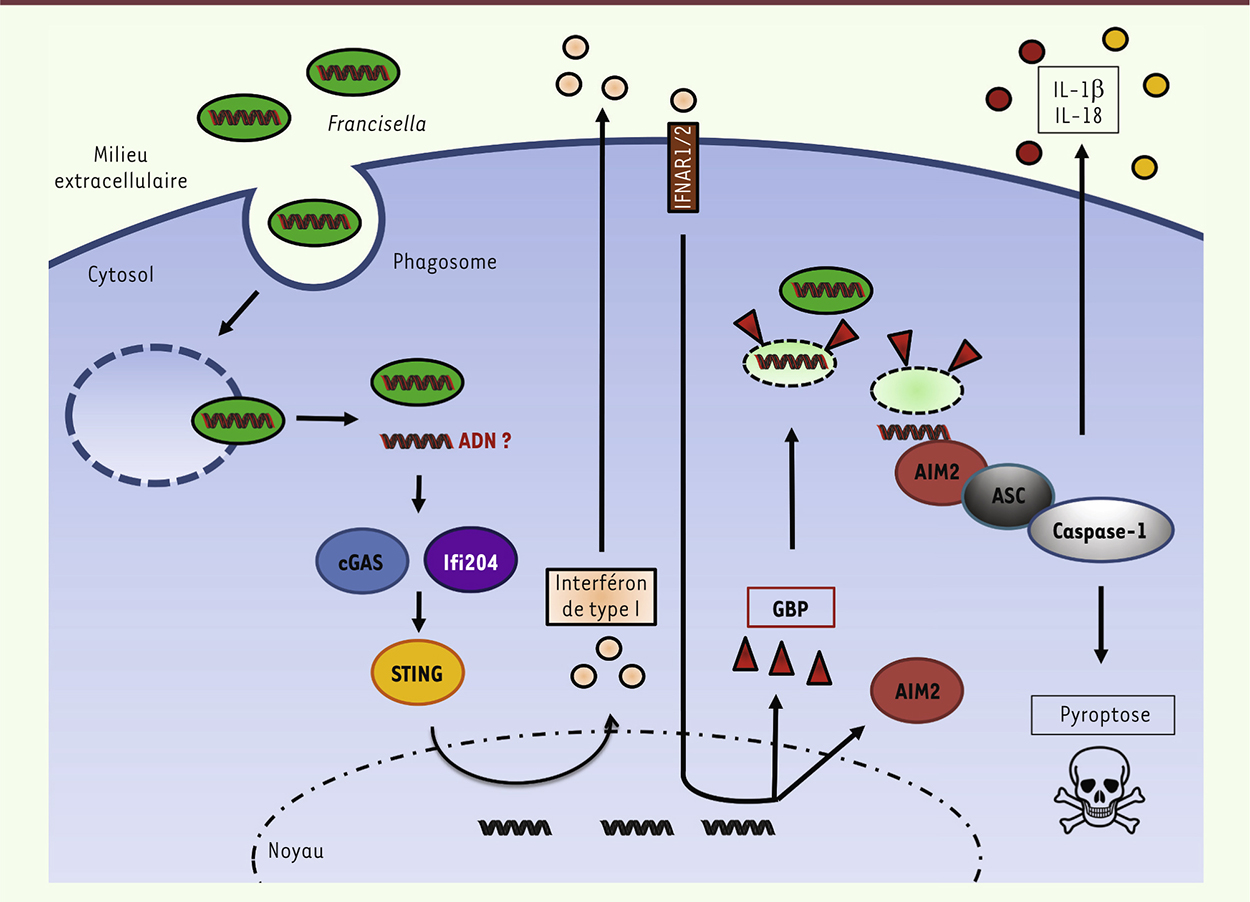
 | Figure 2.
Immunité cytosolique anti-Francisella.
Suite à son échappement précoce du phagosome, Francisella est reconnue par la voie cGAS/STING, ce qui conduit à la sécrétion d’IFN-® et à l’induction de nombreux gènes inductibles par l’interféron, dont GBP2 et GBP5. Ces GBP lysent la bactérie dans le cytosol entraînant le relargage d’ADN dans le cytosol ; celui-ci est alors reconnu par l’inflammasome AIM2. L’inflammasome AIM2 déclenche la sécrétion de cytokines inflammatoires et la mort de la cellule infectée. |
|
Cette étude sur les GBP et l’immunité cytosolique anti-Francisella ouvre de nombreuses perspectives : en premier lieu, il sera intéressant de déterminer si les GBP sont aussi actives contre d’autres bactéries cytosoliques telles que Listeria monocytogenes. De plus, le mécanisme moléculaire bactériolytique des GBP reste à définir. Deux hypothèses sont envisagées : un mécanisme bactériolytique direct des GBP, qui pourraient former un anneau contractile autour des bactéries, ou un mécanisme indirect dans lequel les GBP constitueraient un échafaudage moléculaire servant à recruter d’autres molécules antibactériennes au niveau des bactéries cytosoliques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les auteurs remercient les membres de l’équipe et les collaborateurs ayant participé à cette étude. Ce travail est soutenu par un financement ERC 311542.
|
1.
Ray K, Marteyn B, Sansonetti PJ, Tang CM. Life on the inside: the intracellular lifestyle of cytosolic bacteria . Nat Rev Microbiol. 2009; ; 7 : :333.–340. 2.
Broz P, Monack DM. Molecular mechanisms of inflammasome activation during microbial infections . Immunol Rev. 2011; ; 243 : :174.–190. 3.
Barel M, Charbit A. Francisella tularensis intracellular survival: to eat or to die . Microbes Infect. 2013 ; pii : S1286-4579(13)00206-2.. 4.
Storek KM, Gertsvolf NA, Ohlson M, Monack DM. cGAS and Ifi204 cooperate to produce type I IFNs in response to Francisella infection . J Immunol. 2015; ; 194 : :3236.–3245. 5.
Randow F, MacMicking JD, James LC. Cellular self-defense: how cell-autonomous immunity protects against pathogens . Science. 2013; ; 340 : :701.–706. 6.
Jones JW, Kayagaki N, Broz P, et al. Absent in melanoma 2 is required for innate immune recognition of Francisella tularensis . Proc Natl Acad Sci USA. 2010; ; 107 : :9771.–9776. 7.
Henry T, Brotcke A, Weiss DS, et al. Type I interferon signaling is required for activation of the inflammasome during Francisella infection . J Exp Med. 2007; ; 204 : :987.–994. 8.
Meunier E, Wallet P, Dreier RF, et al. Guanylate-binding proteins promote activation of the AIM2 inflammasome during infection with Francisella novicida . Nat Immunol. 2015; ; 16 : :476.–484. 9.
Kim BH, Shenoy AR, Kumar P, et al. IFN-inducible GTPases in host cell defense . Cell Host Microbe. 2012; ; 12 : :432.–444. 10.
Man SM, Karki R, Malireddi RK, et al. The transcription factor IRF1 and guanylate-binding proteins target activation of the AIM2 inflammasome by Francisella infection . Nat Immunol. 2015; ; 16 : :467.–475. 11.
Jamilloux Y, Henry T. Les inflammasomes . Med Sci (Paris). 2013; ; 29 : :975.–984. 12.
Cabon L, Martinez-Torres AC, Susin SA. La mort cellulaire programmée ne manque pas de vocabulaire . Med Sci (Paris). 2013; ; 29 : :1117.–1124. |