| |
| Med Sci (Paris). 2015 May; 31(5): 481–483. Published online 2015 June 9. doi: 10.1051/medsci/20153105007.Identification de Toddler/Elabela ou la double vie du récepteur de l’apéline Jean Lesage,1* Delphine Eberlé,1** and Christophe Breton1*** 1Unité environnement périnatal et santé, EA4489, Université de Lille 1, bâtiment SN4, 59655Villeneuve d’Ascq, France MeSH keywords: Séquence d'acides aminés, Animaux, Système cardiovasculaire, Séquence conservée, Embryon non mammalien, Métabolisme énergétique, Gastrulation, Humains, Protéines et peptides de signalisation intercellulaire, Ligands, Mammifères, Données de séquences moléculaires, Néovascularisation physiologique, Cellules souches pluripotentes, Alignement de séquences, Similitude de séquences d'acides aminés, Spécificité d'espèce, Danio zébré, Protéines de poisson-zèbre, embryologie, physiologie, métabolisme |
En 1993, O’Dowd et al. [1] identifièrent, par clonage d’une banque génomique humaine, un récepteur orphelin de 380 acides aminés appartenant à la famille des récepteurs à sept domaines transmembranaires couplés aux protéines G et qui partageait 30 % d’identité de séquence protéique avec le récepteur de type 1 des angiotensines (AT1). Ce récepteur fut nommé APJ pour protéine putative reliée au récepteur AT1. Cinq ans plus tard, Tatemoto et al. [2] isolèrent un ligand endogène de ce récepteur à partir d’extraits d’estomac de bœuf qui fut dénommé apéline. Il existe de nombreuses formes moléculaires de l’apéline dérivant de son précurseur (la proapéline), et qui sont fortement conservées dans de nombreuses espèces de mammifères et chez l’homme. La pré-proapéline est un précurseur de 77 acides aminés qui donne naissance par clivage à différentes isoformes moléculaires d’apéline comme l’apéline-36, l’apéline-17, l’apéline-13 et sa forme pyroglutamylée (pyr-Apl-13) ou encore l’apéline-12. Ces formes partagent toutes une conservation stricte de leurs 12 derniers acides aminés carboxy-terminaux (Figure 1) nécessaires à la liaison au récepteur APJ [10] (→). Le système apélinergique (apéline et APJ) est exprimé dans de très nombreux tissus et particulièrement dans le cœur, les poumons, l’endothélium vasculaire, les reins, le cerveau et les tissus adipeux. Plusieurs formes moléculaires (majoritairement l’apéline-13) sont circulantes et confèrent le statut d’hormone à l’apéline. Une décennie d’études a démontré que le système apélinergique est impliqué dans des fonctions biologiques très variées. Il joue notamment un rôle particulièrement important dans le maintien de l’homéostasie du système cardiovasculaire, dans la régulation hydrominérale et celle du métabolisme énergétique [3].
 | Figure 1.
Formes moléculaires des différents ligands de APJ. Les séquences des peptides dérivés de l’apéline chez l’homme et du peptide Toddler/Elabela, les deux ligands endogènes du récepteur APJ sont figurées. L’alignement des séquences montre une conservation stricte des 12 derniers acides aminés pour l’apéline et des 11 derniers pour Toddler/Elabela, sans homologie de séquences entre ces deux facteurs. |
(→) Voir la Synthèse de B. Masri et al., m/s n° 3, mars 2015, page 275
|
Biologie du récepteur APJ et découverte de Toddler/Elabela Depuis sa découverte, de nombreuses études ont démontré que le récepteur APJ présente des fonctions singulières comme par exemple la capacité d’être activé par simple étirement dans les cardiomyocytes, de former des hétérodimères avec d’autres récepteurs comme avec celui de l’angiotensine 1 induisant l’inhibition d’AT1, ou encore de fonctionner comme un corécepteur permettrant l’entrée du virus VIH-1 (virus de l’immunodéficience humaine) dans des cellules humaines [4]. La liaison des isoformes peptidiques de l’apéline à APJ entraîne une très large gamme de réponses biochimiques : citons l’inhibition de la production d’AMPc, la phosphorylation de la protéine kinase B (Akt), de ERK 1/2, de P70S6K, la mobilisation de calcium intracellulaire, ou la synthèse de monoxyde d’azote ; ces actions pouvant être spécifiques de tissus, mais aussi spécifiques des isoformes de l’apéline qui sont incriminées dans les tissus et les y induisent [4]. Récemment, la découverte concomitante par deux groupes de recherche d’un nouveau ligand peptidique endogène d’APJ, dénommé Elabela [5] ou Toddler [6], et identifié chez le poisson zèbre, ajoute un niveau de complexité supplémentaire à ce système. |
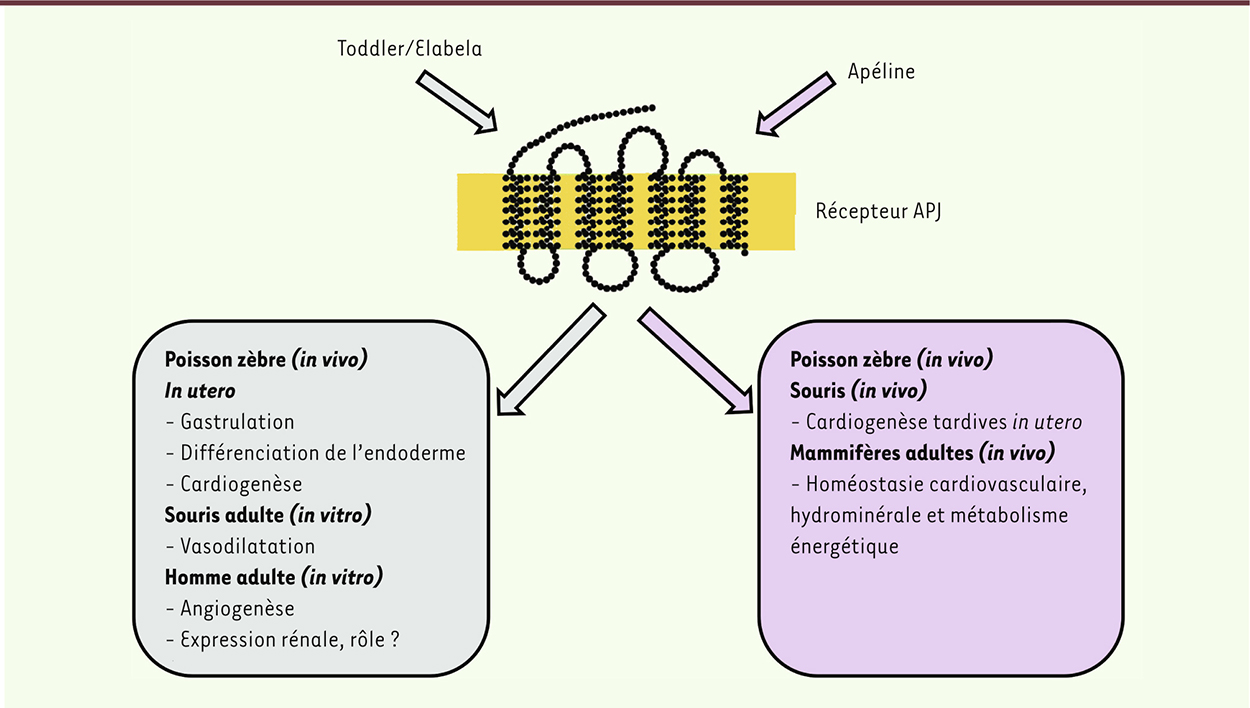
Implication de Toddler/Elabela dans la gastrulation et la cardiogenèse Chez la souris, on savait que l’invalidation du gène codant le récepteur APJ causait la mort précoce de près de 50 % des embryons en raison de profondes altérations cardiaques et vasculaires [7]. En revanche, les souris ayant une invalidation génique du gène codant le ligand apeline naissaient en bonne santé, sans pathologie cardiovasculaire [8]. Cette discordance indiquait l’existence probable d’un autre ligand endogène d’APJ durant le développement embryonnaire. De fait, deux études indépendantes et simultanées, menées l’une par une équipe américaine [6] et l’autre par des chercheurs de Singapour [5], ont récemment identifié un nouveau ligand peptidique circulant d’APJ chez le poisson zèbre, baptisé Toddler ou Elabela. Ces auteurs se sont intéressés à des séquences génomiques très courtes contenant des cadres de lecture, mais qui étaient jusqu’alors considérées comme des gènes non codants. Des expériences d’invalidation et une démarche de caractérisation peptidique leur a permis d’identifier de nouveaux facteurs impliqués dans le développement embryonnaire du poisson zèbre. L’équipe de Pauli et al. [6] a montré que la perte de fonction du peptide Toddler/Elabela ou sa surexpression inhibent les mouvements cellulaires d’épibolie1 durant la gastrulation de l’œuf, ce qui perturbe la mise en place du mésendoderme. Dans cette étude publiée dans le journal Science, les chercheurs ont aussi démontré que Toddler/Elabela est un peptide sécrété qui gouverne l’orientation précoce des cellules embryonnaires vers les pôles animal ou végétatif durant la gastrulation, ce qui fait de Toddler/Elabela la toute première hormone du développement identifiée. On considérait en effet jusqu’à maintenant que les étapes précoces de division cellulaire de l’œuf fécondé n’étaient gouvernées que par un programme génétique complexe, et ne faisait pas intervenir de peptides/hormones sécrétés. L’étude menée à Singapour par Chng et al. [5] a également observé cette implication de Toddler/Elabela dans les migrations cellulaires au cours de la gastrulation. Mais ces chercheurs se sont ensuite focalisés sur le devenir in vivo des embryons après l’invalidation de ce peptide. Celle-ci induit de profondes perturbations dans la différenciation de l’endoderme, qui affectent principalement les processus de cardiogenèse ; en l’absence de Toddler/Elabela, les embryons de poisson zèbre ne forment qu’une ébauche rudimentaire de cœur ; parfois le cœur est absent, ce qui est rapidement létal [5]. Enfin, ces auteurs ont montré que, chez le poisson zèbre, l’expression de Toddler/Elabela, forte durant la gastrulation, diminue ensuite parallèlement à l’émergence de l’expression du gène codant l’apéline [6]. Dans cette espèce, le peptide Toddler/Elabela est donc le premier ligand endogène du récepteur APJ, l’apéline venant, dans un second temps, agir en synergie avec Toddler/Elabela pour contrôler notamment la formation cardiaque (Figure 2).
 | Figure 2.
Principales fonctions biologiques de Toddler/Elabela et de l’apéline chez l’homme et dans d’autres espèces.
|
|
Biologie de Toddler/Elabela chez les mammifères et perspectives Chez le poisson zèbre, Toddler/Elabela est un peptide de 58 acides aminés, avec une forte conservation phylogénétique chez le poussin, la grenouille, la souris, et l’homme, en particulier au niveau de la région carboxy-terminale [5, 6]. Il est donc très probable qu’il intervienne dans le développement du système cardiovasculaire chez les mammifères. Une étude très récente [9] vient de démontrer que les transcrits du gène codant Toddler/Elabela sont détectables dans le rein humain adulte ainsi que dans des cellules souches pluripotentes humaines. L’expression prédominante de Toddler/Elabela dans le rein et dans ces cellules souches semble indiquer que celui-ci pourrait être impliqué - comme facteur paracrine et/ou hormonal - dans la régulation de l’activité rénale et cardiovasculaire chez les mammifères. Ces auteurs ont aussi démontré [9] qu’un peptide de 32 acides aminés correspondant à la forme maturée et sécrétée de Toddler/Elabela était capable d’induire, in vitro, un processus d’angiogenèse chez l’homme et la relaxation de vaisseaux sanguins de souris. Ces processus seraient moins dépendants de l’endothélium que lorsqu’ils sont induits par l’apéline-13, indiquant que les voies de signalisation intracellulaire mises en jeu par ces deux ligands du récepteur APJ pourraient être différentes. Les perspectives suscitées par ces études sont nombreuses. Ce peptide pourrait s’avérer être un nouveau régulateur paracrine, voire endocrine, de nombreuses fonctions physiologiques, en particulier au cours du développement et dans les régulations hydrominérale, cardiovasculaire et métabolique chez les mammifères. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
O’Dowd BF, Heiber M, Chan A, et al. A human gene that shows identity with the gene encoding the angiotensin receptor is located on chromosome 11 . Gene. 1993; ; 136 : :355.–360. 2.
Tatemoto K, Hosoya M, Habata Y, et al. Isolation and characterization of a novel endogenous peptide ligand for the human APJ receptor . Biochem Biophys Res Commun. 1998; ; 251 : :471.–476. 3. O’Carroll AM, Lolait SJ, Harris LE, Pope GR. The apelin receptor APJ: journey from an orphan to a multifaceted regulator of homeostasis . J Endocrinol. 2013; ; 219 : :13.–35. 4.
Chapman NA, Dupré DJ, Rainey JK. The apelin receptor: physiology, pathology, cell signalling, and ligand modulation of a peptide-activated class A GPCR . Biochem Cell Biol. 2014; ; 92 : :431.–440. 5.
Chng SC, Ho L, Tian J, Reversade B. ELABELA: a hormone essential for heart development signals via the apelin receptor . Dev Cell. 2013; ; 27 : :672.–680. 6.
Pauli A, Norris ML, Valen E, et al. Toddler: an embryonic signal that promotes cell movement via Apelin receptors . Science. 2014; ; 343 : :1248636.. 7.
Charo DN, Ho M, Fajardo G, et al. Endogenous regulation of cardiovascular function by apelin-APJ . Am J Physiol Heart Circ Physiol. 2009; ; 297 : :1904.–1913. 8.
Kuba K, Zhang L, Imai Y, et al. Impaired heart contractility in Apelin gene-deficient mice associated with aging and pressure overload . Circ Res. 2007; ; 101 : :32.–42. 9.
Wang Z, Yu D, Wang M, et al. Elabela-apelin receptor signaling pathway is functional in mammalian systems . Sci Rep. 2015; ; 5 : :8170.. 10.
Masri B, Dray C, Knauf C, et al. Le récepteur de l’apéline . Med Sci (Paris). 2015; ; 31 : :275.–281. |