| |
| Med Sci (Paris). 2015 May; 31(5): 475–477. Published online 2015 June 9. doi: 10.1051/medsci/20153105005.Le dernier sursaut des cellules mourantes Étape clé de la morphogenèse tissulaire Bruno Monier,1,2* Melanie Gettings,1,2* Guillaume Gay,3 Thomas Mangeat,1,2 Sonia Schott,1,2 Ana Guarner,4 and Magali Suzanne1,2** 1Université de Toulouse, UPS, LBCMCP, F-31062Toulouse, France 2CNRS, LBCMCP, F-31062Toulouse, France 3DamCB, Data Analysis and Modelling for Cell Biology, 13005Marseille, France 4Centro de Biología Molecular Severo Ochoa (CSIC-UAM), Universidad Autónoma de Madrid, Nicolás Cabrera 1, Cantoblanco, 28049Madrid, Espagne MeSH keywords: Animaux, Apoptose, Polarité de la cellule, Drosophila melanogaster, Cellules épithéliales, Membres, Humains, Mammifères, Métamorphose biologique, Morphogenèse, Anomalies du tube neural, Pupe, Contrainte mécanique, physiologie, cytologie, croissance et développement, embryologie, anatomopathologie |
L’apoptose, sculpteur actif de la morphogenèse L’apoptose - ou mort cellulaire programmée - est un processus cellulaire essentiel dont la dérégulation peut entraîner de nombreuses pathologies [1]. Elle joue un rôle majeur dans la prévention naturelle du développement d’un cancer au sein d’un organisme, par l’élimination de cellules endommagées ou mal placées. En effet, l’inhibition de l’apoptose permet aux cellules cancéreuses de survivre, malgré leur localisation aberrante et leur prolifération anormale. Au contraire, l’excès d’apoptose peut entraîner le développement de maladies neurodégénératives. Ainsi, l’apoptose apparaît comme un processus cellulaire qui doit être finement régulé. Outre son rôle dans différents contextes pathologiques, l’apoptose est essentielle au cours du développement [2, 3]. C’est d’ailleurs dans ce contexte qu’elle a été initialement identifiée chez des organismes modèles tels que le ver à soie et le têtard. Il a ensuite été montré que ce phénomène était extrêmement conservé au cours de l’évolution. En effet, son déclenchement repose sur l’activation de protéases spécifiques appelées caspases, retrouvées dans la chaîne évolutive du ver à soie jusqu’aux mammifères, et qui se chargent de dégrader de façon coordonnée les différentes structures cellulaires [4]. Cette dégradation progressive aboutit à la formation de corps apoptotiques constitués de débris des différents organites enveloppés d’une membrane. Ces corps apoptotiques permettent une élimination « propre » des cellules, sans déversement du contenu cellulaire à l’extérieur, et donc sans inflammation ; ils seront ensuite éliminés par les macrophages. Au cours du développement, l’apoptose permet de réguler le nombre de cellules au sein d’un tissu, mais aussi de sculpter différentes structures [2, 3]. Parmi les différents modèles de morphogenèse dépendant de l’apoptose (cœur, intestin, mains), la formation des doigts chez les vertébrés a été très étudiée. Selon ces études, l’apoptose, par la simple élimination de cellules, agirait comme un sculpteur sur pierre qui élimine progressivement de petits fragments afin de révéler une nouvelle forme. Dans ce modèle, le rôle de l’apoptose sur son environnement était considéré comme essentiellement passif, se bornant à la simple élimination des cellules qui n’étaient plus nécessaires [5]. Les travaux de notre équipe révèlent au contraire que loin d’être une simple élimination passive de cellules, la mort cellulaire programmée ou apoptose intervient activement dans la morphogenèse. |
Le rôle actif de l’apoptose dans la morphogenèse tissulaire chez la drosophile C’est dans ce contexte de morphogenèse - ou changement de forme tissulaire - que le processus d’apoptose est étudié dans notre équipe. Nous avons montré que loin de se limiter à l’élimination pure et simple de cellules, l’apoptose joue un rôle actif dans le remodelage tissulaire, notamment dans la formation de plis au sein d’un épithélium au cours du développement. Afin de tester l’influence des cellules apoptotiques sur leur environnement, nous avons utilisé comme modèle d’étude la patte de Drosophile [6]. Ce modèle présente de nombreux avantages. Tout d’abord, l’apoptose y survient de façon spontanée (il n’est pas nécessaire de l’induire artificiellement) et stéréotypée à un moment précis - au tout début de la métamorphose - et à un endroit précis - au niveau des futures articulations de la patte. Un second avantage est la disponibilité de nombreux outils génétiques et un temps de génération court chez ces drosophiles, qui permettent de disséquer la fonction de différents gènes aisément. Enfin, le tissu de la patte en cours de développement peut être mis en culture et son développement suivi au cours du temps directement par observation au microscope, ce qui permet d’aborder la dynamique du processus à différentes échelles, tissulaire, mais aussi cellulaire (Figure 1 A-B).
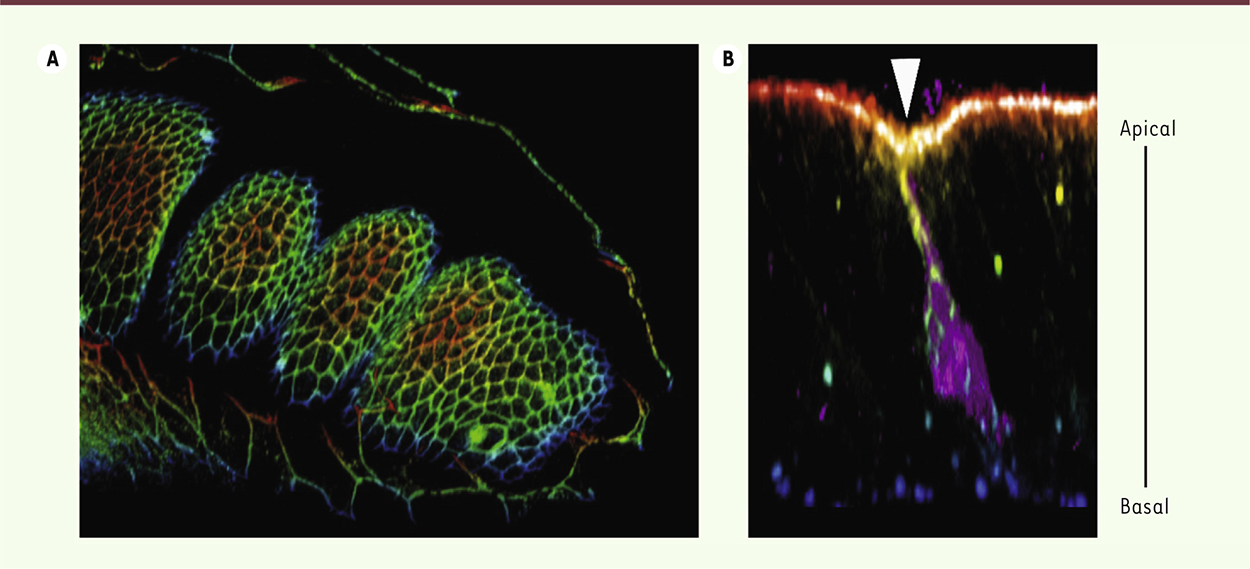
 | Figure 1.
Analyse de l’apoptose au cours du processus de développement de la patte de drosophile. A. Modèle de remodelage tissulaire dépendant de l’apoptose : tissu de patte en cours de développement. Le code couleur permet de différencier des éléments situés à différentes profondeurs dans le tissu. B. Cellule débutant le processus de mort cellulaire programmée ou apoptose, reconnaissable par le marquage violet (qui marque l’activité des caspases, protéases spécifiquement activées lors de l’apoptose). Dans cette cellule, on observe une structure particulière formée par le cytosquelette d’acto-myosine (dégradé vert-jaune-orange) qui est responsable de la génération d’une force spécifiquement dans la cellule mourante, entraînant la déformation apicale de l’épithélium (tête de flèche blanche). |
En utilisant ce modèle, nous avons montré que chaque cellule apoptotique génère avant de mourir une force reposant sur la formation d’un câble apico-basal contractile d’acto-myosine (l’un des principaux moteurs moléculaires responsables des changements de forme cellulaire). La contraction de ce câble entraîne la déformation transitoire de la surface apicale de l’épithélium, et, en conséquence, une augmentation de tension dans les cellules voisines. Finalement, la synergie de plusieurs cellules apoptotiques dans un domaine restreint permet une augmentation de tension suffisante pour entraîner la formation d’un pli, étape clé dans le remodelage tissulaire ou morphogenèse [7]. Afin de tester si ces forces apoptotiques constituent le signal initial responsable du changement de forme du tissu, un modèle biophysique de l’épithélium a été élaboré en collaboration avec la société DamCB. Dans ce modèle théorique tridimensionnel, il a été montré que les forces apoptotiques (force apico-basale suivie de sa propagation apicale) sont à la fois nécessaires et suffisantes pour entraîner la formation d’un pli. Le modèle permet d’explorer des situations hypothétiques inaccessibles in vivo : le pli ne se forme pas dans le modèle si, toutes choses égales par ailleurs, la force de traction apico-basale n’est pas exercée (Figure 2). Le modèle montre aussi la robustesse de l’enchaînement des événements conduisant à la formation du pli, suggérant que ce nouveau mécanisme pourrait survenir dans tout type d’épithélium [7, 8].
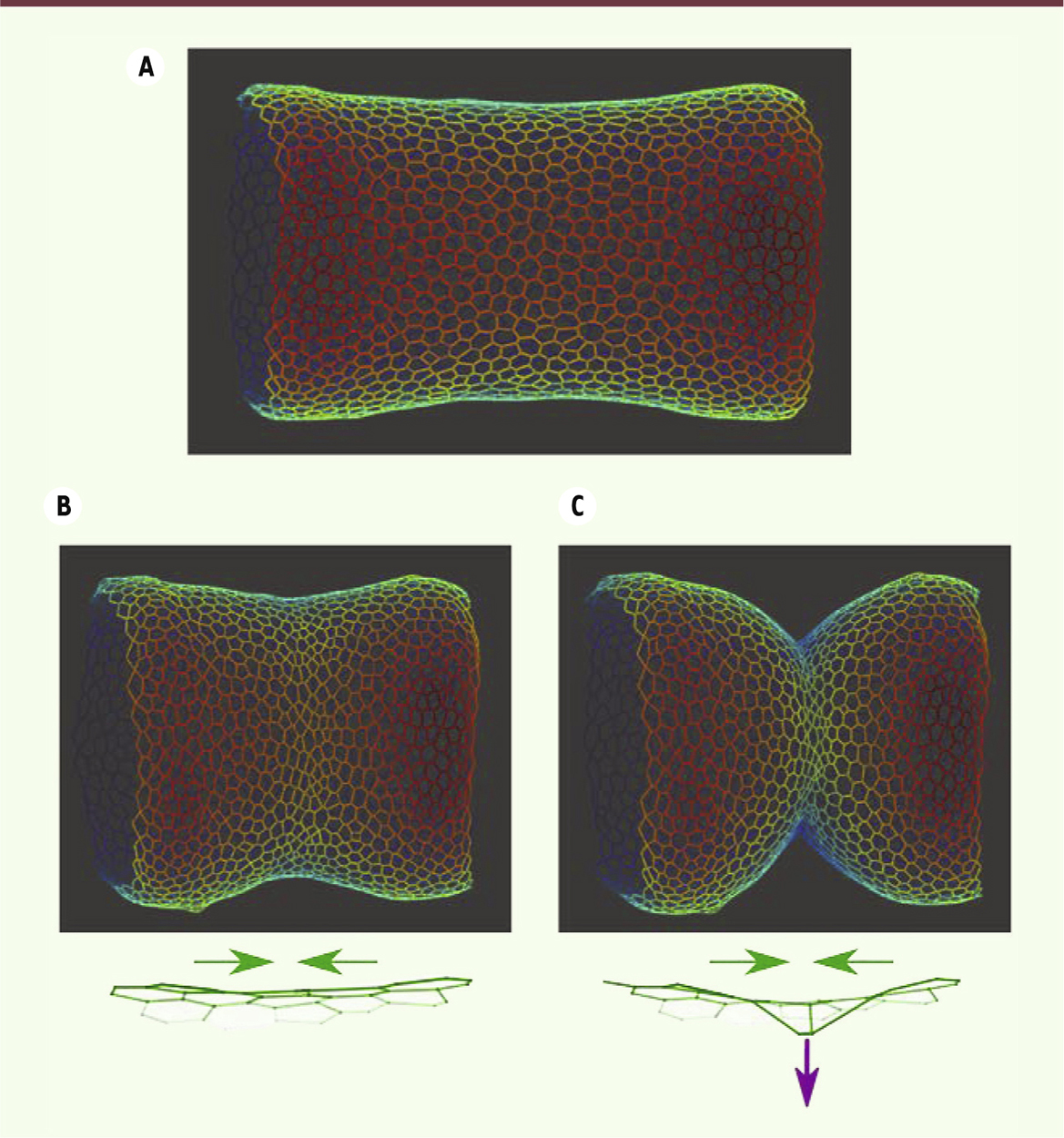
 | Figure 2.
Modélisation de l’épithélium en cours de remodelage. A. Modèle de tissu de patte avant l’élimination des cellules apoptotiques. B. Modèle de tissu après la disparition de 30 cellules apoptotiques, en présence d’une contraction apicale (flèches vertes) mais en l’absence de force apico-basale. C. Modèle de tissu après la disparition de 30 cellules apoptotiques, en présence d’une force apico-basale (flèche violette) et d’une contraction apicale (flèches vertes). |
Ce travail constitue une avancée importante avec, notamment, la démonstration que les cellules apoptotiques peuvent jouer un rôle moteur dans la morphogenèse. L’apoptose est également impliquée chez les vertébrés dans la courbure du tube neural, et son absence peut entraîner des malformations nommées spina bifida. Il sera donc très intéressant de déterminer si les cellules mourantes génèrent également une force dans les cellules mammifères, dans des contextes développementaux et pathologiques. |
1.
Fuchs Y, Steller H. Programmed cell death in animal development and disease . Cell. 2011; ; 147 : :742.–758. 2.
Suzanne M, Steller H. Shaping organisms with apoptosis . Cell Death Differ. 2013; ; 20 : :669.–675. 3.
Penaloza C, Lin L, Lockshin RA, Zakeri Z. Cell death in development: shaping the embryo . Histochem Cell Biol. 2006; ; 126 : :149.–158. 4.
Crawford ED, Wells JA. Caspase substrates and cellular remodeling . Annu Rev Biochem. 2011; ; 80 : :1055.–1087. 5.
Montero JA, Hurlé JM. Sculpturing digit shape by cell death . Apoptosis. 2010; ; 15 : :365.–375. 6. Manjón C, Sánchez-Herrero E, Suzanne M. Sharp boundaries of Dpp signalling trigger local cell death required for Drosophila leg morphogenesis . Nat Cell Biol. 2007; ; 9 : :57.–63. 7.
Monier B, Gettings M, Gay G, et al. Apico-basal forces exerted by apoptotic cells drive epithelium folding . Nature. 2015; ; 518 : :245.–248. 8.
Yamaguchi Y, Miura M. How to form and close the brain: insight into the mechanism of cranial neural tube closure in mammals . Cell Mol Life Sci. 2013; ; 70 : :3171.–3186. |