| |
| Med Sci (Paris). 2015 April; 31(4): 389–396. Published online 2015 May 8. doi: 10.1051/medsci/20153104013.Progrès récents dans la génétique de l’hyperaldostéronisme primaire Maria-Christina Zennaro,1,2,3* Fabio Fernandes-Rosa,1,2,3 and Sheerazed Boulkroun1,2 1Inserm, UMRS 970, Paris-centre de recherche cardiovasculaire, 56, rue Leblanc, 75015Paris, France 2Université Paris Descartes, Sorbonne Paris Cité, Paris, France 3Assistance publique-hôpitaux de Paris, service de génétique, hôpital européen Georges Pompidou, Paris, France |
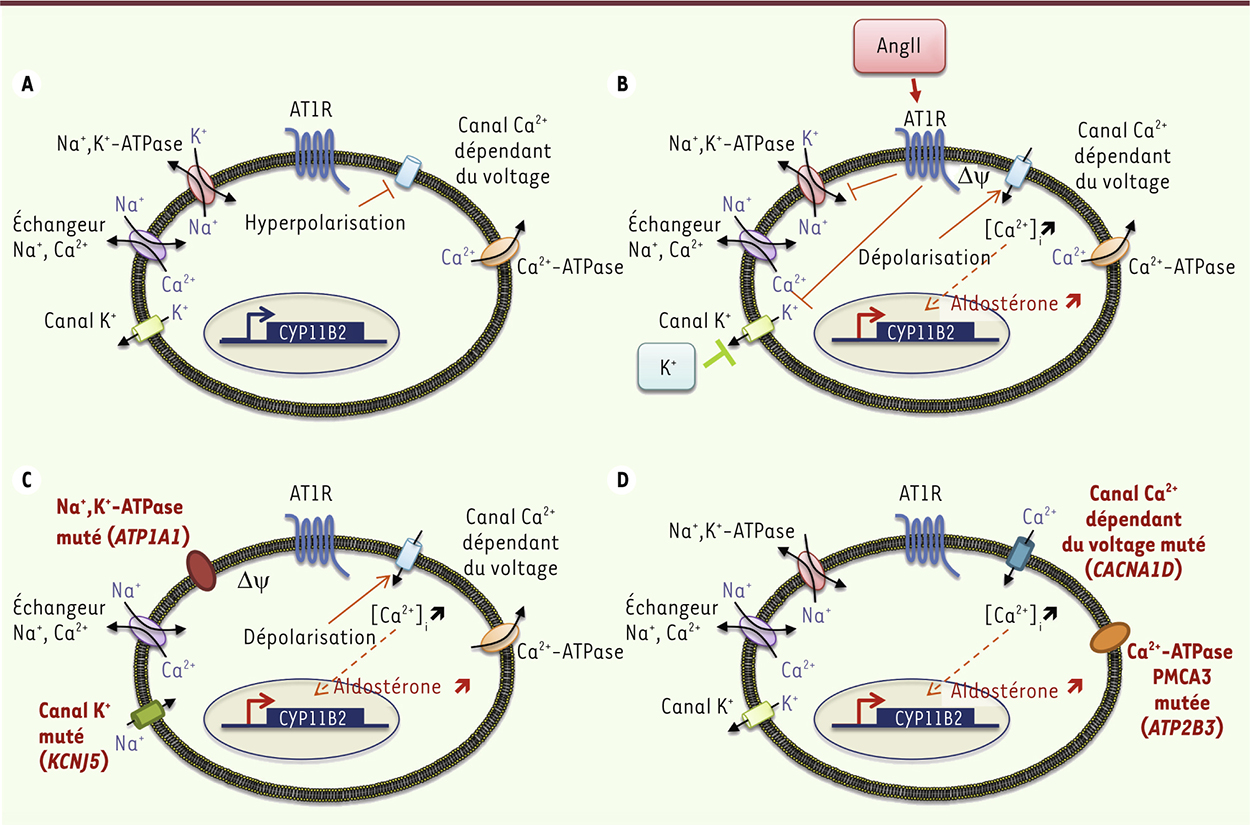
L’hyperaldostéronisme primaire (HAP) est la forme la plus commune d’hypertension artérielle (HTA) secondaire. La prévalence de l’hyperaldostéronisme primaire est estimée à environ 10 % des patients vus dans les centres spécialisés et atteint jusqu’à 20 % chez les patients ayant une HTA résistante aux traitements [1]. Cette maladie résulte d’une production autonome d’aldostérone1 par le cortex de la surrénale, qui est souvent associée à une hypokaliémie. Les deux principales causes en sont les adénomes produisant de l’aldostérone (APA) et les hyperplasies bilatérales des surrénales (HBS). L’augmentation des taux d’aldostérone chez les patients ayant un hyperaldostéronisme primaire est associée à une augmentation du risque cardiovasculaire quand on les compare à des patients ayant une HTA essentielle. Ainsi, une large étude transversale comparant ces deux types de patients appariés individuellement selon le sexe, l’âge et la pression artérielle systolique, a montré, chez les patients avec HAP, une augmentation de la survenue d’événements cardiovasculaires tels que hypertrophie ventriculaire gauche, maladies coronariennes, infarctus du myocarde ou encore fibrillation auriculaire [2]. Cette augmentation de la morbidité cardiovasculaire pourrait être liée à un remodelage cardiaque [3] et une fibrose myocardique [4], se développant de façon indépendante du niveau de pression artérielle. À long terme, le traitement de l’hyperaldostéronisme primaire permet une réversibilité de l’hypertrophie ventriculaire gauche [5]. Le remodelage vasculaire dû à l’excès d’aldostérone ainsi que la durée de l’hypertension constituent des indicateurs de la réponse de la pression artérielle à la surrénalectomie, soulignant ainsi l’importance d’un diagnostic précoce de la maladie [6]. La production d’aldostérone par la zone glomérulée du cortex surrénalien est finement régulée afin d’assurer le maintien de l’homéostasie hydrosodée au niveau rénal (Figure 1). Le principal mécanisme intracellulaire mis en jeu est la signalisation calcique, laquelle est induite à la fois par l’angiotensine II (AngII) et le potassium, les principaux régulateurs de la biosynthèse d’aldostérone [7]. L’augmentation de la signalisation calcique affecte toute une série d’étapes impliquées dans la biosynthèse d’aldostérone, et en particulier l’expression de CYP11B2 (cytochrome P450, family 11, subfamily B, polypeptide 2) qui code pour l’aldostérone synthase (AS), enzyme qui catalyse les dernières étapes de la biosynthèse d’aldostérone. L’AngII agit via le récepteur de l’AngII de type 1 (AT1R) et induit, par la voie de l’inositol triphosphate, un relargage de Ca2+ depuis le réticulum endoplasmique. De plus, l’AngII, tout comme le K+, agissent en dépolarisant la membrane de la zone glomérulée du cortex, conduisant ainsi à l’ouverture de canaux Ca2+ dépendants du voltage. En effet, les cellules de la zone glomérulée ont la capacité intrinsèque de se conduire comme des oscillateurs électriques. L’expression de différents types de canaux potassiques fait du K+ la principale conductance ionique des cellules de cette zone glomérulée. Le potentiel de membrane de ces cellules suit de près le potentiel d’équilibre du K+ dans une large gamme de concentrations extracellulaires de ce cation, faisant des cellules de la zone glomérulée du cortex des senseurs des concentrations extracellulaires en K+. Le gradient de concentration de K+ entre les espaces intra- et extracellulaires nécessaire à l’établissement du potentiel de membrane est généré par l’activité de la Na+,K+-ATPase. Ainsi, l’augmentation de la concentration extracellulaire en K+, la diminution de sa concentration intracellulaire ou encore l’inhibition de la Na+,K+-ATPase ou de canaux potassiques, conduisent tous à une dépolarisation de la membrane plasmique, qui induit l’ouverture de canaux Ca2+ dépendants du voltage. L’importance pour la production physiologique d’aldostérone du maintien du potentiel de repos de la membrane des cellules de la zone glomérulée (−80 mV) ainsi que des concentrations intracellulaires en Ca2+, a récemment été soulignée par la découverte, dans des formes sporadiques et familiales d’HAP, d’altérations génétiques touchant à des séquences codant des protéines impliquées dans la régulation du potentiel de membrane des cellules de la ZG et dans l’homéostasie ionique intracellulaire.
 | Figure 1.
Biosynthèse de l’aldostérone en conditions normales et pathologiques. A. Les cellules de la zone glomérulée (ZG) présentent une conductance élevée pour le K+ leur conférant un potentiel de membrane très négatif en condition basale (−80 mV en présence d’une concentration plasmatique normale en K+), dû à l’expression d’un grand nombre de canaux potassiques. Le gradient de concentration en K+ entre l’espace intracellulaire et extracellulaire nécessaire au maintien du potentiel de membrane est généré par l’activité de la pompe Na+,K+-ATPase. B. L’AngII agit en se liant au récepteur de l’AngII de type 1 (AT1R), et stimule ainsi, via l’augmentation d’inositol triphosphate, le relargage de Ca2+ par le réticulum endoplasmique (non présenté). De plus, l’AngII et le K+ induisent tous les deux une dépolarisation de la membrane plasmique, conduisant à une ouverture de canaux Ca2+ dépendants du voltage qui induit une augmentation du Ca2+ intracellulaire. L’effet de l’AngII sur la dépolarisation de la membrane plasmique passe par une inhibition de canaux potassiques et de la pompe Na+,K+-ATPase. L’augmentation des concentrations extracellulaires, ou la diminution des concentrations intracellulaires en K+, conduisent à une inhibition de canaux potassiques de fuite, aboutissant aussi à une dépolarisation de la membrane plasmique. Celle-ci active l’ouverture de canaux Ca2+ dépendants du voltage. L’augmentation de la concentration intracellulaire en Ca2+ résulte en une activation de la voie de signalisation calcique induisant une augmentation de la biosynthèse d’aldostérone par l’activation de facteurs de transcription spécifiques et la transcription du gène CYP11B2 codant l’aldostérone synthase. C. Les mutations gain de fonction de KCNJ5, qui affectent le canal GIRK4, ainsi que les mutations de la pompe Na+,K+-ATPase (par mutation du gène ATP1A1), modifient les concentrations intracellulaires en Na+, conduisant à la dépolarisation de la membrane plasmique et ainsi à l’ouverture des canaux Ca2+ dépendants du voltage. D. Les mutations du gène ATP2B3 qui code la pompe Ca2+ membranaire PMCA3, et les mutations du gène CACNA1D qui affectent la sous-unité Cav1.3 du canal Ca2+ de type L, ont des conséquences directes sur les concentrations intracellulaires en Ca2+ en affectant directement l’influx et le recyclage du Ca2+. Toutes ces anomalies génétiques conduisent finalement à l’activation de la signalisation calcique et à l’augmentation de la biosynthèse d’aldostérone. Flèche pleine, activation directe ; flèche hachurée, activation indirecte nécessitant des étapes intermédiaires. |
|
L’équilibre ionique au centre de la pathogenèse des adénomes produisant de l’aldostérone Mutations du gène codant le canal ionique KCNJ5 La comparaison, chez un même patient, des séquences d’exomes de l’ADN constitutionnel et de l’ADN (ADN somatique) extrait d’adénomes produisant de l’aldostérone a permis d’identifier des mutations somatiques récurrentes dans des gènes codant des canaux ioniques ( KCNJ5
2 [ 8] et CACNA1D
3 [ 9, 10]) et des ATPases ( ATP1A1 et ATP2B3 [ 11]) impliqués dans la régulation de l’homéostasie ionique intracellulaire et du potentiel de membrane (Figure 1). Il est à noter qu’aucune mutation germinale n’a été identifiée chez des patients ayant un adénome porteur de mutations somatiques. KCNJ5 code le canal potassique GIRK4 ( G protein-activated inward rectifier potassium channel 4). Toutes les mutations KCNJ5 identifiées dans l’APA, de même que les différentes mutations germinales identifiées dans l’hyperaldostéronisme familial de type III (FH-III, voir ci-dessous), sont localisées au niveau de l’exon 2. Les deux mutations les plus fréquentes sont la p.Gly151Arg et la p.Leu168Arg, mais d’autres mutations localisées à proximité ont également été décrites. Toutes ces mutations sont localisées dans, ou à proximité du, filtre de sélectivité de GIRK4 et affectent la sélectivité ionique du canal. Le filtre permet le passage sélectif du K + à travers le pore du canal. Les mutations induisent une augmentation de la conductance Na + du canal qui conduit à un influx de cet ion dans la cellule et, par conséquent, à une dépolarisation chronique de la membrane plasmique. Cela déclenche l’ouverture de canaux Ca 2+ dépendants du voltage et l’activation de la voie de signalisation calcique, stimulant la production d’aldostérone. La surexpression de différents canaux mutés dans une lignée cellulaire de cortex surrénalien induit une augmentation de l’expression de CYP11B2 et de la production d’aldostérone, ainsi que de celle de deux des régulateurs transcriptionnels de CYP11B2, NURR1 ( nuclear receptor related 1 protein, codé par NR4A2 [nuclear receptor subfamily 4, group A, member]) et NOR-1 ( neuron-derived orphan receptor 1, codé par NR4A3 [nuclear receptor subfamily 4, group A, member 3]) [ 12, 13]. Mutations de ATP1A1, ATP2B3 et CACNA1D Plus récemment, des mutations somatiques récurrentes dans deux autres gènes, ATP1A1 et ATP2B3, codant des membres de la famille des ATPases de type-P ont été identifiées dans les adénomes produisant de l’aldostérone [ 11] (Tableau I). ATP1A1 code la sous-unité a1 de la Na +,K +-ATPase et ATP2B3 code la pompe PMCA3 ( plasma membrane calcium-transporting ATPase 3). Des mutations dans le gène CACNA1D, codant la sous-unité a1 (Cav1.3) du canal Ca 2+ du type L ( voltage-dependent L-type calcium channel subunit alpha-1D), ont également été identifiées. [ 9, 10]. Les mutations de la sous-unité a1 de la Na +,K +-ATPase affectent des résidus particuliers localisés au niveau des hélices transmembranaires M1 et M4 de la protéine, et impliqués dans l’interaction avec le Na + et/ou le K +. Elles conduisent à une perte de l’activité de la pompe et une réduction importante de l’affinité pour le K +, ainsi qu’à une fuite entrante de protons ou de Na +. Il en résulte une augmentation de la production d’aldostérone consécutive à une dépolarisation de la membrane plasmique, et une augmentation de l’influx calcique ; ce mécanisme est similaire à celui observé pour les mutations KCNJ5 [ 9, 11]. Des mesures électrophysiologiques réalisées sur des cultures primaires de cellules issues d’adénomes produisant de l’aldostérone révèlent une dépolarisation inappropriée des cellules porteuses de mutations ATP1A1 [ 11]. Les mutations PMCA3 et Cav1.3, quant à elles, affectent directement l’homéostasie intracellulaire du calcium. Les mutations de PMCA3 touchent des résidus hautement conservés, localisés au niveau de l’hélice transmembranaire M4 qui serait impliquée dans l’interaction avec le Ca 2+. Elles entraînent une distorsion du site de liaison du Ca 2+, ce qui affecte la clairance intracellulaire de ce cation. Les mutations somatiques affectant Cav1.3 sont localisées au niveau de domaines impliqués dans l’activation du canal calcique et la sensibilité au potentiel de membrane, ainsi qu’au niveau du domaine cytoplasmique couplant le domaine de sensibilité au potentiel et le pore du canal. Les mutations modifient la sensibilité du canal au potentiel de membrane, décalant son activation pour des potentiels de membrane plus négatifs ou retardant son inactivation. Elles conduisent, comme les mutations ATP2B3, à une altération de l’homéostasie du calcium intracellulaire.
Tableau I.
| Gène |
Protéine |
Fréquence des mutations somatiques dans l’APA |
Présence des mutations dans l’HAP familial |
|
KCNJ5
|
Canal potassique GIRK4 |
38 % |
FH3 (sévérité selon le type de mutation) |
|
|
CACNA1D
|
Sous-unité α1 (Cav1.3) du canal Ca2+ de type L |
9,3 % |
Mutations constitutionnelles de novo dans l’HAP avec syndrome neurologique complexe |
|
|
ATP1A1
|
Sous-unité α1 de la Na+, K+-ATPase |
5,3 % |
Non |
|
|
ATP2B3
|
Pompe calcique PMCA3 |
1,7 % |
Non |
|
|
CYP11B1/B2*
|
11β hydroxylase et aldostérone synthase |
|
FH1 |
Mutations somatiques et constitutionnelles dans les adénomes produisant de l’aldostérone et l’hyperaldostéronisme familial. *Bien que le FH-I n’ait pas été discuté dans le texte, cette forme d’hyperaldostéronisme familial a été ajoutée au tableau pour des raisons d’exhaustivité. Le FH-I est dû à la formation d’un gène chimérique entre CYP11B1 (codant la 11β hydroxylase) et CYP11B2 (codant l’adostérone synthase). Ainsi l’activité de l’aldostérone synthase est placé sous le contrôle des régions régulatrice de la 11β hydroxylase et la production d’aldostérone est donc contrôlée par l’ACTH (adrenocorticotrophic hormone) et non pas par le système rénine-angiotensine et le potassium. |
épidémiologie et corrélations génotype-phénotype Différentes études sur des cohortes de patients assez larges ont établi la fréquence des mutations somatiques dans les adénomes produisant de l’aldostérone. Ainsi, deux études multicentriques consécutives réalisées au sein du réseau européen d’étude des tumeurs de la surrénales 4 ont évalué l’éventail génétique et les corrélations cliniques des mutations somatiques chez les patients porteurs d’adénomes produisant de l’aldostérone [ 14, 15]. L’analyse de 474 patients issus de sept centres différents a identifié des mutations somatiques chez 54 % des patients porteurs d’adénomes ; cette prévalence varie de 27,2 % à 56,8 % selon les centres. Les mutations KCNJ5 sont les anomalies génétiques les plus fréquentes (prévalence de 38 %) ; les mutations ATP1A1 et ATP2B3 sont présentes respectivement dans 5,3 % et 1,7 % des adénomes produisant de l’aldostérone. La fréquence de ces mutations concorde avec celle rapportée à partir d’autres cohortes [ 9, 11, 16], bien que les mutations KCNJ5 soient plus ou moins fréquentes dans certaines populations et selon les procédures diagnostiques utilisées [ 14, 17, 18]. Les mutations du gène CACNA1D sont les secondes mutations les plus fréquentes après les mutations KCNJ5 et leur prévalence est de 9,3 % [ 15]. L’analyse de la corrélation entre les données génétiques et les paramètres cliniques et biologiques a montré que les mutations KCNJ5 étaient plus fréquentes chez les femmes, et diagnostiquées plus précocement que les mutations CACNA1D [ 15] ; les mutations CACNA1D sont, quant à elles, présentes dans des adénomes plus petits. Il n’y a pas d’association entre le statut mutationnel et les taux plasmatiques d’aldostérone, de rénine, ni avec le rapport aldostérone sur rénine en préopératoire, ou le nombre de médicaments pris avant la chirurgie. Il n’y a pas de corrélation non plus avec la valeur de la tension artérielle postopératoire. Dans une autre étude multicentrique, les mutations ATP1A1 et ATP2B3 étaient plus fréquentes chez les hommes, et associées à une aldostéronémie plus élevée et une kaliémie plus basse [ 11]. |
Anomalies de KCNJ5 dans l’hyperaldostéronisme primaire familial Alors que la majorité des cas d’hyperaldostéronisme primaire sont sporadiques, 1 à 5 % des cas sont des formes familiales. Trois formes de transmission mendélienne ont été décrites : l’hyperaldostéronisme familial de type I (FH-I), de type II (FH-II) et de type III (FH-III). À la différence du FH-I, dont la base génétique, notamment la présence d’un gène chimérique CYP11B1/B2, a été établie il y a environ vingt ans déjà [19, 20] (et qui ne sera pas discuté dans cette revue), la compréhension des causes génétiques du FH-III et de certains cas de FH-II est en relation directe avec les découvertes récentes de génétique somatique dans les adénomes produisant de l’aldostérone (Tableau I). Le FH-II est une forme familiale d’hyperaldostéronisme qui n’est pas sensible aux glucocorticoïdes5 [21], et se transmet sur un mode autosomique dominant [20, 22]. La prévalence du FH-II est estimée autour de 1,2 % à 6 % dans des populations adultes avec hyperaldostéronisme primaire [23, 24]. Le phénotype est variable et des adénomes produisant de l’aldostérone et/ou des hyperplasies bilatérales des surrénales peuvent être présents dans la même famille. Sur les plans clinique et biochimique, le FH-II ne se distingue pas des formes sporadiques et n’est diagnostiqué que lorsque deux membres au moins sont atteints dans la même famille. L’origine génétique du FH-II n’est pas connue ; une liaison entre le FH-II et la région chromosomique 7p22 a été établie chez certaines familles [25], sans qu’aucune mutation n’ait cependant été identifiée dans cette région. Récemment, des mutations germinales particulières de KCNJ5 ont été trouvées chez des patients atteints d’un hyperaldostéronisme primaire considéré comme FH-II en raison d’une méconnaissance de l’hétérogénéité phénotypique du FH-III (voir plus loin) [26]. De plus, des mutations somatiques de KCNJ5 ont été rapportées dans des adénomes produisant de l’aldostérone chez des sujets FH-II [26]. Compte tenu de la fréquence élevée d’un hyperaldostéronisme primaire chez les sujets hypertendus, il pourrait s’agir de l’association fortuite, dans la même famille, de patients atteints d’hyperaldostéronisme sporadique. Une autre hypothèse est la présence d’un déterminant polygénique de l’hyperaldostéronisme sur un fond génétique prédisposant à un hyperaldostéronisme familial, qui se manifesterait sous la forme d’un adénome uniquement chez les patients porteurs de mutations KCNJ5. Le FH-III a été décrit pour la première fois en 2008 chez un père et ses deux filles présentant une HTA sévère précoce, résistante au traitement et associée à une hypokaliémie profonde [27]. Les trois sujets atteints présentaient un hyperaldostéronisme primaire non suppressible par les glucocorticoïdes, des niveaux élevés de stéroïdes hybrides 18-oxocortisol et 18-hydroxycortisol, et une hyperplasie massive du cortex surrénalien, nécessitant une surrénalectomie bilatérale afin de contrôler la pression artérielle [27]. Récemment, l’origine génétique du FH-III dans cette famille a été attribuée à la mutation p.Thr158Ala du gène KCNJ5 [8]. Comme c’est le cas pour les mutations somatiques décrites dans les adénomes produisant de l’aldostérone, cette mutation est localisée à proximité du motif GYG qui confère à GIRK4 sa sélectivité pour le K+. Comme les autres mutations, celle-ci entraîne une perte de sélectivité pour le K+ et un influx de Na+ dans la cellule résultant en une dépolarisation de la membrane plasmique et une activation de canaux Ca2+ dépendants du voltage, conduisant à une accumulation de Ca2+ intracellulaire [13]. Différentes autres mutations germinales de KCNJ5 ont été décrites dans des familles de type FH-III. La sévérité de l’hyperaldostéronisme primaire dépend du type de mutation. Les mutations p.Gly151Arg (mutation identique à l’une des mutations récurrentes décrites dans l’APA), p.Thr158Ala et p.Ile157Ser entraînent toutes un phénotype sévère avec une HTA précoce résistante au traitement [8, 28], alors que le phénotype associé aux mutations KCNJ5 p.Gly151Glu et p.Tyr152Cys est plus modéré, similaire à celui qui prévaut dans le FH-II [26, 29, 30]. Des études in vitro ont démontré que, comme le font d’autres mutations, la mutation p.Gly151Glu altère la sélectivité du canal GIRK4. Cependant, cette mutation confère une conductance Na+ plus élevée que les autres mutations, induisant une mort cellulaire rapide dépendante du Na+ ; celle-ci pourrait, in vivo, limiter la prolifération des cellules du cortex surrénalien et la sévérité de l’hyperaldostéronisme, expliquant le phénotype plus modéré des familles porteuses de la mutation p.Gly151Glu ainsi que l’absence d’hyperplasie de la surrénale [26, 30]. L’existence d’une corrélation stricte entre le génotype et le phénotype a été récemment nuancée par la description d’un patient porteur d’une mutation hétérozygote germinale p.Gly151Arg, qui avait développé une polyurie à l’âge de 18 mois et une hypertension avec hypokaliémie à 4 ans. Par la suite, son hyperaldostéronisme a été traité avec succès durant sept ans avec de la spironolactone6 sans que soit observé un élargissement de la surrénale [31]. Dans tous les cas, la recherche de mutations dans le gène KCNJ5 doit être considérée même dans les formes familiales modérées d’HAP. |
Des mutations constitutionnelles de KCNJ5 et CACNA1D dans l’hyperaldostéronisme primaire sporadique Récemment, la région codante du gène KCNJ5 a été séquencée à partir de l’ADN leucocytaire de 251 patients atteints d’hyperaldostéronisme primaire sporadique [32]. Trois mutations hétérozygotes faux-sens (p.Arg52His, p.Glu246Lys et p.Gly247Arg), situées hors du filtre de sélectivité de GIRK4, ont été identifiées. De plus, 5 % des patients étaient porteurs de polymorphismes rares (rs7102584, p.Glu282Gln). Les études fonctionnelles ont montré que, bien que localisées à l’extérieur du filtre de sélectivité, les mutations p.Arg52His et p.Glu246Lys altèrent les propriétés du canal dans l’oocyte de xénope ainsi que dans les cellules de cortex surrénalien H295R, induisant une dépolarisation de la membrane cellulaire et potentialisant l’effet stimulant de l’AngII sur la biosynthèse d’aldostérone [32]. Dans la même étude, la surexpression, dans les cellules H295R, d’un canal GIRK4 porteur du polymorphisme rs7102584 altère la viabilité cellulaire. Les auteurs suggèrent que des variations constitutionnelles du gène KCNJ5 pourraient jouer un rôle dans les formes communes sporadiques d’hyperaldostéronisme primaire [32]. Des mutations constitutionnelles de novo du gène CACNA1D ont été décrites chez des sujets ayant une HTA précoce, un hyperaldostéronisme primaire et un tableau neurologique complexe [10]. Chez le premier patient, l’HTA était présente dès la naissance ainsi qu’une hypertrophie biventriculaire, et les signes d’hyperaldostéronisme primaire à l’âge d’un mois. Ces signes s’associaient à un tableau neurologique comprenant des convulsions, une paralysie cérébrale apparente, une cécité corticale et des anomalies neuromusculaires. L’utilisation d’un inhibiteur calcique, l’amlodipine, normalisait la pression artérielle. Une mutation germinale a été identifiée dans l’exon 8B du gène CACNA1D sous la forme de la substitution d’une glycine par une asparagine en position 403 (p.Gly403Asp). Des mutations somatiques du même résidu du gène CACNA1D (p.Gly403Arg) ont été identifiées dans les adénomes produisant de l’aldostérone [9, 10, 15]. L’analyse fonctionnelle du canal porteur de cette mutation a montré une activation à des potentiels plus bas que le canal sauvage [10]. Le second patient, qui présentait dès la naissance une paralysie cérébrale et des convulsions complexes, a développé une HTA et un hyperaldostéronisme primaire à l’âge de 5 ans, en l’absence d’anomalies des surrénales et d’histoire familiale d’HTA précoce. Une mutation germinale de novo, p.Ile770Met, a été identifiée ; elle est également retrouvée dans des adénomes produisant de l’aldostérone. L’étude des caractéristiques fonctionnelles des canaux portant ces mutations dans les cellules H295R a montré une activation des courants calciques à des potentiels plus bas que le canal non muté [10]. Ces mutations germinales induiraient, à nouveau, une augmentation des concentrations intracellulaires en Ca2+, résultant en une activation de la voie de signalisation calcique et une augmentation de la production d’aldostérone. |
Perspectives pour le diagnostic et la prise en charge de l’hyperaldostéronisme primaire Les formes familiales d’hyperaldostéronisme primaire représentent environ 5 % des cas, et les anomalies génétiques n’ont été identifiées que dans le FH-I (gène chimérique CYP11B1/CYP11B2) et le FH-III (KCNJ5). Des mutations somatiques récurrentes des gènes KCNJ5, ATP1A1, ATP2B3 et CACNA1D sont présentes dans plus de la moitié des adénomes produisant de l’aldostérone. Alors que le diagnostic génétique des mutations récurrentes de KCNJ5, ATP1A1 et ATP2B3 est relativement simple et peut facilement être transféré en routine hospitalière, le nombre important de mutations différentes localisées dans différentes régions du canal Cav1.3 implique un séquençage génétique large de CACNA1D dans les adénomes produisant de l’aldostérone. Les corrélations génotype-phénotype ont montré que les patients porteurs de mutations KCNJ5 sont plus fréquemment des femmes, sont diagnostiqués plus jeunes, et ont des concentrations plasmatiques minimales en potassium plus élevées ; la mutation de CACNA1D est, quant à elle, associée à des adénomes plus petits [15]. Une question dont les conséquences cliniques sont importantes est celle de l’influence des mutations sur le diagnostic final d’hyperaldostéronisme primaire, les options et/ou le suivi thérapeutiques. La présence de mutations KCNJ5 a été associée à un index de latéralisation7 plus élevé lors du cathétérisme des veines surrénaliennes [33]. Il est donc probable que les patients porteurs de mutations KCNJ5 soient plus facilement identifiés au moment du cathétérisme des veines surrénaliennes et, ainsi, bénéficient plus tôt d’une surrénalectomie. Néanmoins, ces résultats n’ont pas été confirmés, et une autre étude ne retrouve aucun impact clinique du statut mutationnel sur les gradients de stéroïdes lors du cathétérisme des veines surrénaliennes [34]. Les complications cardiovasculaires dues à l’excès d’aldostérone dans les adénomes produisant de l’aldostérone ont été corrélées au profil des mutations dans deux larges études incluant plus de 100 patients [17, 18]. Bien que la fréquence des mutations diffère de façon significative (26 % [18] contre 69,4 % [17]), des taux plus élevés d’aldostérone plasmatique étaient associés à des mutations KCNJ5 dans les deux études. Rossi et al. ont également observé des anomalies cardiovasculaires plus sévères, avec un index de masse ventriculaire gauche plus élevé, chez les sujets porteurs de mutations KCNJ5 par rapport aux patients non porteurs de mutations. Cependant, une régression similaire de l’hypertrophie ventriculaire gauche était observée dans les deux groupes après surrénalectomie [17, 18]. Dans les deux études, l’amélioration de l’index de masse ventriculaire gauche était indépendamment associée aux mutations KCNJ5. Ces résultats soulignent qu’il est important d’identifier très tôt les patients porteurs de mutations KCNJ5, car ces patients pourraient être à risque de complications cardiovasculaires plus sévères. La connaissance de la pharmacologie des canaux et pompes mutés est utile à l’interprétation des données expérimentales et cliniques, et pourrait également se révéler importante pour le développement de nouveaux traitements dans l’APA. Il a été montré que les mutations somatiques KCNJ5 confèrent une perméabilité pathologique au Na+ aux canaux GIRK4 mutés [8], conduisant à une augmentation de la production d’aldostérone via des mécanismes dépendants du Ca2+ [12, 13]. L’augmentation des concentrations intracellulaires en Ca2+ est supposée être due à l’ouverture de canaux Ca2+ dépendants du voltage. De façon intéressante, dans les cellules corticosurrénaliennes NCI-H295R, des concentrations élevées de Na+ intracellulaire empêcheraient également l’export de Ca2+via l’échangeur Na+/Ca2+ (NCX), résultant en un influx de Ca2+ au travers de NCX qui fonctionnerait alors en mode de transport inversé [35]. Alors que le canal GIRK4 sauvage est inhibé par la Tertiapin-Q [36], les canaux mutés ne le sont que faiblement [35]. Des études in vitro ont même montré que le canal GIRK4 porteur de la mutation p.Leu168Arg était inhibé par l’amiloride, et de façon encore plus puissante par le vérapamil, antagoniste des canaux Ca2+ de type-L. Les mutants p.Gly151Arg et p.Thr158Ala sont également bloqués par le vérapamil, mais de façon moins puissante [35]. Le vérapamil n’agirait donc pas uniquement sur la production d’aldostérone en inhibant les canaux Ca2+ dépendants du voltage activés par la dépolarisation, mais également en bloquant le canal muté. Les antagonistes calciques sont utilisés dans le traitement des patients avec hyperaldostéronisme primaire ; ils diminuent non seulement la pression artérielle, mais également les taux plasmatiques d’aldostérone [37, 38]. Chez l’un des deux patients porteurs d’une mutation germinale de CACNA1D (voir ci-dessus), l’utilisation de l’amlodipine a permis la normalisation de la pression artérielle [10]. Ces données suggèrent qu’un traitement spécifique serait possible chez les patients porteurs de mutations KCNJ5 et CACNA1D. Il serait particulièrement pertinent d’identifier des biomarqueurs associés au statut mutationnel, ce qui permettrait de stratifier les patients et de leur administrer un traitement ciblé avant la chirurgie. Dans le futur, il devrait être possible de détecter la présence de mutations somatiques dans l’ADN libre circulant libéré lors du renouvellement des cellules des adénomes produisant de l’aldostérone. Cela constituerait une méthode de dépistage sensible et non invasive de cette maladie, particulièrement précieuse pour les mutations KCNJ5 qui sont présentes dans la majorité des cas. |
Des avancées majeures ont été réalisées récemment dans l’analyse des bases génétiques et mécanistiques des formes sporadiques et familiales d’hyperaldostéronisme primaire. L’analyse, dans le futur, d’un grand nombre d’échantillons apportera certainement des informations précieuses permettant d’expliquer l’origine des 50 % restants d’adénomes produisant de l’aldostérone sporadiques, ainsi que celle des formes familiales pour lesquelles les anomalies génétiques ne sont pas encore identifiées. D’autres questions restent en suspens ; elles concernent notamment l’existence de gènes de susceptibilité impliqués dans le développement des formes bilatérales d’hyperaldostéronisme primaire, ou encore les mécanismes communs de prolifération du cortex surrénalien et/ou de production d’aldostérone qui pourraient être impliqués à la fois dans la formation des adénomes produisant de l’aldostérone et des hyperplasies bilatérales. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Calhoun DA, Zaman MA, Nishizaka MK. Resistant hypertension . Curr Hypertens Rep. 2002; ; 4 : :221.–228. 2.
Savard S, Amar L, Plouin PF, Steichen O. Cardiovascular complications associated with primary aldosteronism: a controlled cross-sectional study . Hypertension. 2013; ; 62 : :331.–336. 3.
Rossi GP, Sacchetto A, Pavan E, et al. Remodeling of the left ventricle in primary aldosteronism due to Conn’s adenoma . Circulation. 1997; ; 95 : :1471.–1478. 4.
Freel EM, Mark PB, Weir RA, et al. Demonstration of blood pressure-independent noninfarct myocardial fibrosis in primary aldosteronism: a cardiac magnetic resonance imaging study . Circ Cardiovasc Imaging. 2012; ; 5 : :740.–747. 5.
Rossi GP, Cesari M, Cuspidi C, et al. Long-term control of arterial hypertension and regression of left ventricular hypertrophy with treatment of primary aldosteronism . Hypertension. 2013; ; 62 : :62.–69. 6.
Rossi GP, Bolognesi M, Rizzoni D, et al. Vascular remodeling and duration of hypertension predict outcome of adrenalectomy in primary aldosteronism patients . Hypertension. 2008; ; 51 : :1366.–1371. 7.
Spat A, Hunyady L. Control of aldosterone secretion: a model for convergence in cellular signaling pathways . Physiol Rev. 2004; ; 84 : :489.–539. 8.
Choi M, Scholl UI, Yue P, et al. K+ channel mutations in adrenal aldosterone-producing adenomas and hereditary hypertension . Science. 2011; ; 331 : :768.–772. 9.
Azizan EA, Poulsen H, Tuluc P, et al. Somatic mutations in ATP1A1 and CACNA1D underlie a common subtype of adrenal hypertension . Nat Genet. 2013; ; 45 : :1055.–1060. 10.
Scholl UI, Goh G, Stolting G, et al. Somatic and germline CACNA1D calcium channel mutations in aldosterone-producing adenomas and primary aldosteronism . Nat Genet. 2013; ; 45 : :1050.–1054. 11.
Beuschlein F, Boulkroun S, Osswald A, et al. Somatic mutations in ATP1A1 and ATP2B3 lead to aldosterone-producing adenomas and secondary hypertension . Nat Genet. 2013; ; 45 : :440.–444. 12.
Monticone S, Hattangady NG, Nishimoto K, et al. Effect of KCNJ5 mutations on gene expression in aldosterone-producing adenomas and adrenocortical cells . J Clin Endocrinol Metab. 2012; ; 97 : :E1567.–E1572. 13.
Oki K, Plonczynski MW, Luis Lam M, et al. Potassium channel mutant KCNJ5 T158A expression in HAC-15 cells increases aldosterone synthesis . Endocrinology. 2012; ; 153 : :1774.–1782. 14.
Boulkroun S, Beuschlein F, Rossi GP, et al. Prevalence, clinical, and molecular Correlates of KCNJ5 mutations in primary aldosteronism . Hypertension. 2012; ; 59 : :592.–598. 15.
Fernandes-Rosa FL, Williams TA, Riester A, et al. Genetic spectrum and clinical correlates of somatic mutations in aldosterone-producing adenoma . Hypertension. 2014; ; 64 : :354.–361. 16.
Williams TA, Monticone S, Schack VR, et al. Somatic ATP1A1, ATP2B3, and KCNJ5 mutations in aldosterone-producing adenomas . Hypertension. 2014; ; 63 : :188.–195. 17.
Kitamoto T, Suematsu S, Matsuzawa Y, et al. Comparison of cardiovascular complications in patients with and without KCNJ5 gene mutations harboring aldosterone-producing adenomas . J Atheroscler Thromb. 2014 ; doi : doi.org/10.5551/jat.24455. 18.
Rossi GP, Cesari M, Letizia C, et al. KCNJ5 gene somatic mutations affect cardiac remodelling but do not preclude cure of high blood pressure and regression of left ventricular hypertrophy in primary aldosteronism . J Hypertens. 2014;; 32 : :1514.–1521; discussion 22. 19.
Lifton RP, Dluhy RG, Powers M, et al. A chimaeric 11 beta-hydroxylase/aldosterone synthase gene causes glucocorticoid-remediable aldosteronism and human hypertension . Nature. 1992; ; 355 : :262.–265. 20.
Stowasser M, Gordon RD. Primary aldosteronism: learning from the study of familial varieties . J Hypertens. 2000; ; 18 : :1165.–1176. 21.
Gordon RD, Stowasser M, Tunny TJ, et al. Clinical and pathological diversity of primary aldosteronism, including a new familial variety . Clin Exp Pharmacol Physiol. 1991; ; 18 : :283.–286. 22.
Stowasser M, Gordon RD. Familial hyperaldosteronism . J Steroid Biochem Mol Biol. 2001; ; 78 : :215.–229. 23.
Medeau V, Assie G, Zennaro MC, et al. Aspect familial de l’hyperaldostéronisme primaire : analyse de familles compatibles avec un with hyperaldostéronisme primaire de type 2 . Ann Endocrinol (Paris). 2005; ; 66 : :240.–246. 24.
Mulatero P, Tizzani D, Viola A, et al. Prevalence and characteristics of familial hyperaldosteronism: the PATOGEN study (Primary Aldosteronism in TOrino-GENetic forms) . Hypertension. 2011; ; 58 : :797.–803. 25.
Lafferty AR, Torpy DJ, Stowasser M, et al. A novel genetic locus for low renin hypertension: familial hyperaldosteronism type II maps to chromosome 7 (7p22) . J Med Genet. 2000; ; 37 : :831.–835. 26.
Mulatero P, Tauber P, Zennaro MC, et al. KCNJ5 mutations in European families with nonglucocorticoid remediable familial hyperaldosteronism . Hypertension. 2012; ; 59 : :235.–240. 27.
Geller DS, Zhang J, Wisgerhof MV, et al. A novel form of human mendelian hypertension featuring nonglucocorticoid-remediable aldosteronism . J Clin Endocrinol Metab. 2008; ; 93 : :3117.–3123. 28.
Charmandari E, Sertedaki A, Kino T, et al. A novel point mutation in the KCNJ5 gene causing primary hyperaldosteronism and early-onset autosomal dominant hypertension . J Clin Endocrinol Metab. 2012; ; 97 : :E1532.–E1539. 29.
Monticone S, Hattangady NG, Penton D, et al. A novel Y152C KCNJ5 mutation responsible for familial hyperaldosteronism type III . J Clin Endocrinol Metab. 2013; ; 98 : :E1861.–E1865. 30.
Scholl UI, Nelson-Williams C, Yue P, et al. Hypertension with or without adrenal hyperplasia due to different inherited mutations in the potassium channel KCNJ5 . Proc Natl Acad Sci USA. 2012; ; 109 : :2533.–2538. 31.
Adachi M, Muroya K, Asakura Y, et al. Discordant genotype-phenotype correlation in familial hyperaldosteronism type III with KCNJ5 gene mutation: A patient report and review of the literature . Horm Res Paediatr. 2014; ; 82 : :138.–142. 32.
Murthy M, Xu S, Massimo G, et al. Role for germline mutations and a rare coding single nucleotide polymorphism within the KCNJ5 potassium channel in a large cohort of sporadic cases of primary aldosteronism . Hypertension. 2014; ; 63 : :783.–789. 33.
Seccia TM, Mantero F, Letizia C, et al. Somatic mutations in the KCNJ5 gene raise the lateralization index: implications for the diagnosis of primary aldosteronism by adrenal vein sampling . J Clin Endocrinol Metab. 2012; ; 97 : :E2307.–E2313. 34.
Osswald A, Fischer E, Degenhart C, et al. Lack of influence of somatic mutations on steroid gradients during adrenal vein sampling in aldosterone-producing adenoma patients . Eur J Endocrinol. 2013; ; 169 : :657.–663. 35.
Tauber P, Penton D, Stindl J, et al. Pharmacology and pathophysiology of mutated KCNJ5 found in adrenal aldosterone-producing adenomas . Endocrinology. 2014; ; 155 : :1353.–1362. 36.
Jin W, Klem AM, Lewis JH, Lu Z. Mechanisms of inward-rectifier K+ channel inhibition by tertiapin-Q . Biochemistry. 1999; ; 38 : :14294.–14301. 37.
Aritomi S, Konda T, Yoshimura M. L/N-type calcium channel blocker suppresses reflex aldosterone production induced by antihypertensive action . Heart Vessels. 2012; ; 27 : :419.–423. 38.
Tanaka T, Tsutamoto T, Sakai H, et al. Comparison of the effects of efonidipine and amlodipine on aldosterone in patients with hypertension . Hypertens Res. 2007; ; 30 : :691.–697. |