| |
| Med Sci (Paris). 2015 April; 31(4): 360–362. Published online 2015 May 8. doi: 10.1051/medsci/20153104005.Lymphome folliculaire Une histoire de perversion de la mémoire immunologique Sandrine Roulland1,2,3 and Bertrand Nadel1,2,3* 1Centre d’immunologie de Marseille Luminy, Université Aix-Marseille, Parc scientifique et technologique de Luminy, Case 906, 13288Marseille cedex 9, France 2Inserm U1104, Marseille, France 3CNRS UMR7280, Marseille, France MeSH keywords: Adulte, Animaux, Formation de concepts, Humains, Mémoire immunologique, Lymphome folliculaire, Souris, Souris transgéniques, Protéines proto-oncogènes c-bcl-2, génétique, physiologie, immunologie |
Le lymphome folliculaire est la 2e hémopathie lymphoïde de l’adulte en termes de fréquence, et, en dépit de l’introduction d’immunothérapies ciblées (dont le Rituximab1) au cours des années 2000, reste un cancer incurable [1]. L’évolution préclinique est généralement indolente et insidieuse, progressant sans symptôme clinique manifeste pendant plusieurs dizaines d’années. Le diagnostic est de fait généralement tardif et le traitement instauré alors que le clone tumoral est déjà largement disséminé. Au cours des lignes successives du traitement actuel de référence (R-CHOP2 ou équivalent), les rechutes sont quasi-inéluctables, récurrentes, et acquièrent une résistance croissante aux traitements. Grâce au fantastique essor de la génomique, il est apparu au cours de ces dernières années qu’à l’instar de nombreuses autres tumeurs, les rechutes sont rarement le résultat de l’évolution directe des clones tumoraux présents au moment du diagnostic, mais au contraire sont issues de clones ancestraux, prétumoraux, vraisemblablement présents plusieurs années avant même l’apparition de la tumeur [2–6]. Par analogie avec les leucémies myéloïdes, ces entités prétumorales sont souvent assimilées au concept des cellules souches cancéreuses, bien que pour le lymphome folliculaire, la définition phénotypique et la démonstration fonctionnelle restent spéculatives à ce jour. La dissection de ces mécanismes est un défi majeur, qui pourrait mener au développement d’approches curatives basées sur l’éradication des précurseurs engagés. Au niveau biologique, le lymphome folliculaire est un lymphome B mature issu de la transformation maligne de lymphocytes B des centres germinatifs. L’acquisition précoce de la translocation BCL2/IGH
3 t(14;18)(q32;q21) lors d’erreurs de recombinaison V(D)J pendant la différenciation des cellules pré-B dans la moelle osseuse, en constitue l’événement initiateur (via l’activation constitutive de l’oncogène BCL2). Paradoxalement, il est désormais bien établi que des cellules porteuses de la translocation t(14;18) sont également retrouvées à faible fréquence (∼1 cellule/1 million) dans le sang d’individus sains, sans autre manifestation hématologique clinique (> 70 % de la population adulte) [7]. Comparé à l’incidence du lymphome folliculaire (~3-4 cas/100 000/an), il est clair que cette translocation est nécessaire, mais non suffisante, pour le développement tumoral, et que d’autres altérations, acquises au fil du temps, devront complémenter l’activité oncogénique de BCL2 pour enclencher le développement tumoral. |
Quels sont les mécanismes menant à l’engagement des cellules t(14;18) dans la transformation maligne ? La démonstration récente que les cellules B mémoires peuvent réintégrer les centres germinatifs et y déclencher de nouveaux cycles de maturation lors de stimulations antigéniques secondaires [8] nous a suggéré l’idée suivante : l’accumulation d’évènements menant au développement du lymphome folliculaire requiert des passages successifs dans les centres germinatifs, favorisant une instabilité génomique croissante via le « mutateur » AID4, (activation induced cytidine deaminase) ; et l’expression constitutive de BCL2 jouerait un rôle moteur dans l’initiation et la maintenance de ce cercle vicieux [7]. Cette hypothèse permettrait d’expliquer à la fois la latence et l’indolence de cette pathologie de l’adulte (moyenne 65 ans), dont le développement pourrait alors nécessiter des années, voire une vie entière de stimulations antigéniques. Pour répondre à cette question, nous avons créé un modèle murin dont l’objectif était de récapituler le plus fidèlement possible les étapes précoces de progression du lymphome folliculaire, depuis l’expression sporadique de la translocation t(14;18) chez l’individu sain (dans ~ 1 cellule sur 1 million) jusqu’aux formes les plus précoces, telles que le « lymphome folliculaire in situ » (FLIS). Le FLIS est considéré comme l’entité clinique la plus précoce du lymphome folliculaire ; celle-ci se manifeste par une colonisation partielle des centres germinatifs (en général quelques foci BCL2+ au sein de centres germinatifs normaux par ailleurs, BCL2-, sans distorsion architecturale), et progressant vers un lymphome folliculaire dans ~ 5 % des cas [9]. Dans notre modèle nommé BCL2traceur(Figure 1A), un transgène BCL2 humain (qui peut être distingué par un anticorps spécifique du Bcl2 endogène murin) est activé via une inversion V(D)J, récapitulant le caractère sporadique de t(14;18). La séquence de jonction (unique pour chaque inversion) constitue alors un marqueur spécifique de chaque clone (clonotypique) se substituant au point de cassure de t(14;18). L’étude des souris BCL2traceur montre que lors d’une immunisation courte (2 rappels), l’expression ectopique de BCL2 dans les lymphocytes B activés ne permet ni leur accumulation ni leur rétention dans les centres germinatifs, et génère, comme chez la souris sauvage, des B mémoires et des plasmocytes différenciés. En revanche, une immunisation chronique (toutes les 3 semaines pendant 9 mois) incite à la réentrée préférentielle des B mémoires BCL2+ dans les centres germinatifs et à leur expansion clonale massive, aux dépens des cellules B mémoires normales [10] (Figure 1B). Curieusement, en dépit de l’intense processus d’immunisation, la grande majorité des clones BCL2+ ne font pas de commutation de classe (voir note 4) et restent IgM+. Le transfert adoptif de ces cellules réactivées de façon répétée chez un hôte sauvage pré-immunisé démontre qu’une cellule B BCL2+ différenciée peut réintégrer un centre germinatif, s’y « dédifférencier » en centroblaste, et s’y accumuler en foci BCL2+ mimant une forme de précurseur humain de type FLIS. Il est intéressant de noter que seules les cellules B mémoires IgM+ BCL2+ ont cette propriété, ce qui pourrait expliquer la prédominance de cet isotype dans les lymphomes folliculaires, en dépit d’une activité constitutive et fonctionnelle d’AID tant au niveau des mutations somatiques5, que de la commutation de classe [7].
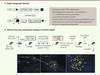 | Figure 1.
Le modèle BCL2traceur. A. Représentation schématique du module transgénique rétroviral. Un BCL2 transcriptionnellement inactif (inversé et flanqué d’un marqueur cellulaire sous IRES) est bordé de séquences signal de recombinaison V(D)J arrangées en mode inversion (triangles). Sous l’action des recombinases RAG1/2 lors du développement pré-B, le module BCL2 est inversé et placé sous le contrôle transcriptionnel (constitutif) du LTR (long terminal repeat) rétroviral. La recombinaison par inversion est relativement inefficace et se produira dans ~ 1 cellule B sur un million. La séquence formant le joint codant (CJ) est imprécise, et forme une empreinte clonale traçable par PCR. B. Représentation schématique de la stratégie de stimulation antigénique. Les cellules souches hématopoïétiques (CSH) d’une souris [AID-Cre x ROSA-EYFP] sont infectées par les rétrovirus contenant le module BCL2traceur non réarrangé, et greffées dans une souris hôte sauvage irradiée. En absence d’immunisation, la fréquence des cellules ayant réarrangé/activé le transgène BCL2 reste de ~10-6/10-5 quel que soit l’âge des souris greffées. Une stimulation antigénique répétée (ici par un antigène complexe : les globules rouges de mouton [GRM]) provoque une expansion préférentielle des cellules B BCL2+ comparé aux autres cellules B non réarrangées (BCL2-) au sein des mêmes souris. Les sous-populations B BCL2+ et contrôles sont triées par cytométrie de flux et un transfert adoptif effectué dans une nouvelle souris hôte sauvage (pré-immunisée et stimulée avec des GRM). La formation de clusters BCL2+ « FLIS-like » est observée au sein de centres germinatifs réactifs par ailleurs normaux. Marquages : EYFP (enhanced yellow fluorescent protein), cellules ayant transité par le centre germinatif et activé la EYFP via AID-Cre. GL7 : marqueur des cellules du centre germinatif. IgD : marqueur des cellules B du manteau entourant le centre germinatif ; hBCL2 : BCL2 transgénique humain. |
Ces passages répétés dans les centres germinatifs génèrent-ils une instabilité génomique particulièrement élevée dans les précurseurs BCL2+ ? Par une approche d’exome-seq6, sur les populations B mémoires purifiées, nous montrons, dans notre modèle de souris BCL2traceur immunisées en mode chronique, que la fréquence de SNV (single nucleotide variant) dans les fractions de cellules mémoire BCL2+ est significativement plus élevée que dans les fractions mémoires contrôles. Les transitions G→A et C→T sont les variations les plus fréquentes, en accord avec une activité faisant intervenir AID. Nous avons validé ces observations chez l’homme, grâce à l’analyse d’une collection unique de tissus appariés (rate, ganglions, moelle osseuse, sang) d’individus sains porteurs de la translocation t(14;18)+, notamment des donneurs d’organes. Nous montrons que comparés aux clones mémoires normaux, les clones BCL2+ sont largement disséminés (y compris dans la moelle osseuse, un site de localisation préférentiel du lymphome folliculaire mais pas des B mémoires), ont subi une expansion clonale bien plus significative, et présentent une extraordinaire diversité sous-clonale traduisant une longue histoire généalogique. De façon remarquable, les formes FLIS-like murines miment la situation observée chez l’homme : en effet, l’analyse par CGH-array haute résolution montre dans les FLIS un nombre d’altérations bien supérieur aux contreparties non tumorales, touchant notamment certains oncogènes (par exemple EZH2 [enhancer of zeste homolog 2]7,) et suppresseurs de tumeur (par ex. MLL2 [mixed-lineage leukemia protein 2], TNFRSF14 [tumor necrosis factor receptor superfamily member 14]) observés de façon récurrente dans le lymphome folliculaire [9]. De plus, une excellente correspondance existe entre le taux et la relevance/récurrence des altérations et les différents stades de progression vers le lymphome folliculaire (FLIS < lymphome folliculaire bas grade < lymphome folliculaire haut grade). Ainsi, nous montrons que la lymphomagenèse du lymphome folliculaire procède initialement d’une perversion de la dynamique et de la plasticité des lymphocytes B mémoires à la base de la maintenance de la mémoire humorale. À la suite de la t(14;18), le « 2ehit » n’est donc pas génétique, mais immunologique (extrinsèque à la cellule). Au cours du temps, la résidence prolongée et récurrente de cellules BCL2+ (et donc résistantes à l’apoptose) dans un environnement hautement mutagène (AID+) génèrerait alors une instabilité génomique propice à l’accumulation d’altérations oncogéniques complémentaires (3ehit). L’identification de ces troisièmes évènements, et le décryptage de leurs fonctions dans l’engagement, le caractère « souche » et la transformation maligne, sont les principaux objectifs de nos projets actuels. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Dreyling M, Ghielmini M, Marcus R, Salles G, Vitolo U. Newly diagnosed and relapsed follicular lymphoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up . Ann Oncol. 2011;; 22 ((suppl 6)) : :vi59.–63. 2.
Green MR, Alizadeh AA. Common progenitor cells in mature B-cell malignancies: implications for therapy . Curr Opin Hematol. 2014; ; 21 : :333.–340. 3.
Weigert O, Kopp N, Lane AA, et al. Molecular ontogeny of donor-derived follicular lymphomas occurring after hematopoietic cell transplantation . Cancer Discov. 2012; ; 2 : :47.–55. 4.
Okosun J, Bödör C, Wang J, et al. Integrated genomic analysis identifies recurrent mutations and evolution patterns driving the initiation and progression of follicular lymphoma . Nat Genet. 2013; ; 46 : :176.–181. 5.
Pasqualucci L, Khiabanian H, Fangazio M, et al. Genetics of follicular lymphoma transformation . Cell Rep. 2014; ; 6 : :130.–140. 6.
Roulland S, Kelly RS, Morgado E, et al. t(14;18) Translocation: a predictive blood biomarker for follicular lymphoma . J Clin Oncol. 2014; ; 32 : :1347.–1355. 7.
Roulland S, Faroudi M, Mamessier E, et al. Early steps of follicular lymphoma pathogenesis . Adv Immunol. 2011; ; 111 : :1.–46. 8.
Dogan I, Bertocci B, Vilmont V, et al. Multiple layers of B cell memory with different effector functions . Nat Immunol. 2009; ; 10 : :1292.–1299. 9.
Mamessier E, Song JY, Eberle FC, et al. Early lesions of follicular lymphoma: a genetic perspective . Haematologica. 2014; ; 99 : :481.–488. 10.
Sungalee S, Mamessier E, Morgado E, et al. Germinal center reentries of BCL2-overexpressing B cells drive follicular lymphoma progression . J Clin Invest. 2014; ; 124 : :5337.–5351. 11.
Catalan N, Imai K, Revy P, Fischer A, Durandy A. Deux ans après, l’activation induced cytidine deaminase n’a pas livré tous ses secrets . Med Sci (Paris). 2003; ; 19 : :139.–141. |