| |
| Med Sci (Paris). 2015 April; 31(4): 357–359. Published online 2015 May 8. doi: 10.1051/medsci/20153104004.Une seule cellule souche dans le foie : l’hépatocyte ! Hélène Gilgenkrantz1* 1Institut Cochin, Inserm U1016, CNRS UMR 8104, Université Paris-Descartes, 24, rue du faubourg saint-Jacques, 75005Paris, France MeSH keywords: Animaux, Hépatocytes, Humains, Foie, Régénération hépatique, Souris, Rats, Niche de cellules souches, Cellules souches, cytologie, physiologie |
L’hépatocyte, le super-héros de la régénération du foie après hépatectomie L’imagination « homérique » des Grecs nous a longtemps laissé croire que la capacité régénérative du foie était connue depuis l’antiquité. Pourtant, il faudra plus de 2 500 ans pour voir démontrée l’extraordinaire capacité proliférative des cellules hépatiques qui avait forgé le mythe de Prométhée. Le foie est composé pour plus de 80 % de cellules parenchymateuses au premier rang desquelles l’hépatocyte assure l’essentiel des fonctions métaboliques et de détoxication. Bien que différenciés et quiescents dans un foie non stimulé, les hépatocytes peuvent, si besoin, proliférer in situ, dotant le foie de ses extraordinaires capacités régénératives. Chez le rongeur, après une hépatectomie partielle des 2/3, la division quasi synchrone des hépatocytes matures du tiers restant du foie permet à ce dernier de recouvrer sa masse initiale en quelques jours. Dans ce contexte particulier, le foie est donc capable d’assurer son homéostasie grâce à ses seuls hépatocytes, sans avoir recours à une niche spécifique de cellules souches. Plus remarquable encore, la transplantation d’un petit nombre de ces cellules hautement différenciées dans un modèle de souris dont le foie est en destruction/renouvellement permanents permet une reconstitution quasi complète de la masse hépatique en quelques semaines en raison de l’avantage sélectif des cellules transplantées. Il est même possible de réitérer l’expérience sur une série de sept animaux consécutifs sans atteindre l’épuisement de la capacité proliférative de ces « super cellules ». |
La cellule ovale : une autre cellule progénitrice hépatique ? Pourtant, il y a peu encore, l’hépatocyte ne semblait pas être le seul garant de la régénération du foie. En effet, dans des circonstances différentes, telles qu’une agression massive aiguë chez l’homme ou l’induction d’un stimulus régénératif associé à une inhibition de la division hépatocytaire chez le rongeur, de petites cellules, dites ovales, avaient été observées dès le milieu du xxe siècle en périphérie de la veine porte, dans une région du foie appelée canal de Hering [1]. Ces cellules prolifèrent rapidement et expriment un programme à la fois cholangiocytaire et hépatocytaire. Elles sont considérées comme des cellules bipotentes intermédiaires entre cellules souches et cellules épithéliales différenciées. Ainsi, chez le rongeur soumis à certains régimes ou traitements (régime dit CDE pour déficient en choline et supplémenté en éthionine ; DDC pour 3,5-dietoxycarbonyl-1,4-dihydrocollidine ou AAF/HP associant 2-acétyl-aminofluorène à une hépatectomie partielle), la prolifération de ces petites cellules et leur différenciation en hépatocytes et en cholangiocytes permettent la régénération du foie. Chez l’homme, ces cellules sont également responsables de la réaction ductulaire observée au cours de nombreuses agressions chroniques du foie, que celles-ci soient virales, métaboliques ou toxiques [1]. L’intensité de cette réaction ductulaire est significativement corrélée à la sévérité de la fibrose hépatique [2]. Après de nombreuses années de recherches infructueuses, des marqueurs tels que Foxl1 (forkhead box L1), Sox9, Epcam (epithelial cell adhesion molecule) ou Lgr5 (leucine-rich-repeat-containing G-protein coupled receptor 5) ont permis de mieux les caractériser [3]. Le rôle de certains d’entre eux semble d’ailleurs déterminant au cours de la régénération hépatique induite par les régimes spécifiques susmentionnés (CDE, DDC, AAF/PHx). À titre d’exemple, l’ablation de cellules progénitrices Foxl1 empêche de recouvrer un foie normal après agression [4], et la transplantation de ce type de cellules dans d’autres modèles d’insuffisance hépatique permet de régénérer un foie sain. Leur origine, en revanche, restait à ce jour très controversée. |
L’hépatocyte : une cellule ovale en sommeil ? Des approches expérimentales de lignage, utilisant la recombinase Cre ou des vecteurs viraux dédiés ont été utilisées pour définir l’origine et le destin de ces cellules ovales in vivo. À l’issue d’un débat intense et souvent contradictoire, il est d’abord apparu que la proportion d’hépatocytes nouvellement formés et réellement issus de ces cellules progénitrices était faible (de l’ordre de 1 à 3 % en fonction des modèles utilisés) [5, 6]. Trois récentes publications, qui utilisent les mêmes types de régimes inducteurs de cellules ovales (CDE ou DDC chez la souris ou le rat) et des approches similaires de transplantation et de lignage, sont venues porter un coup fatal à l’essence même de ces cellules progénitrices [7–9]. La conclusion est unanime : ces cellules bipotentes sont issues d’hépatocytes matures (Figure 1). Il nous aura donc fallu pratiquement 50 ans de débats pour retourner aux fondamentaux et aboutir au constat que, comme après une hépatectomie partielle, les hépatocytes sont également responsables de la réparation du foie après une agression chronique. Cette fois cependant, la régénération passera par une dédifférenciation préalable de l’hépatocyte en une cellule progénitrice. Comment comprendre a posteriori les discordances observées ? Tout d’abord, l’expression des marqueurs ayant servi à suivre ces cellules est labile, remettant en cause l’interprétation de certains des résultats obtenus. Ainsi, l’expression de Sox9 est induite transitoirement dans des hépatocytes après administration de tamoxifène [3]. Par ailleurs, la plasticité de l’hépatocyte est remarquable. Il a par exemple été montré que l’induction de Notch suffisait à reprogrammer l’hépatocyte vers une différenciation biliaire [10], ou que l’activation de YAP dans un hépatocyte adulte [11] suffisait à le dédifférencier en cellule progénitrice, celle-ci présentant alors des caractéristiques typiques de cellules souches telles que multipotence et autorenouvellement [12]. Or, chez l’homme, l’importance de la réaction ductulaire est justement corrélée à l’accumulation nucléaire de Yap [12].
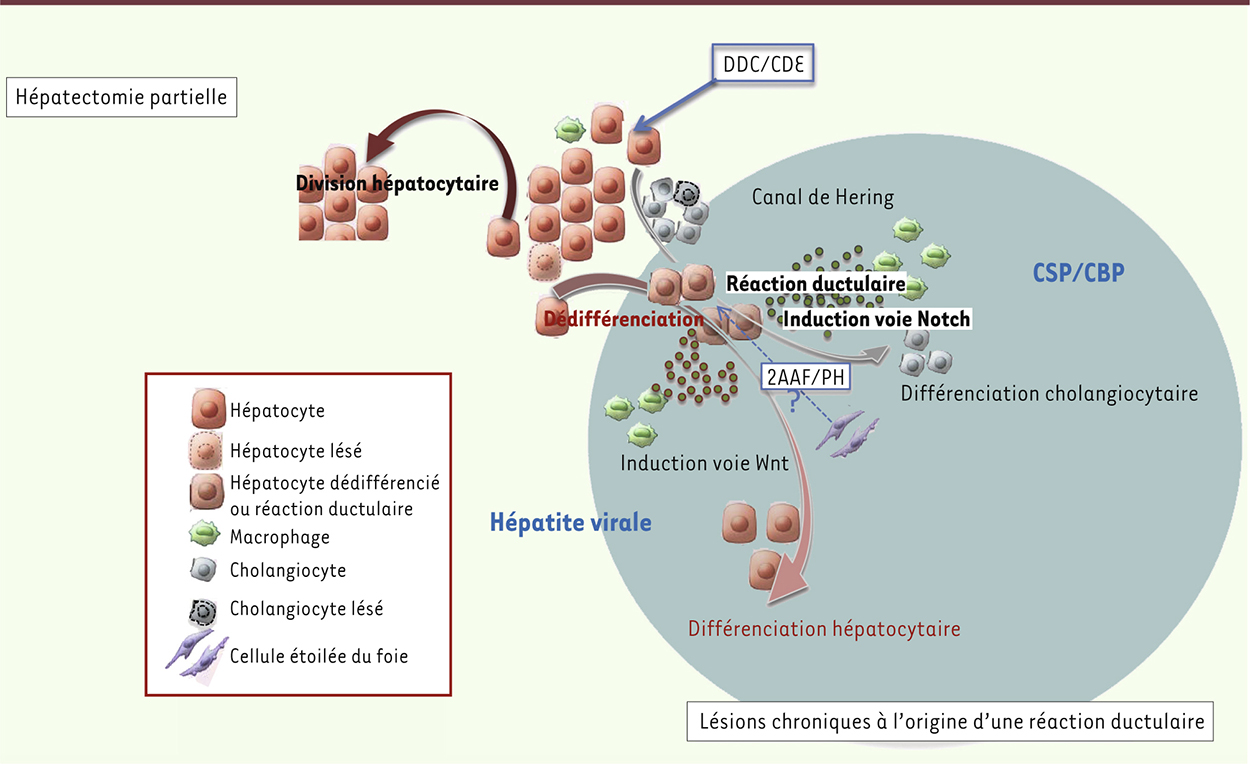
 | Figure 1.
Les cellules progénitrices bipotentes de la réaction ductulaire proviennent d’hépatocytes matures. En cas d’hépatectomie partielle (HP) ou d’agression aiguë simple, l’hépatocyte quiescent non lésé entre en division, participant ainsi à la régénération hépatique. L’agression chronique du foie chez le rongeur soumis à un régime CDE ou DDC entraîne une réaction ductulaire périportale. Les résultats récents [ 7– 9] montrent que ces cellules progénitrices proviennent d’hépatocytes matures qui acquièrent un nouveau phénotype et peuvent se différencier en hépatocytes ou en cholangiocytes. D’après des résultats antérieurs [ 14], en fonction du type d’agression chronique lésant soit les hépatocytes (hépatite chronique virale), soit les cholangiocytes (CSP pour cholangite sclérosante primitive ou CBP pour cirrhose biliaire primitive), les macrophages induiront une voie de signalisation différente, orientant les cellules de la réaction ductulaire vers l’un ou l’autre des destins cellulaires. Dans certaines conditions (traitement par le 2AAF et HP chez le rat), les cellules étoilées pourraient également contribuer à la régénération du foie via la formation de cellules progénitrices [ 13]. |
|
Comment revisiter l’ensemble des résultats obtenus ? Plasticité, dédifférenciation et microenvironnement de l’hépatocyte sont les maîtres-mots permettant de réconcilier l’ensemble des travaux antérieurs. Nous avions déjà rapporté dans ces colonnes que le type de lésion hépatique modifiait le comportement du microenvironnement (→).
(→) Voir la Brève d’Hélène Gilgenkrantz, m/s n° 5, mai 2012, page 482
Ainsi, les myofibroblastes du foie, en cas de lésion biliaire (cholangite sclérosante ou cirrhose biliaire primitive), accumulent un ligand des récepteurs Notch orientant les cellules supposées progénitrices vers une voie cholangiocytaire ; à l’inverse, dans des foies soumis à une agression de type hépatocytaire (infection chronique par le virus de l’hépatite C par exemple), les macrophages avoisinant les hépatocytes infectés induisent l’expression de gènes cibles de la voie Wnt comme Numb, une ubiquitine ligase antagoniste de la voie Notch, et le destin hépatocytaire sera alors privilégié. On peut donc désormais supposer que les cellules cibles de ce microenvironnement labile sont en réalité les hépatocytes eux-mêmes (Figure 1). Tous les hépatocytes sont-ils capables d’une telle plasticité ? La question est légitime si l’on considère que la tétraploïdie, caractéristique physiologique d’une proportion importante d’hépatocytes chez le rongeur comme chez l’homme, bloque l’activation de Yap [12]. Existe-t-il une niche d’hépatocytes plus performants que d’autres dans ce domaine ? Rappelons que les cellules dites progénitrices sont observées de façon privilégiée dans la région périportale au niveau du canal de Hering. D’autres types cellulaires hépatiques ont-ils également cette capacité à se dédifférencier ? Des travaux récents semblent indiquer que les cellules étoilées du foie peuvent contribuer à la formation d’hépatocytes et de cellules biliaires dans un modèle associant 2AAF et HP chez le rat (Figure 1), dont nous avons rappelé qu’il induisait également une réaction ductulaire [13]. Enfin, une dernière question reste en suspens : ces publications signent-elles définitivement la fin de la quête de la cellule souche hépatique ? Dans le monde de la régénération, il était classique de considérer que le foie avait une place à part, faisant fi des deux grandes voies classiques, celle de l’hydre qui requiert au moins une cellule souche, et celle des urodèles, dont les cellules épithéliales au niveau de la zone de section du membre amputé se dédifférencient. Désormais, il faudra ranger le foie plutôt dans cette deuxième catégorie. Saluons toutefois le caractère exceptionnel de cette cellule épithéliale qu’est l’hépatocyte, capable à la fois de se diviser, quand différenciation et division cellulaires sont souvent antinomiques, mais aussi, si on l’en empêche, de marcher à rebours sur ses traces ontogéniques pour mieux se réengager, vers un destin hépatocytaire ou biliaire en fonction des besoins. ‡ |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Laperche Y. Origine des cellules ovales hépatiques . Med Sci (Paris). 2007; ; 5 : :480.–481. 2.
Williams MJ, Clouston AD, Forbes SJ. Links between hepatic fibrosis, ductular reaction and progenitor cell expansion . Gastroenterology. 2014; ; 146 : :349.–356. 3.
Lemaigre F. développement des lignages hépatiques dans le foie normal durant la régénération . Med Sci (Paris). 2012; ; 28 : :958.–962. 4.
Shin S, Upadhyay N, Greenbaum LE, Kaestner KH. Ablation of Foxl1-Cre-labeled hepatic pogenitor cells and their descendants impairs recovery of mice from liver injury . Gastroenterology. 2015; ; 148 : :192.–202. 5.
Malato Y, Naqvi S, Schürmann N, et al. Fate tracing of mature hépatocytes in mouse liver homeostasis and régénération . J Clin Invest. 2011; ; 121 : :4850.–4860. 6.
Espanol-Suner R, Carpentier R, Van Hul N, et al. Liver progenitor cells yield functional hepatocytes in response to chronic liver injury in mice . Gastroenterology. 2012; ; 143 : :1564.–1575. 7.
Schaub JR, Malato Y, Gormond C, Willenbring H. Evidence against a stem cell origin of new hepatocytes in a common mouse model of chronic liver injury . Cell Rep. 2014; ; 8 : :933.–939. 8.
Tarlow B, Pelz C, Naugler WE, et al. Bipotential adult liver progenitors are derived from chronically injured mature hepatocytes . Cell Stem Cell. 2014; ; 15 : :605.–618. 9.
Yanger K, Knigin D, Zong Y, et al. Adult hepatocytes are generated by self-duplication rather than stem cell differentiation . Cell Stem Cell. 2014; ; 15 : :340.–349. 10.
Yanger K, Zong Y, Maggs LR, et al. Robust reprogramming occurs spontaneously during liver regeneration . Genes Dev. 2013; ; 27 : :719.–724. 11.
Gilgenkrantz H. Le monde selon YAP . Med Sci (Paris). 2013; ; 29 : :868.–874. 12.
Yimlamai D, Christodoulou C, Galli GG, et al. Hippo pathway activity influences liver cell fate . Cell. 2014; ; 157 : :1324.–1338. 13.
Kordes C, Sawita I, Götze S, et al. Hepatic stellate cells contribute to progenitor cells and liver régénération . J Clin Invest. 2014; ; 124 : :5503.–5515. 14.
Boulter L, Lu WY, Forbes SJ. Differentiation of progenitors in the liver : a matter of local choice . J Clin Invest. 2013; ; 12 : :1867.–1873. |