| |
| Med Sci (Paris). 2015 March; 31(3): 256–259. Published online 2015 April 8. doi: 10.1051/medsci/20153103010.Transplantation d’hépatocytes humains dérivés de cellules souches dans le foie de souris Un nouveau modèle murin d’infection par le virus de l’hépatite C Arnaud Carpentier1* and T. Jake Liang1* 1National institute of diabetes and digestive and kidney diseases, liver diseases branch, 9000 Rockville Pike, Bethesda, MD 20892, États-Unis MeSH keywords: Adulte, Animaux, Différenciation cellulaire, Modèles animaux de maladie humaine, Hepacivirus, Hépatite C, Hépatocytes, Humains, Cellules souches pluripotentes induites, Foie, Transplantation hépatique, Souris, anatomopathologie, thérapie, physiologie, transplantation, virologie, méthodes |
Le développement de modèles expérimentaux d’infection par le virus de l’hépatite C (VHC) prenant en compte le patrimoine génétique de l’hôte est nécessaire. En effet, de récentes études ont démontré l’influence du patrimoine génétique du patient aussi bien sur l’histoire naturelle de l’infection que sur la réponse aux traitements antiviraux [1]. Le modèle expérimental le plus utilisé est basé sur l’infection par le VHC de cellules de la lignée Huh7 [2], issues d’un hépatocarcinome ; il ne permet donc pas l’analyse de l’infection dans le contexte d’un patrimoine génétique particulier. De plus, ces cellules transformées ne reproduisent que très imparfaitement la physiologie des hépatocytes humains adultes (HH). Les cultures primaires d’hépatocytes humains peuvent être infectées par le VHC [3] et, dans une certaine mesure, permettraient d’étudier l’importance du génome de l’hôte dans l’infection. Cependant, les hépatocytes primaires ne permettent qu’une réplication limitée du virus, comparés aux cellules Huh7, et, de plus, ils ne peuvent être maintenus en culture que quelques jours, et, surtout, sont difficiles à obtenir (ils proviennent de résections hépatiques). Les hépatocytes humains peuvent aussi être greffés dans le foie de différents modèles de souris immunodéficientes transgéniques (modèles uPA, FAH1) (→) [10], où ils sont permissifs à l’infection in vivo par différents virus hépatotropiques [4].
(→) Voir la Nouvelle de H. Gilgenkrantz, m/s juin-juillet 2011, n° 6/7, page 587
Récemment, il a été décrit que les cellules souches pluripotentes induites (iPS, pour induced pluripotent stem cells) [5], obtenues après reprogrammation nucléaire de cellules somatiques - les fibroblastes dermiques ou les cellules sanguines constituant des types cellulaires relativement aisés à obtenir - peuvent être différenciées en cellules hépatocytaires appelées HLC (pour hepatocyte-like cells) [6, 7, 11]. Ces hépatocytes-like représentent un modèle de choix pour analyser aussi bien le métabolisme cellulaire (maladies hépatiques d’origine génétique, par exemple), que l’infection par des virus hépatotropes dans le contexte du fond génétique du donneur. |
Différenciation hépatique in vitro
La différenciation de cellules iPS en cellules de type hépatocytes est basée sur un traitement séquentiel avec différents facteurs de croissances et molécules, et, dans notre protocole, suit trois étapes : Première étape : induction des cellules pluripotentes vers l’endoderme définitif, sous l’influence de l’activine A et du FGF2 (fibroblast growth factor), ce qui induit l’expression de facteurs de transcription typiques des cellules d’endoderme définitif (SOX17 et FOXA2). Seconde étape : spécification hépatique, en présence de HGF (hepatocyte growth factor, 100 ng/ml) et 0,1 % de diméthylsulfoxyde (DMSO) pour induire l’expression de gènes associés au métabolisme hépatique. En particulier, le gène HNF4A (hepatocyte nuclear factor 4A) est fortement induit, et agit comme un régulateur central de la différenciation hépatique, induisant l’expression par exemple de l’alpha-fœtoprotéine (AFP) et de l’antitrypsine A1 (AAT). Troisième étape : maturation hépatique par traitement avec de la déxaméthasone, ce qui provoque un important changement de morphologie (cellules polygonales, parfois binucléées, petits noyaux ronds, très similaires à des hépatocytes humains en culture primaire). Surtout, ce traitement induit l’expression de marqueurs hépatiques matures, tels que l’albumine, le facteur de coagulation FVII, et différentes isoformes des enzymes de détoxification dont le cytochrome P450. Bien que reproduisant différents processus biologiques et métaboliques typiques d’hépatocytes humains primaires (stockage du glycogène et de lipides, capture et sécrétion de lipoprotéines), les hépatocytes-like issus des iPS restent immatures comparés aux hépatocytes humains primaires, comme le montre la persistance de l’expression de marqueurs fœtaux comme l’AFP. |
Infection in vitro par le VHC L’infection productive par le VHC est strictement limitée aux hépatocytes humains adultes. Dans notre expérience, les hépatocytes-like issus d’iPS étaient susceptibles à l’infection in vitro par le VHC, qu’il s’agisse de virus produits en culture cellulaire (isolat JFH1, de génotype 2a) ou du sérum de patients chroniquement infectés par des virus de différents génotypes, comme cela a été décrit récemment [8]. Cependant, le niveau de réplication virale était très bas, et la production de particules infectieuses faible, en raison peut-être de la maturation incomplète des hépatocytes. De plus, il est important de noter que le niveau de réplication virale tendait à diminuer après deux semaines, ce qui correspondait à une dédifférenciation des hépatocytes in vitro. Nous avons aussi observé le déclenchement d’une réponse cellulaire de type interféron, suggérant que ce système constitue un modèle intéressant pour l’étude de la réponse immune innée au virus. |
Analyse de l’infection par le VHC in vivoÉtape 1 : transplantation d’hépatocytes-like Afin d’étudier leur implantation in vivo, 4 x 10 6 hépatocytes- like ont été injectés par voie intrasplénique dans des souris immunodéficientes (SCID/Bg 2,) exprimant le gène codant pour l’activateur du plasminogène de type urokinase (uPA) sous le contrôle du promoteur des protéines urinaires majeures (MUP) [ 4]. L’expression du transgène uPA dans les hépatocytes murins provoque leur cytolyse et donne ainsi un avantage sélectif aux hépatocytes humains implantés dans un environnement hépatique favorable à la prolifération hépatocytaire. L’implantation des hépatocytes- like a été suivie par la quantification de l’albumine humaine dans le sang des souris ; celle-ci était détectable dès les premiers jours suivant l’injection et augmentait avec le temps. Deux semaines après injection, les hépatocytes- like pouvaient être visualisés dans le parenchyme hépatique murin après marquage immunohistochimique avec le marqueur humain Hep Par1 et détection en immunofluorescence de l’albumine humaine, confirmant l’implantation intrahépatique des cellules humaines autour des veines centrales. L’albumine humaine sérique pouvait être détectée pendant au moins 100 jours après l’injection, suggérant la persistance des hépatocytes-like humains. De fait, 100 jours après l’injection, l’analyse immunohistochimique a révélé un degré variable (de 0,1 a 15 %) de repopulation du foie murin par les cellules humaines, corrélé à la concentration d’albumine humaine dans le sang des souris greffées. Surtout, l’analyse par immunofluorescence de sections de foies repeuplés par des cellules humaines a montré que les hépatocytes humains greffés prolifèrent et présentent un niveau de maturation hépatique plus élevé que celui des hépatocytes-like humains au moment de l’injection. Par exemple, ils perdent l’expression de marqueurs fœtaux (AFP), et gagnent celle de marqueurs d’hépatocytes matures, par exemple différentes isoformes du cytochrome P450 Figure 1).
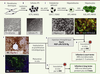 | Figure 1.
Stratégie expérimentale d’obtention d’hépatocytes-like humains à partir d’iPS. Des fibroblastes isolés de biopsies de peau (A) sont reprogrammés en cellules iPS (B), puis différenciés en cellules hépatocytaires hépatocytes-like
(C). Ces hépatocytes-like sont permissifs à l’infection par le VHC in vitro
(D) et peuvent être transplantés dans le parenchyme hépatique de souris MUP-uPA/SCID/Bg (E-F), où ils prolifèrent et développent un phénotype plus mature (G). Les hépatocytes-like peuvent aussi être infectés in vivo par différents génotypes de VHC (H). OSKM : lentivirus porteurs des ADNc codant pour OCT4 (O), SOX2 (S) KLF4 (K) et cMYC (M), les 4 facteurs de transcription nécessaires à la reprogrammation en iPS. |
Étape 2 : infection in vivo par le VHC Afin de confirmer la permissivité des hépatocytes- like humains issus d’iPS à l’infection in vivo par le VHC, des souris greffées ayant un taux sérique d’albumine humaine supérieur à 100 ng/ml 10 jours après la greffe ont été inoculées par voie intraveineuse avec des sérums de chimpanzés porteurs d’une infection chronique par différents génotypes de VHC. La réplication du VHC était ensuite mesurée par la quantification de l’ARN viral dans le sang des souris inoculées. Deux semaines après l’infection virale, L’ARN viral n’était détectable chez aucune souris, et seulement chez la moitié d’entre elles un mois après inoculation. Les raisons de ce délai sont inconnues, peut-être liées au temps de maturation et de prolifération in situ des cellules humaines. Cependant, trois mois après l’inoculation virale, toutes les souris avaient un taux mesurable d’ARN viral dans le sang, compris entre 4 et 7 log de copies par millilitre. La virémie pouvait aussi être détectée par ELISA (anticorps détectant l’antigène de capside du VHC). Ces résultats confirment que l’infection par le VHC peut être maintenue à un niveau détectable pendant plus de 100 jours. |
L’infection in vivo d’hépatocytes-like humains différenciés à partir de cellules iPS dérivées de cellules somatiques de patients constitue une approche unique permettant d’étudier l’infection à long terme de cellules hépatocytaires matures par le VHC dans le contexte du patrimoine génétique du patient [9]. Cette approche pourrait constituer un outil important non seulement pour analyser l’influence du génome du patient sur la primo-infection par le VHC et le passage à la chronicité de l’infection, mais aussi pour la validation de traitements antiviraux adaptés au patient. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Horner SM, Gale M, Jr. Regulation of hepatic innate immunity by hepatitis C virus . Nat Med. 2013; ; 19 : :879.–888. 2.
Wakita T, Pietschmann T, Kato T, et al. Production of infectious hepatitis C virus in tissue culture from a cloned viral genome . Nat Med. 2005; ; 11 : :791.–796. 3.
Podevin P, Carpentier A, Pène V, et al. Production of infectious hepatitis C virus in primary cultures of human adult hepatocytes . Gastroenterology. 2010; ; 139 : :1355.–1364. 4.
Tesfaye A, Stift J, Maric D, et al. Chimeric mouse model for the infection of hepatitis B and C viruses . PLoS One. 2013; ; 8 : :e77298.. 5.
Takahashi K, Tanabe K, Ohnuki M, et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors . Cell. 2007; ; 131 : :861.–872. 6.
Basma H, Soto-Gutiérrez A, Yannam GR, et al. Differentiation and transplantation of human embryonic stem cell-derived hepatocytes . Gastroenterology. 2009; ; 136 : :990.–999. 7.
Si-Tayeb K, Noto FK, Nagaoka M, et al. Highly efficient generation of human hepatocyte-like cells from induced pluripotent stem cells . Hepatology. 2010; ; 51 : :297.–301. 8.
Wu X, Robotham JM, Lee E, et al. Productive hepatitis C virus infection of stem cell-derived hepatocytes reveals a critical transition to viral permissiveness during differentiation . PLoS Pathog. 2012; ; 8 : :e1002617.. 9.
Carpentier A, Tesfaye A, Chu V, et al. Engrafted human stem cell-derived hepatocytes establish an infectious HCV murine model . J Clin Invest. 2014; ; 124 : :4953.–4964. 10.
Gilgenkrantz H. Des souris humanisées pour l’étude du virus de l’hépatite C . Med Sci (Paris). 2011; ; 27 : :587.–589. 11.
Touboul T, Vallier L, Weber A. Cellules souches embryonnaires humaines et iPS : une source fiable d’hépatocytes fœtaux . Med Sci (Paris). 2010; ; 26 : :1061.–1066. |