| |
| Med Sci (Paris). 2015 March; 31(3): 241–244. Published online 2015 April 8. doi: 10.1051/medsci/20153103005.Traitement de la protéinose alvéolaire par transplantation intrapulmonaire de macrophages Raphael Borie,1,2,3* Claire Danel,3,4 Catherine Lainé,5 Caroline Kannengiesser,3,6 and Bruno Crestani1,2,3 1APHP, hôpital Bichat, DHU Fire, service de pneumologie A, centre de compétence des maladies pulmonaires rares, 46, rue Henri Huchard, 75018Paris, France 2Inserm unité1152, Paris, France 3Université Paris Diderot, Paris, France 4APHP, hôpital Bichat, service d’anatomopathologie, 46, rue Henri Huchard, 75018Paris, France 5service d’immunologie-thérapie cellulaire et hématopoïèse, centre hospitalo-universitaire Pontchaillou, Rennes, France 6APHP, hôpital Bichat, service de génétique, 46, rue Henri Huchard, 75018Paris, France MeSH keywords: Animaux, Chaine bêta commune aux récepteurs des cytokines, Thérapie génétique, Facteur de stimulation des colonies de granulocytes et de macrophages, Humains, Perfusions intralésionnelles, Macrophages alvéolaires, Souris, Souris knockout, Protéinose alvéolaire pulmonaire, Protéines recombinantes, génétique, usage thérapeutique, transplantation, thérapie |
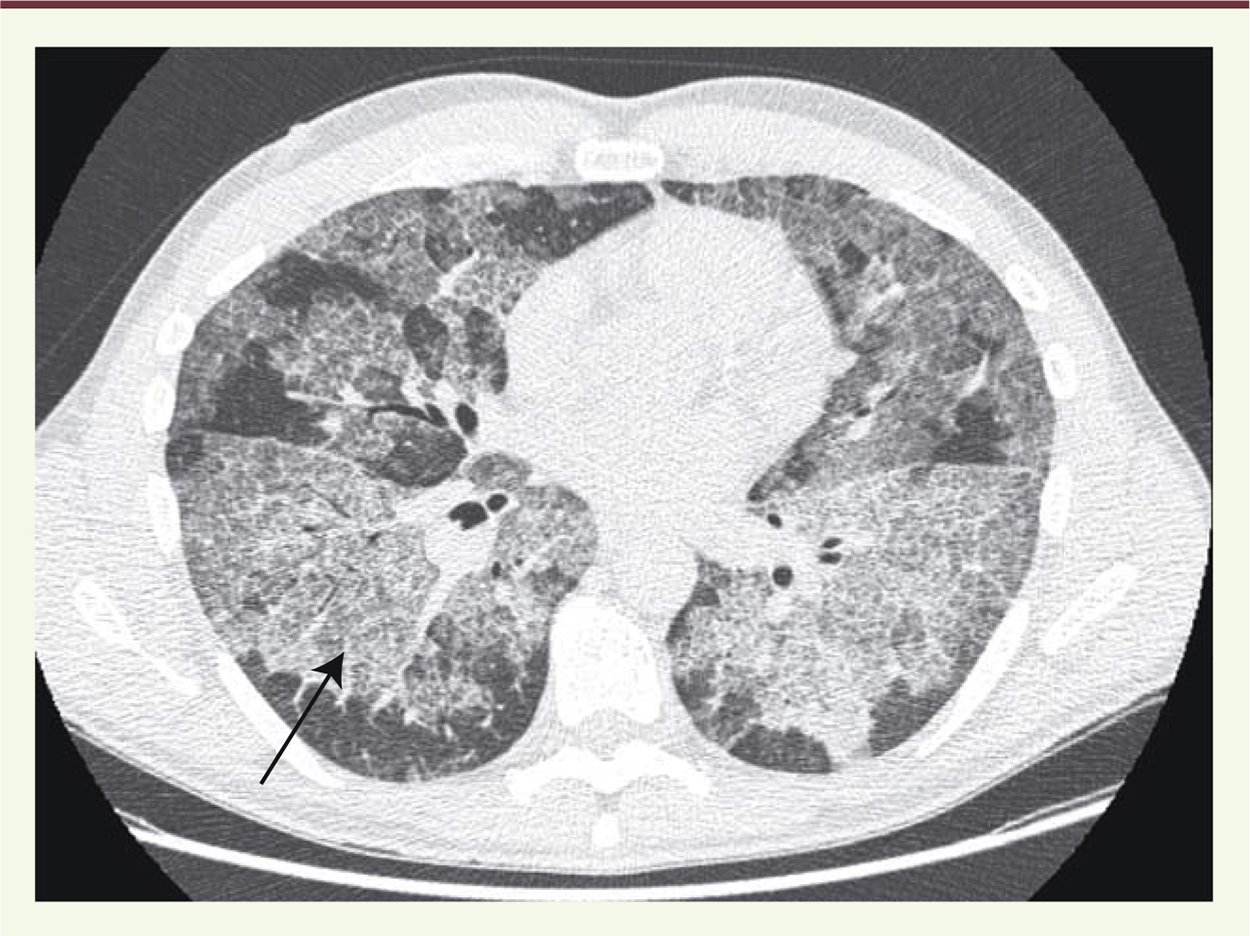
La protéinose alvéolaire pulmonaire La protéinose alvéolaire pulmonaire (PAP) est une maladie rare caractérisée par une accumulation de matériel phospholipoprotéinacé (protéines et lipides du surfactant) dans les alvéoles pulmonaires. Cette accumulation est liée à un défaut de clairance par les macrophages alvéolaires. Le diagnostic de protéinose alvéolaire pulmonaire est suggéré par un scanner thoracique évocateur (Figure 1), et confirmé par une lecture spécifique du lavage broncho-alvéolaire [1, 2].
 | Figure 1.
Scanner thoracique chez un patient atteint de protéinose alvéolaire. Scanner en coupe parenchymateuse mettant en évidence des opacités bilatérales en verre dépoli (n’effaçant pas les vaisseaux) mal limitées sur lesquelles se superposent des réticulations (opacités linéaires dessinant les septums inter-alvéolaires) dites en « crazy paving » très évocatrices du diagnostic de protéinose alvéolaire. |
On distingue trois types de protéinose alvéolaire pulmonaire en fonction de leur étiologie : auto-immunes, secondaires et génétiques. Chez l’adulte, les formes auto-immunes, avec présence d’auto-anticorps sériques anti GM-CSF (granulocyte-macrophage colony-stimulating factor) sont les plus fréquentes. Les formes secondaires sont dues le plus souvent à une inhalation de toxiques ou à une dysfonction du macrophage alvéolaire, en rapport soit avec une maladie hématologique, soit avec un déficit immunitaire. On ne détecte pas d’anticorps anti GM-CSF dans ces formes. Les protéinoses alvéolaires pulmonaires d’origine génétique peuvent s’intégrer dans des syndromes touchant plusieurs organes, elles s’observent essentiellement chez l’enfant et leur présentation radio-clinique est relativement spécifique du gène en cause. Les symptômes sont peu spécifiques et se limitent le plus souvent à une dyspnée. Il existe un risque d’infection opportuniste au cours des protéinoses alvéolaires pulmonaires auto-immunes, et la présence d’anticorps anti-GM-CSF pourrait être associée à un risque spécifique de méningite à cryptocoque [3]. |
Le surfactant est composé d’un mélange de protéines et de lipides (essentiellement de la phosphatidylcholine) sécrétés par les pneumocytes de type II. La clairance du surfactant est réalisée par les pneumocytes de type II et les macrophages alvéolaires [4]. Le surfactant réduit la tension de surface alvéolaire et empêche le collapsus alvéolaire au cours du cycle ventilatoire. Il intervient aussi dans la régulation de la réponse anti-infectieuse alvéolaire. L’insuffisance de surfactant chez les nouveau-nés prématurés (maladie des membranes hyalines), ou son altération au cours du syndrome de détresse respiratoire aiguë, sont ainsi responsables d’atélectasies conduisant à l’insuffisance respiratoire. Le GM-CSF joue un rôle capital dans la physiopathologie de la protéinose alvéolaire pulmonaire. Ce facteur de croissance des lignées granuleuses et monocytaires stimule in vitro la différenciation, la prolifération et la survie des cellules myéloïdes : monocytes, macrophages, éosinophiles, neutrophiles et cellules dendritiques. Le développement des souris mutantes déficientes (knock-out) pour le gène codant pour le GM-CSF a permis de manière inattendue d’identifier la responsabilité de cette cytokine dans la physiopathologie de la maladie [5]. Ces souris développent une protéinose alvéolaire pulmonaire semblable à la maladie humaine, dont l’apparition est secondaire à un défaut d’élimination du surfactant par les macrophages alvéolaires. Chez la souris, les effets du GM-CSF sur les macrophages alvéolaires font intervenir le facteur de transcription PU.1. Les souris mutantes déficientes en PU.1 présentent également une protéinose alvéolaire pulmonaire, et la réexpression de PU.1 prévient l’apparition de la symptomatologie [6]. Chez l’homme, le récepteur du GM-CSF est composé d’une sous-unité α et d’une sous-unité β. Des mutations sur les gènes codant pour les deux sous-unités de ce récepteur, CSF2RA et CSF2RB, sont responsables d’une protéinose alvéolaire pulmonaire avec accumulation de surfactant dans les alvéoles sans anomalie de l’interstitium pulmonaire. Dans cette forme, les taux sanguins et alvéolaires de GM-CSF sont augmentés et la recherche d’anticorps sériques anti-GM-CSF est négative [7]. Dans les protéinoses alvéolaires pulmonaires associées aux maladies hématologiques ou aux déficits immunitaires, les macrophages alvéolaires seraient numériquement ou fonctionnellement incapables d’assurer la clairance du surfactant. Ainsi, un défaut fonctionnel des macrophages stimulés par le GM-CSF ou l’interleukine (IL) 3 a été démontré chez trois patients atteints d’une protéinose alvéolaire pulmonaire associée à une leucémie aiguë myéloïde, et chez une patiente atteinte d’un lupus traité par immunosuppresseurs. Ces anomalies phénotypiques et fonctionnelles étaient corrigées après le traitement de la leucémie ou la diminution du traitement immunosuppresseur. Enfin, au cours de la protéinose alvéolaire auto-immune, la présence d’un titre élevé d’anticorps anti GM-CSF, d’isotype IgG, est spécifique de la maladie [8]. Ces auto-anticorps anti GM-CSF captent le facteur de croissance avec une grande affinité et neutralisent complètement son activité fonctionnelle. Les fonctions des macrophages alvéolaires en sont affectées, ce qui entraîne un défaut de clairance du surfactant, mais aussi un déficit de l’immunité innée et de l’immunité acquise. En effet, via la sécrétion d’IL-12 et d’IL-18, les macrophages alvéolaires stimulent les lymphocytes T helper de type 1 et les lymphocytes natural killer. Outre le défaut fonctionnel des macrophages alvéolaires, les polynucléaires neutrophiles des patients atteints de protéinose alvéolaire pulmonaire ne fonctionnent pas correctement. Il a ainsi été démontré que le transfert d’anticorps anti-GM-CSF in vitro sur des cellules myéloïdes de sujets sains reproduit les anomalies mises en évidences chez les patients atteints de protéinose alvéolaire [9]. S’y ajoutent des anomalies fonctionnelles lymphocytaires, qui participent au risque de complications infectieuses opportunistes. Enfin, le transfert d’anticorps anti GM-CSF humains à des primates non humains reproduit une maladie en tout point semblable à la maladie humaine, avec notamment une diminution de l’expression des ARNm de PU-1 et de PPARγ (peroxisome proliferator-activated receptor), et un dysfonctionnement des polynucléaires neutrophiles sanguins circulants. |
Le traitement de référence est symptomatique. Il consiste en un lavage pulmonaire. Le lavage au sérum physiologique est réalisé litre par litre jusqu’à clarification du liquide de lavage pulmonaire, sous anesthésie générale, un poumon à la fois, tandis que l’autre est ventilé. En moyenne, 15 litres de sérum physiologique sont nécessaires [10, 11]. Chez 30 à 50 % des patients un second lavage est nécessaire, et chez 10 % des lavages répétés [1]. D’autres traitements plus « physiopathologiques » peuvent être utilisés. Ainsi le GM-CSF (Sargramostim®) ciblant directement le macrophage alvéolaire, peut être utilisé par voie inhalée ou sous-cutanée. L’effet serait supérieur par voie inhalée avec un taux de réponse de 76,5 % et un taux de rechute de 12,5 % dans les protéinoses auto-immunes [12]. Les traitements immunosuppresseurs, en particulier les corticoïdes, sont dangereux et inefficaces. Cependant, dans quelques cas cliniques et chez sept patients d’une série de neuf patients traités par rituximab, un anticorps monoclonal anti-CD20, une amélioration de la protéinose a été observée, associée à une diminution du taux d’anticorps sériques [13, 14]. Le lavage thérapeutique est bénéfique chez moins de 20 % des patients dont la maladie est secondaire à une affection hématologique [15]. Le traitement hématologique, chimiothérapie et/ou la greffe de moelle, peut entraîner une guérison de la protéinose alvéolaire, en particulier au cours des leucémies aiguës [16]. Enfin le lavage thérapeutique pourrait être efficace au cours des protéinoses alvéolaires secondaires aux mutations de CSF2RA ou CSF2RB [17]. Le traitement par GM-CSF ne semble pas efficace [17–19]. L’évolution de la maladie n’est pas prévisible, et une rémission spontanée survient dans 5 à 7 % des cas. La survie à 5 ans est d’environ 95 % dans les formes auto-immunes. |
La thérapie génique est le Graal de la médecine thérapeutique. Cependant, les résultats en sont, sauf exception, régulièrement décevants [20]. Elle se heurte en effet à plusieurs difficultés dont l’utilisation d’une procédure myéloablative nécessaire à la greffe cellulaire, et/ou les problèmes de vecteurs requis pour l’insertion du gène corrigé. Une des méthodes pour pallier ces difficultés consiste à se placer en situation de greffe autologue, c’est-à-dire prélever des cellules du patient, les modifier ex vivo, puis les réinjecter, ce qui élimine le risque de rejet et la nécessité d’un traitement immunosuppresseur. La nature de la cellule à modifier peut être limitante, mais dans les cas de protéinoses alvéolaires secondaires à une mutation du récepteur du GM-CSF, cette approche pouvait s’avérer efficace. Une équipe américaine a récemment élégamment confirmé cette hypothèse chez la souris [21]. Les souris dont la sous-unité β du récepteur au GM-CSF a été invalidée (Csf2rb-/-) présentent une protéinose alvéolaire identique à celle des enfants présentant une mutation de ce même récepteur. Dans un premier temps, les auteurs ont instillé, dans les poumons des souris Csf2rb-/-, des macrophages dérivés de biopsie ostéo-médullaire de souris sauvages. L’injection chez l’animal anesthésié de deux millions de cellules améliorait la protéinose de manière objective : le lavage alvéolaire était moins opaque et contenait moins de surfactant. Le taux d’hémoglobine diminuait, traduisant une correction de l’hypoxémie via une diminution de la sécrétion d’érythropoïétine. Ainsi, quatre mois après la transplantation, les lésions histologiques pulmonaires étaient moins importantes, et, finalement, la survie globale des souris était améliorée. De manière intéressante, les macrophages issus de la transplantation avaient un avantage de survie comparés aux macrophages csf2rb-/-, et étaient toujours détectables dans le lavage alvéolaire un an après la procédure. Ce que confirmait l’augmentation persistante de la transcription de certains biomarqueurs comme PU.1. Les auteurs ont confirmé ces résultats par l’injection de macrophages différenciés in vitro à partir de cellules souches hématopoïétiques issues de souris csf2rb-/-, dans lesquelles le gène sauvage avait été réintroduit via un vecteur lentiviral. Les résultats étaient équivalents à ceux obtenus par l’injection de macrophages issus de souris sauvages. Aucune anomalie hématologique, ni lésion pulmonaire inflammatoire ou fibrosante n’ont compliqué la transplantation pulmonaire de ces macrophages. |
Ces résultats sont très encourageants et ouvrent la voie à un essai thérapeutique chez l’homme dans les protéinoses alvéolaires d’origine génétique, compte-tenu de la similitude des maladies chez l’homme et la souris. Ces résultats permettent aussi d’envisager cette méthode pour traiter d’autres maladies pulmonaires d’origine génétique ou non. La transplantation de macrophages pourrait ainsi être envisagée pour apporter une protéine ou un facteur de croissance déficient comme au cours du syndrome de détresse respiratoire aiguë. Il est amusant de noter que les connaissances sur la physiopathologie de la protéinose alvéolaire ont fait un bon en avant grâce au modèle de souris knock-out pour le gène GM-CSF. L’avenir nous dira si c’est un autre modèle murin knock-out qui résoudra les problèmes thérapeutiques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Seymour JF, Presneill JJ. Pulmonary alveolar proteinosis: progress in the first 44 years . Am J Respir Crit Care Med. 2002; ; 166 : :215.–235. 2.
Borie R, Danel C, Debray MP, et al. Pulmonary alveolar proteinosis . Eur Respir Rev. 2011; ; 20 : :98.–107. 3.
Rosen LB, Freeman AF, Yang LM, et al. Anti-GM-CSF autoantibodies in patients with cryptococcal meningitis . J Immunol. 2013; ; 190 : :3959.–3966. 4.
Whitsett JA, Wert SE, Weaver TE. Alveolar surfactant homeostasis and the pathogenesis of pulmonary disease . Annu Rev Med. 2010; ; 61 : :105.–119. 5.
Stanley E, Lieschke GJ, Grail D, et al. Granulocyte/macrophage colony-stimulating factor-deficient mice show no major perturbation of hematopoiesis but develop a characteristic pulmonary pathology . Proc Natl Acad Sci USA. 1994; ; 91 : :5592.–5596. 6.
Shibata Y, Berclaz PY, Chroneos ZC, et al. GM-CSF regulates alveolar macrophage differentiation and innate immunity in the lung through PU.1 . Immunity. 2001; ; 15 : :557.–567. 7.
Suzuki T, Sakagami T, Young LR, et al. Hereditary pulmonary alveolar proteinosis: pathogenesis, presentation, diagnosis, and therapy . Am J Respir Crit Care Med. 2010; ; 182 : :1292.–1304. 8.
Greenhill SR, Kotton DN. Pulmonary alveolar proteinosis: a bench-to-bedside story of granulocyte-macrophage colony-stimulating factor dysfunction . Chest. 2009; ; 136 : :571.–577. 9.
Uchida K, Beck DC, Yamamoto T, et al. GM-CSF autoantibodies and neutrophil dysfunction in pulmonary alveolar proteinosis . N Engl J Med. 2007; ; 356 : :567.–579. 10.
Michaud G, Reddy C, Ernst A. Whole-lung lavage for pulmonary alveolar proteinosis . Chest. 2009; ; 136 : :1678.–1681. 11.
Briens E, Delaval P, Mairesse MP, et al. La protéinose alvéolaire pulmonaire . Rev Mal Respir. 2002; ; 19 : :166.–182. 12.
Tazawa R, Inoue Y, Arai T, et al. Duration of benefit in patients with autoimmune pulmonary alveolar proteinosis after inhaled granulocyte-macrophage colony-stimulating factor therapy . Chest. 2014; ; 145 : :729.–737. 13.
Kavuru MS, Malur A, Marshall A, et al. An open-label trial of rituximab therapy in pulmonary alveolar proteinosis . Eur Respir J. 2011; ; 38 : :1361.–1367. 14.
Borie R, Debray V, Laine C, et al. Rituximab therapy in autoimmune pulmonary alveolar proteinosis . Eur Respir J. 2009; ; 33 : :1503.–1506. 15.
Ishii H, Seymour JF, Tazawa R, et al. Secondary pulmonary alveolar proteinosis complicating myelodysplastic syndrome results in worsening of prognosis: a retrospective cohort study in Japan . BMC Pulm Med. 2014; ; 14 : :37.. 16.
Ishii H, Nakata K, Inoue Y, et al. Clinical course of GM−CSF autoantibody negative pulmonary alveolar proteinosis (NAPAP): efficacy of lavage therapy . Am J Respir Crit Care Med. 2009; ; 179 : :A3035.. 17.
Suzuki T, Sakagami T, Rubin BK, et al. Familial pulmonary alveolar proteinosis caused by mutations in CSF2RA . J Exp Med. 2008; ; 205 : :2703.–2710. 18.
Martinez-Moczygemba M, Doan ML, Elidemir O, et al. Pulmonary alveolar proteinosis caused by deletion of the GM-CSFRalpha gene in the X chromosome pseudoautosomal region 1 . J Exp Med. 2008; ; 205 : :2711.–2716. 19.
Dirksen U, Nishinakamura R, Groneck P, et al. Human pulmonary alveolar proteinosis associated with a defect in GM-CSF/IL-3/IL-5 receptor common beta chain expression . J Clin Invest. 1997; ; 100 : :2211.–2217. 20.
Hacein-Bey-Abina S, Pai SY, Gaspar HB, et al. A modified gamma-retrovirus vector for X-linked severe combined immunodeficiency . N Engl J Med. 2014; ; 371 : :1407.–1417. 21.
Suzuki T, Arumugam P, Sakagami T, et al. Pulmonary macrophage transplantation therapy . Nature. 2014; ; 514 : :450.–454. |