| |
| Med Sci (Paris). 2015 February; 31(2): 123–126. Published online 2015 March 4. doi: 10.1051/medsci/20153102003.Les bacilles de la tuberculose bovine Une évolution aux dépens de la transmissibilité chez l’homme Roland Brosch1* and Christophe Guilhot2** 1Institut Pasteur, unité de pathogénomique mycobactérienne intégrée, 25, rue du docteur Roux, 75015Paris, France 2CNRS, Université de Toulouse, Université Paul Sabatier, Institut de pharmacologie et de biologie structurale, 205, route de Narbonne, 31000Toulouse, France MeSH keywords: Élevage, Animaux, Animaux domestiques, Animaux sauvages, Antigènes bactériens, Protéines bactériennes, Bovins, Évolution moléculaire, Hominidae, Spécificité d'hôte, Humains, Mycobacterium, Mycobacterium bovis, Mycobacterium tuberculosis, Phylogénie, Polymorphisme de nucléotide simple, Tuberculose, Virulence, microbiologie, génétique, classification, pathogénicité, épidémiologie, transmission, médecine vétérinaire |
Il est fréquent d’observer une évolution des agents pathogènes bactériens vers une spécificité d’hôte plus ou moins stricte. Comprendre les déterminants de l’adaptation d’un agent pathogène à un hôte, mais également les facteurs favorisant le franchissement de la barrière d’espèce et la transmission à un nouvel hôte, permet d’évaluer le risque d’émergence de nouvelles maladies chez l’homme et de concevoir des stratégies pour limiter ce risque. |
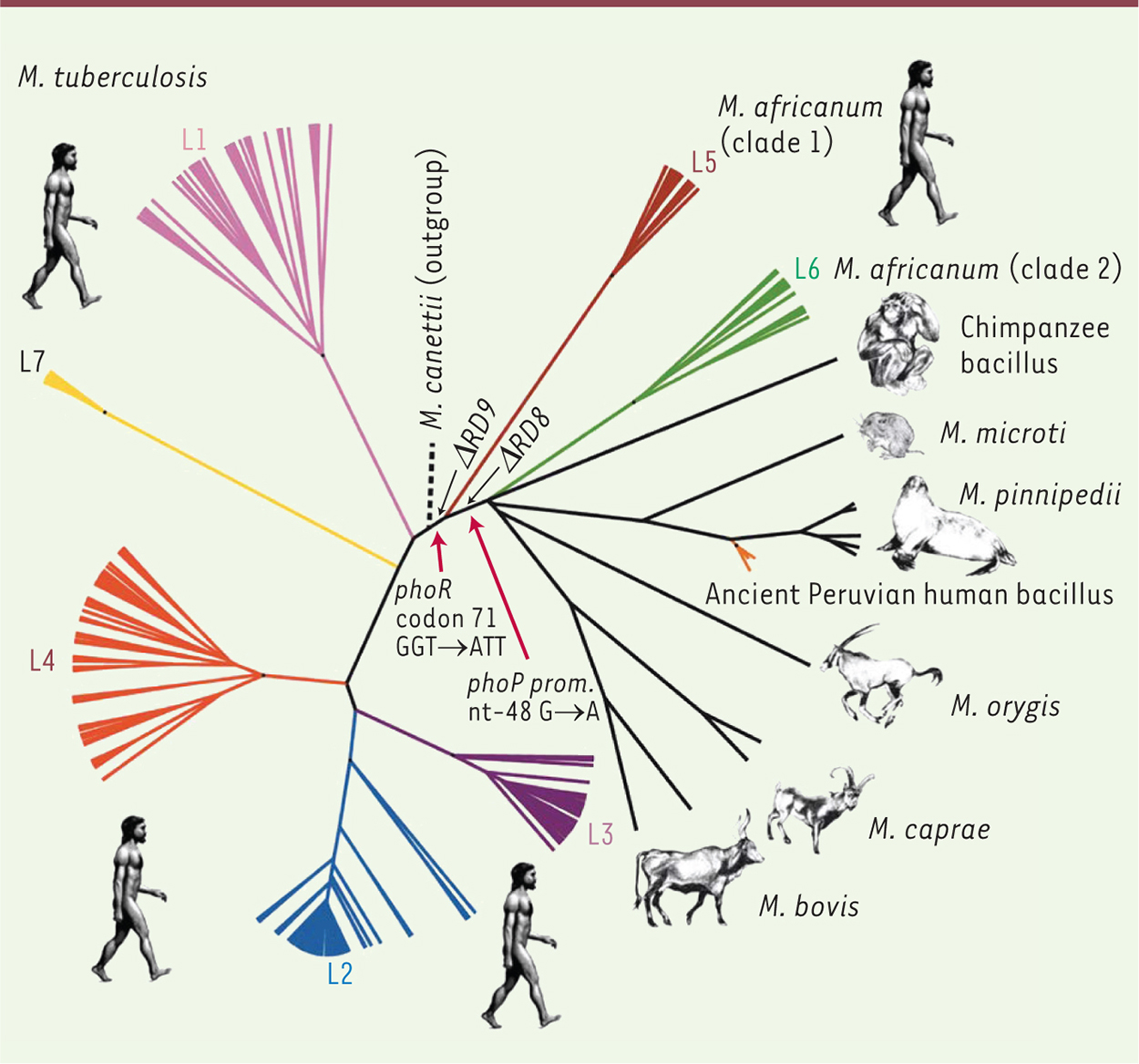
Les bacilles du complexe de Mycobacterium tuberculosisLa tuberculose est l’une des maladies infectieuses les plus dévastatrices dans l’histoire de l’humanité. Encore au début du xxie siècle, le nombre global de nouveaux cas de tuberculose par an est estimé à 9 millions et le nombre de décès à 1,5 millions [1]. La tuberculose est provoquée par des bacilles, rassemblés en un groupe nommé complexe de Mycobacterium tuberculosis (MTB), qui inclut les mycobactéries partageant plus de 99,9 % d’identité au niveau de leur ADN génomique. Ce groupe comprend MTB, l’agent principal de la tuberculose humaine, et Mycobacterium africanum, un pathogène de l’homme, endémique en Afrique de l’Ouest. Il inclut également des bacilles qui se sont adaptés à des hôtes animaux spécifiques : par exemple, Mycobacterium mungi pour la mangouste ; le « dassie bacillus » pour le daman des rochers1 ; Mycobacterium orygis pour les gazelles oryx ; Mycobacterium pinnipedii pour les phoques ; Mycobacterium microti pour les campagnols ; Mycobacterium caprae pour les caprins et Mycobacterium bovis pour les bovins [2]. Les liens phylogénétiques entre les différents bacilles du complexe de MTB sont restés mal définis pendant un siècle. En effet, les bacilles tuberculeux d’origine bovine (maintenant connus sous le nom de M. bovis) ont été identifiés dès la fin du xixe siècle, peu après la découverte par Robert Koch de MTB. Selon des documents historiques, les scientifiques de l’époque supposaient déjà des différences entre les bacilles tuberculeux d’origine humaine et bovine, malgré leurs ressemblances fortes [3, 4]. Le modèle le plus communément admis était que MTB dérivait d’un bacille infectant les bovins. Il a fallu attendre le début du xxie siècle et les avancées spectaculaires de la génomique comparative pour contredire ce modèle et établir un arbre phylogénétique clair des bacilles du complexe de MTB. Une cartographie très détaillée des différences génétiques a été construite, permettant d’établir un modèle évolutif fiable des bacilles tuberculeux [5, 6]. Ce modèle place M. bovis à l’extrémité d’une lignée phylogénétique se séparant de la lignée des souches de MTB, et suggère que les souches animales dérivent d’un bacille humain (proche de M. africanum) [5–8], puis ont évolué vers une spécificité d’hôte [9, 10] (Figure 1).
 | Figure 1. Analyse phylogénétique de souches du complexe de MTB, basée sur les SNP de 261 génomes (adaptée avec la permission de MacMillan Publishers Ltd : Nature [ 8], © 2014) et incluant certaines délétions spécifiques des lignées animale et M. africanum ainsi que les mutations affectant le système de régulation PhoPR [ 14]. |
|
Les bacilles de la tuberculose bovine sont peu transmissibles chez l’homme La pandémie de tuberculose est largement alimentée par l’immense réservoir humain de porteurs asymptomatiques, qui est estimé à un tiers de la population mondiale. Il existe également un autre réservoir, correspondant aux mammifères non humains infectés par la lignée phylogénétique des souches animales du complexe de MTB. Ce réservoir animal reste très largement méconnu, mais les données actuelles montrent qu’il est très divers et distribué mondialement : il concerne des espèces sauvages (telles que les chimpanzés, des cervidés, des mammifères marins, entre autres) et des animaux de rente (telles que les bovins et caprins) chez lesquels des épisodes de tuberculose bovine ont été observés dans 128 pays durant la période 2005-2008 [11]. Les opportunités de contact entre l’homme et des animaux contaminés sont fréquentes, et les bacilles de la lignée animale, tels que M. bovis, constituent donc un risque zoonotique. On estime qu’environ 2 % des cas de tuberculose humaine au niveau mondial sont provoqués par des contaminations liées à des sources animales. Les données épidémiologiques suggèrent néanmoins que l’homme représente un hôte accidentel pour M. bovis et les souches animales voisines. Ainsi, une étude danoise a établi dès 1966 que la morbidité est plus faible chez les personnes infectées par des bacilles de source animale que chez celles contaminées à partir d’une source humaine [12]. De même, les cas de transmission interhumaine de souches animales sont extrêmement rares. Ces observations s’appliquent également, mais dans une moindre mesure, aux lignées de M. africanum qui sont les plus proches phylogénétiquement des souches animales. En effet, la distribution de M. africanum est restreinte aux pays d’Afrique de l’Ouest. En dépit de mouvements de populations importants entre cette région du globe et d’autres pays, ces souches n’ont pas réussi à s’implanter ailleurs de façon durable. Comme pour les souches animales, la transition entre infection et tuberculose active s’opère plus tardivement lorsque l’agent infectieux est M. africanum plutôt que MTB sensu stricto. Cette atténuation de la virulence des souches de M. africanum semble confirmée par les données expérimentales en modèle animal et les observations récentes de terrain, qui montrent un remplacement progressif dans certains pays d’Afrique de l’Ouest de M. africanum par MTB sensu stricto [13]. La maladie, et les lésions pulmonaires associées telles que les cavités, sont des prérequis pour la transmission efficace des bacilles tuberculeux par voie aérienne. Une capacité plus faible à causer la maladie pourrait donc expliquer la transmission inefficace des bacilles bovins chez l’homme. |
Des mutations dans le système de régulation PhoPR sont la clé de la faible transmission chez l’homme des bacilles de la tuberculose bovine Les études récentes de génomique comparative ont établi que les bacilles du complexe de MTB ont suivi une évolution clonale, sans gain apparent de matériel génétique exogène par transfert horizontal après la séparation avec le clade des Mycobacterium canettii [9] (Figure 1). Les différences génétiques entre les souches les plus éloignées caractérisées à ce jour se limitent à environ 2 400 mutations ponctuelles ou SNP (single nucleotide polymorphism) et quelques délétions de fragments du chromosome. Parmi ces différences se trouve le, ou les, déterminant(s) de l’atténuation des souches animales, dont M. bovis, pour l’homme. En comparant plus de 30 génomes de bacilles tuberculeux des différentes lignées phylogénétiques, nous avons identifié 3 SNP spécifiques des lignées animales et M. africanum, qui touchent les gènes phoPR codant pour un système de régulation jouant un rôle crucial dans l’interaction avec l’hôte [14]. Ce système est composé de deux protéines : PhoR, qui perçoit un signal extracellulaire de nature encore inconnue et active, via une phosphorylation, PhoP, qui est capable de se fixer sur des sites définis du chromosome bactérien et de moduler l’expression de nombreux gènes. Les protéines PhoPR contrôlent en particulier la production de lipides spécifiques des bacilles tuberculeux, tels que les sulfolipides (SL) et les polyacyltréhaloses (PAT), et de protéines, telles que le facteur de virulence ESAT-6, situés à la surface des bactéries [15–17]. Ces lipides et ESAT-6 déterminent la capacité de MTB à envahir et tuer les macrophages. En transférant l’allèle phoPR des souches animales (contenant donc les 3 SNP) dans des souches de MTB, nous avons pu établir par différentes approches transcriptomiques et biochimiques que cet allèle est déficient : l’expression des gènes du régulon PhoP est fortement diminuée et plusieurs facteurs de virulence ne sont plus produits ou transportés vers la surface de la bactérie (comme par exemple les lipides SL et PAT, et ESAT-6) [14]. Cela se traduit par une capacité moindre des souches de MTB exprimant cet allèle à se multiplier dans les macrophages, et par un retard dans l’induction de la maladie et de la mort en modèle animal [14]. |
Une ré-acquisition d’un fort pouvoir de transmission est possible pourles souches bovines Les résultats démontrant la perte de fonctionnalité du système PhoPR à cause de mutations ponctuelles soulèvent une autre question : comment les bacilles de la tuberculose bovine, et les souches phylogénétiquement proches, ont-ils pu se maintenir et rester virulents pour leur hôte naturel, en dépit de la perte de fonction du système PhoPR ? Pour répondre à cette question, nous avons analysé l’impact du transfert chez M. bovis de l’allèle fonctionnel de phoPR, issu d’une souche de MTB sensu stricto. Comme attendu, ce transfert augmente l’expression des gènes du régulon PhoP et permet la production, absente des souches sauvages, de facteurs de virulence lipidiques de MTB [14]. Ces résultats démontrent que les voies de biosynthèse de ces composés sont toujours présentes et fonctionnelles, mais ne s’expriment pas, dans les souches de tuberculose bovine. À l’inverse, la présence d’un allèle fonctionnel de phoPR ne modifie pas la sécrétion du facteur de virulence ESAT-6 qui, de façon inattendue, est produit en quantité comparable dans les bacilles des tuberculoses bovine et humaine. Cette observation nous a suggéré que l’ancêtre des bacilles bovins ayant survécu à la diminution de virulence associée aux mutations dans phoPR avait acquis une ou plusieurs mutations compensatrice(s) capable(s) de restaurer la sécrétion du facteur de virulence majeur ESAT-6. La translocation d’ESAT-6 vers l’extérieur de la bactérie requiert un système de sécrétion dit de type VII et la présence de trois protéines, EspACD. Alors que la production du système de type VII ne semble pas sous contrôle du régulateur PhoP, la synthèse de EspACD est sous sa dépendance. Contre toute attente, l’expression des gènes espACD chez M. bovis, ou chez des lignées proches, est comparable à celle observée chez MTB sensu stricto sauvage, et nettement supérieure à celle obtenue chez MTB une fois les gènes phoPR éliminés, ou exprimant l’allèle phoPR de M. bovis. Nous avons pu montrer qu’une délétion de phoPR chez M. bovis, ou chez une souche proche de M. africanum, n’affecte pas la transcription d’espACD contrairement à la situation chez MTB [14]. La conclusion est donc que l’expression de ces gènes a échappé au contrôle par le système PhoPR. Une inspection du génome des bacilles bovins et des souches voisines révèle une délétion spécifique de ces bactéries, située en amont des gènes espACD, préalablement nommé région de différence (RD8) [5, 6]. Par transfert génétique de l’allèle espACD de M. bovis chez un MTB muté dans phoPR, nous avons pu établir que cette délétion permet une translocation d’ESAT-6 indépendamment de PhoPR [14]. Ces résultats établissent donc une série d’évènements génétiques qui se sont déroulés chez un ancêtre commun des bacilles de tuberculose bovine et des lignées phylogénétiques proches, et qui ont sans doute eu un impact majeur sur la virulence de ces bacilles pour l’homme. Est-il maintenant possible que des souches adaptées à un hôte animal puissent parcourir le chemin inverse et regagner une forte capacité de transmission chez l’homme ? Comme indiqué précédemment, des souches de tuberculose bovine responsables de chaînes de transmission chez l’homme sont extrêmement rares. Cependant, c’est le cas d’un bacille, M. bovis B, impliqué dans plus de 36 cas de tuberculose humaine en Espagne à la fin des années 1990 [18]. Une analyse génétique a révélé qu’un élément mobile s’est inséré en amont du locus phoPR dans cette souche [19]. Notre étude a établi que cette insertion induit une surexpression des gènes phoPR et, en conséquence, du régulon PhoP. Elle restaure la production de facteurs de virulence lipidiques en dépit des SNP présents dans phoPR et, dans un modèle animal, augmente la virulence des bacilles tuberculeux [14]. Il est donc très probable que cette insertion est la cause de la transmission inhabituelle de la souche M. bovis B chez l’homme. |
Un scénario pour l’évolution des souches de tuberculose animale Cette étude permet de concevoir un scénario pour l’évolution des souches de tuberculose animale et de leurs proches voisines M. africanum. Un ancêtre commun de ces lignées a acquis des SNP dans phoPR qui ont réduit sa virulence et sa capacité à se transmettre chez l’homme. Un second événement génétique, une délétion en amont d’espACD, s’est produit ensuite, compensant partiellement la perte de virulence associée aux SNP dans phoPR en permettant une sécrétion du facteur de virulence ESAT-6 indépendamment de PhoPR. À partir de là, les souches animales ont divergé et acquis des mutations permettant une meilleure adaptation à un hôte particulier comme par exemple le campagnol pour M. microti, le phoque pour M. pinnipedii ou les bovins pour M. bovis. La délétion en amont d’espACD n’est cependant pas suffisante pour permettre une transmission efficace chez l’homme. Cette propriété peut être à nouveau acquise par un troisième événement génétique qui est l’insertion d’un élément mobile en amont de phoPR, comme cela a été le cas pour la souche M. bovis B. Ce travail, mis en perspective avec la phylogénie bien caractérisée des souches du complexe de MTB, fournit un cadre explicatif aux données épidémiologiques sur la tuberculose humaine associée aux souches animales ou à M. africanum. Une autre conclusion importante de ce travail est que des déterminants fondamentaux pour la transmission efficace de MTB chez l’homme sont portés par les gènes du régulon PhoP. Une porte s’ouvre donc pour comprendre cette étape cruciale du cycle infectieux et pour concevoir ensuite des stratégies visant à la bloquer. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nous remercions les membres des équipes de Carlos Martin à l’Université de Saragosse, de Roland Brosch à l’Institut Pasteur de Paris et de Christophe Guilhot à l’Institut de pharmacologie et de biologie de Toulouse pour leur participation au travail présenté dans cet article. Celui-ci a été subventionné par la Fondation pour la recherche médicale (Équipe FRM DEQ20090515399 et DEQ20130326471) et l’Union européenne (contrat NEWTBVAC 241745 et FEDER/POCTEFA/REFBIO EFA237/11).
|
Footnotes |
1.
WHO . Global tuberculosis report 2014 . Geneva: : World Heatlh Organization; , 2014. 2.
van Ingen J, Rahim Z, Mulder A, et al. Characterization of Mycobacterium orygis as M. tuberculosis complex subspecies . Emerg Inf Dis. 2012;; 18 : :653.–655. 4.
Smith TA A comparative study of bovine tubercle bacilli and of human bacilli from s putum . J Exp Med. 1898; ; 1898 : (3) :451.–511. 5.
Brosch R, Gordon SV, Marmiesse M, et al. A new evolutionary scenario for the Mycobacterium tuberculosis complex . Proc Natl Acad Sci USA. 2002; ; 99 : :3684.–3689. 6.
Mostowy S, Cousins D, Brinkman J, Aranaz A, Behr MA. Genomic deletions suggest a phylogeny for the the Mycobacterium tuberculosis complex . J Inf Dis. 2002; ; 186 : :74.–80. 7.
Comas I, Coscolla M, Luo T, et al. Out-of-Africa migration and Neolithic coexpansion of Mycobacterium tuberculosis with modern humans . Nat Genet. 2013; ; 45 : :1176.–1182. 8.
Bos KI, Harkins KM, Herbig A, et al. Pre-Columbian mycobacterial genomes reveal seals as a source of New World humans tuberculosis . Nature. 2014; ; 514 : :494.–497. 9.
Boritsch EC, Supply P, Honoré N, et al. A glimpse into the past and predictions for the future: the molecular evolution of the tuberculosis agent . Mol Microbiol. 2014; ; 93 : :835.–852. 10.
Smith NH, Hewinson RG, Kremer K, Brosch R, Gordon SV. Myths and misconceptions: the origin and evolution of Mycobacterium tuberculosis . Nat Rev Microbiol. 2009; ; 7 : :537.–544. 11.
Michel AL, Müller B, Van Helden PD. Mycobacterium bovis at the animal-human interface: a problem or not ? Vet Microbiol. 2010; ; 140 : :371.–381. 12.
Magnus K.. Epidemiological basis of tuberculosis eradication. 3. Risk of pulmonary tuberculosis after human and bovine infection . Bulletin of the World Health Organization. 1966; ; 35 : :483.–508. 13.
Koro Koro F, Kamdem Simo Y, Piam FF, et al. Population dynamics of tuberculous Bacilli in Cameroon as assessed by spoligotyping . J Clin Microbiol. 2013;; 51 : :299.–302. 14.
Gonzalo-Asensio J, Malaga W, Pawlik A, et al. Evolutionary history of tuberculosis shaped by conserved mutations in the PhoPR virulence regulator . Proc Natl Acad Sci USA. 2014; ; 111 : :11491.–11496. 15.
Walters SB, Dubnau E, Kolesnikova I, et al. The Mycobacterium tuberculosis PhoPR two-component system regulates genes essential for virulence and complex lipid biosynthesis . Mol Microbiol. 2006; ; 60 : :312.–330. 16.
Gonzalo-Asensio J, Maia C, Ferrer NL, et al. The virulence-associated two component PhoP-PhoR system controls the biosynthesis of polyketide-derived lipids in Mycobacterium tuberculosis . J Biol Chem. 2006; ; 281 : :1313.–1316. 17.
Frigui W, Bottai D, Majlessi L, et al. Control of M. tuberculosis ESAT-6 secretion and specific T cell recognition by PhoP . PloS Pathogens. 2008; ; 4 : :e33.. 18.
Rivero A, Marquez M, Santos J, et al. High rate of tuberculosis reinfection during a nosocomial outbreak of multidrug-resistant tuberculosis caused by Mycobacterium bovis strain B . Clin Infect Dis. 2001; ; 32 : :159.–161. 19.
Soto CY, Menendez MC, Perez E, et al. IS6110 mediates increased transcription of the phoP virulence gene in a multidrug-resistant clinical isolate responsible for tuberculosis outbreaks . J Clin Microbiol. 2004; ; 42 : :212.–219. |