| |
| Med Sci (Paris). 2015 January; 31(1): 60–67. Published online 2015 February 6. doi: 10.1051/medsci/20153101014.Anticorps anti-NR1 dans l’encéphalite anti-récepteur N-méthyl-D-aspartate et la schizophrénie Emmanuel Le Guen,1,2,3* Raphaël Doukhan,1,2,3 Nora Hamdani,1,2,3 Ryad Tamouza,4,5,6 Laurent Groc,7 Jérôme Honnorat,8,9,10 and Marion Leboyer1,2,3 1Pôle psychiatrie des hôpitaux universitaires Henri Mondor, AP-HP, université Paris-Est, DHU PePSY, hôpital Albert Chenevier, 40, rue de Mesly, 94000Créteil, France 2Inserm U955, équipe 15, psychiatrie génétique, Créteil, France 3fondation FondaMental, Créteil, France 4laboratoire Jean Dausset d’immunologie et d’histocompatibilité, hôpital Saint Louis, Paris, France 5LabEx Transplantex, Inserm UMRS 1160, Paris, France 6université Paris Diderot, Paris, France 7institut interdisciplinaire de neuroscience, CNRS UMR 5297, université de Bordeaux, Bordeaux, France 8centre de référence maladies rares « syndromes neurologiques paranéoplasiques », Hospices civils de Lyon, hôpital neurologique, Bron, France 9Inserm U1028/CNRS UMR 5292, centre de recherché en neurosciences de Lyon, Bron, France 10université de Lyon, université Claude-Bernard Lyon-1, Lyon, France |
En 2007, Josep Dalmau a décrit une nouvelle cause d’encéphalite limbique auto-immune sévère, associée à des tumeurs, mais potentiellement traitable : les encéphalites à anticorps (Ac) anti-récepteur N-méthyl-D-aspartate (anti-R-NMDA) [1]. Cette pathologie, extrêmement bien caractérisée sur le plan syndromique, associe des symptômes psychotiques initiaux, suivis d’un état catatonique et de symptômes neurologiques. Elle est imputable à l’action, au niveau du système nerveux central (SNC), d’un Ac spécifique de type IgG ciblant la sous-unité GluN1 (NR1) du récepteur glutamatergique N-méthyl-D-aspartate (Figure 1) [2]. Ce récepteur ionotropique, nommé selon son agoniste pharmacologique préférentiel, le N-méthyl-D-aspartate (NMDA), est un canal calcique jouant un rôle majeur dans les mécanismes de plasticité neuronale (potentialisation à long terme et synaptogenèse développementale) [40].
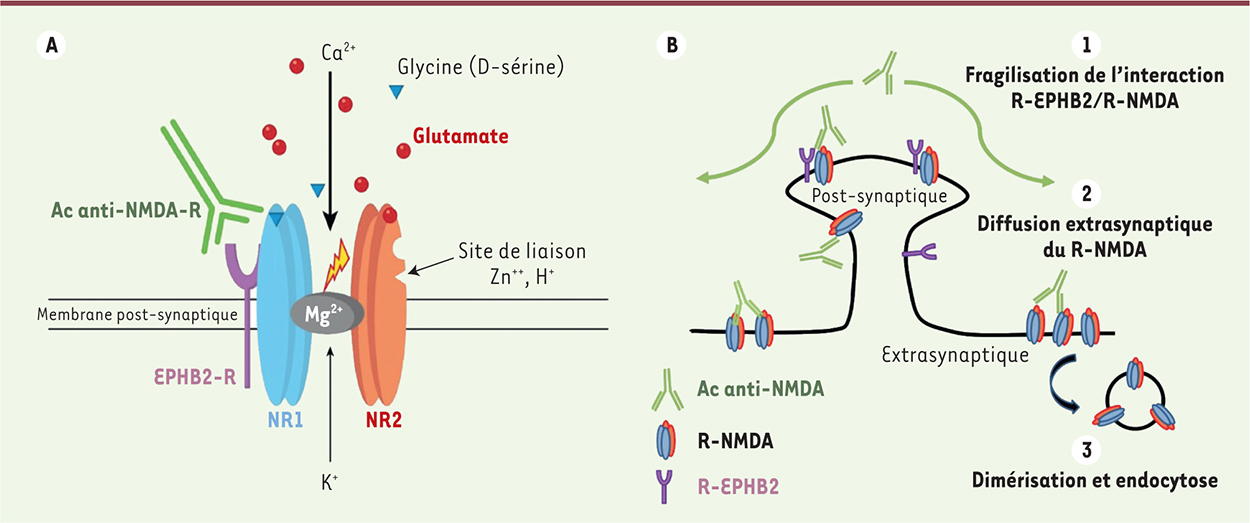
 | Figure 1.
Récepteur glutamatergique NMDA et mécanisme d’action des anticorps. A. Récepteur glutamatergique NMDA. Dans le cortex cérébral et hippocampique, le R-NMDA est constitué de deux sous-unités GluN1 (NR1) et, généralement, de deux sous-unités GluN2 (NR2). Son ouverture requiert : (1) une dépolarisation membranaire préalable (expulsion de l’ion Mg2+) ; (2) la fixation du glutamate sur la sous-unité NR2 ; (3) la fixation d’un co-agoniste (glycine ou D-sérine) sur la sous-unité NR1. De nombreuses substances endogènes ou pharmacologiques modulent l’activité de ce récepteur. Le récepteur à activité tyrosine kinase éphrine B2 (R-EPHB2) s’associe avec le NMDA-R, via la région amino-terminale extracellulaire de NR1, et régule sa diffusion latérale à la surface membranaire. B. Mécanisme d’action des anticorps dans les encéphalites anti-R-NMDA. La fixation des anticorps de type IgG1 ou IgG3, ciblant la sous-unité NR1, fragilise l’interaction du NMDA-R avec le R-EPHB2 nécessaire à son ancrage synaptique. Il en résulte une diffusion en dehors de la synapse de ces deux récepteurs. Les récepteurs retrouvés dans l’espace extrasynaptique et dimérisés sous l’effet des anticorps sont secondairement endocytés. Le fonctionnement global réduit, induit par une raréfaction des R-NMDA, aboutit à une hyperactivation corticale responsable des symptômes psychiatriques et neurologiques. |
Cette découverte a suscité l’intérêt des cliniciens et des chercheurs s’intéressant à des pathologies potentiellement dysimmunitaires affectant la mémoire, la cognition, et les comportements comme la schizophrénie ou le trouble bipolaire. Ainsi, un nombre croissant de cas d’encéphalites ont été rapportés, révélés par des tableaux initialement psychiatriques, secondairement compliqués par l’apparition caractéristique de symptômes neurologiques. De plus, la présence de ces auto-Ac dans des formes psychiatriques pures, particulièrement lors des premiers épisodes psychotiques, et répondant à une immunothérapie, semble confirmer leur implication dans la physiopathologie de certains troubles psychotiques [3]. Certains agents infectieux neurotropes, contractés pendant la grossesse ou en période périnatale, augmentent le risque de trouble psychotique pour la descendance [4]. À l’âge adulte, bien qu’il n’y ait pas d’infection patente, ces pathogènes pourraient être responsables des signes d’activation microgliale et de l’hyperpolarisation Th1 des réponses immunitaires observées dans la schizophrénie [5]. Les troubles psychotiques, comme les maladies auto-immunes, résultent de l’interaction de facteurs de vulnérabilité génétiques et de facteurs environnementaux potentiellement déclencheurs comme les infections [6]. En outre, il existe une incidence accrue de diverses maladies auto-immunes affectant ou non le SNC chez les patients psychotiques et leurs apparentés [7]. Cette association pourrait être expliquée par la présence d’Ac dirigés contre le SNC, comme cela a été signalé dès les années 1930 [8]. Bien que l’hyperdopaminergie reste l’hypothèse neurobiologique prédominante, il existe de nombreux arguments en faveur d’un hypofonctionnement des récepteurs NMDA (R-NMDA) dans la schizophrénie [9]. De plus, l’action de ces Ac sur le R-NMDA dans les encéphalites semble induire les mêmes effets cliniques chez l’homme, ou comportementaux chez l’animal, que lors de l’administration de drogues antagonistes du R-NMDA (kétamine, phencyclidine), qui constitue un modèle de schizophrénie [10]. Plusieurs études ont confirmé la présence de ces Ac dans le sérum de patients schizophrènes ; néanmoins, les mécanismes physiopathologiques potentiellement en cause doivent être précisés [11–13]. Nous présenterons la clinique des encéphalites anti-R-NMDA chez l’adulte, ainsi que les études ayant permis de démontrer la pathogénicité de ces Ac. Puis, nous ferons état des études réalisées chez des patients présentant des symptômes psychiatriques purs, et tenterons d’aborder les questions qu’elles soulèvent. |
Clinique des encéphalites limbiques anti-R-NMDA Épidémiologie Chez l’adulte immunocompétent, les encéphalites ont des causes infectieuses, dysimmunitaires (inflammatoire et auto-immune), mais elles sont le plus souvent idiopathiques [ 14]. Le spectre des encéphalites dysimmunitaires s’est élargi au cours des dernières années, avec la découverte d’Ac ciblant différents antigènes synaptiques : VGKC ( voltage-gated potassium channel), LGI1 ( leucine-rich, glioma inactivated 1) et CASPR2 (contactin-associated protein 2), R-NMDA, R-AMPA (récepteur de l’alpha-amino-3-hydroxy-5-méthylisoxazole-4-propionate, un analogue du glutamate), mGluR5 ( metabotropic glutamate receptor 5), R-GABA B(γ-aminobutyric acid receptor B) et R-glycine (récepteur de la glycine) [ 15]. Selon une étude prospective, les encéphalites à Ac anti-R-NMDA sont la première cause d’encéphalite auto-immune anti-synaptique, et leur fréquence pourrait être similaire à celle des encéphalites virales chez les moins de 30 ans [ 16]. Terrain L’âge médian lors de l’apparition de la maladie est de 21 ans (valeurs extrêmes : six mois à 85 ans), et 81 % des patients sont de sexe féminin. Les hommes sont davantage représentés aux âges extrêmes de la vie, ou en l’absence de tumeur. Un tiers des patients, dont 97 % de femmes, présentent, au moment du diagnostic, une tumeur sous-jacente. Celles-ci sont principalement des tératomes ovariens, bien que d’autres néoplasies aient également été décrites [ 17]. Les formes paranéoplasiques sont moins fréquentes chez l’homme ou chez l’enfant. Symptomatologie clinique habituelle D’apparition subaiguë, les encéphalites limbiques se manifestent par des symptômes neuropsychiatriques associés à des troubles de la mémoire et une épilepsie. Les encéphalites anti-R-NMDA ont une présentation stéréotypée qui évolue classiquement en trois phases :
-
Phase prodromale : dans 70 % des cas, une phase prodromale survient deux semaines avant l’apparition des symptômes psychiatriques ; elle associe des signes pseudo-grippaux, suggérant une infection virale respiratoire ou digestive.
-
Phase psychiatrique : deux semaines après, la majorité des patients présentent des symptômes psychiatriques, et 77 % d’entre eux sont hospitalisés initialement en psychiatrie [2]. Les symptômes psychotiques sont des symptômes positifs (idées délirantes, hallucinations auditives et visuelles), mais également des symptômes dissociatifs et négatifs. Les symptômes thymiques sont le plus souvent de polarité maniaque (irritabilité, agressivité, insomnie), bien que des symptômes dépressifs soient également rencontrés. Ces manifestations sont généralement considérées comme un premier épisode psychotique inaugural d’une schizophrénie ou d’un trouble de l’humeur avec caractéristiques psychotiques. Les traitements neuroleptiques sont peu efficaces sur ces symptômes, et les manifestations neurologiques de la phase secondaire peuvent mimer un syndrome malin des neuroleptiques [10].
-
Phase neurologique : une étiologie organique est évoquée devant les troubles mnésiques, les troubles du langage, et une catatonie. À cette phase de la maladie, les autres manifestations neurologiques sont fréquentes et débutent par des crises d’épilepsie (76 % des cas), des mouvements anormaux (86 %) pouvant être considérés à tort comme psychogènes. Secondairement, des troubles de la conscience (88 %), une dysautonomie (69 %) ou une hypoventilation alvéolaire d’origine centrale (66 %) imposent un transfert en réanimation [2]. Les dyskinésies orofaciales sont les plus caractéristiques, mais des mouvements choréo-athétosiques du tronc ou des membres, des dystonies, une rigidité, un opisthotonos1, ou des crises oculogyres peuvent être observés. À ce stade, des réponses dissociées aux stimulus (diminution de la sensibilité nociceptive et résistance à l’ouverture des paupières) sont notées, similaires à celles des états dissociatifs induits par les antagonistes du R-NMDA (kétamine, PCP [phencyclidine]) [10].
Formes atypiques Des formes frustes ont été décrites avec des crises convulsives, des dystonies, ou des manifestations psychiatriques isolées ; ces formes demeurent néanmoins minoritaires. De plus, les symptômes manquants peuvent apparaître secondairement, notamment au cours des rechutes [ 10]. Les formes psychiatriques isolées sont rares, représentant 4 % des encéphalites à R-NMDA. Elles surviennent lors de l’épisode initial ou de rechutes. Les caractéristiques démographiques, cliniques et la réponse aux traitements dans ces formes sont comparables à celles des formes classiques [ 17]. Examens complémentaires Une ponction lombaire, un EEG (électroencéphalogramme), et une IRM (imagerie par résonance magnétique) s’imposent en urgence devant un tableau d’encéphalite, afin d’écarter une cause infectieuse. Dans les encéphalites anti-R-NMDA, le liquide céphalo-rachidien (LCR) est anormal dans 79 % des cas, associant une pléiocytose lymphocytaire modérée, une protéinorachie normale ou modérément élevée, et une glycorachie normale. Des bandes oligoclonales 2, sont fréquentes et la majorité des patients ont une synthèse intrathécale d’auto-Ac [ 10, 16]. L’EEG est perturbé dans 90 % des cas, montrant des activités ralenties, diffuses, et désorganisées aspécifiques, et parfois des crises comitiales. L’IRM cérébrale est anormale dans un tiers des cas : hypersignaux T2 ou FLAIR ( fluid attenuated inversion recovery), siégeant le plus souvent au niveau de l’hippocampe ou du cortex cérébral [ 16]. Le diagnostic de certitude est apporté par la détection dans le LCR d’Ac de type IgG dirigés contre la sous-unité GluN1. La réactivité des Ac est mise en évidence par trois différentes techniques : chez le rat, en immunohistochimie sur des coupes de cerveau et sur des cultures de neurones hippocampiques, ou en utilisant des cellules rénales embryonnaires humaines transfectées avec de l’ADN codant pour les sous-unités NR1 et NR2 ( cell based assay, CBA). L’immunohistochimie permet d’observer un profil de réactivité hautement spécifique au niveau de l’hippocampe (parfois révélé par d’autres Ac dirigés contre le SNC) qui, conjointement au test cellulaire (confirmant l’identité de l’antigène ciblé), est utilisé en pratique courante pour le diagnostic. En raison de la fréquence des formes paranéoplasiques, la recherche d’un tératome ovarien s’impose chez les femmes. Chez l’homme, il convient d’écarter la présence d’une tumeur testiculaire, pulmonaire ou d’un lymphome. Traitement Malgré la sévérité de ce syndrome, 81 % des patients présentent une issue favorable à un an, après l’instauration d’un traitement étiologique adéquat. Ce traitement, outre l’exérèse chirurgicale d’une tumeur lorsqu’elle est présente, consiste en l’utilisation de thérapeutiques immunologiques de première ligne : stéroïdes, immunoglobulines intraveineuses et plasmaphérèse, seules ou combinées. En l’absence de tumeur, en cas de diagnostic tardif, ou devant la persistance/résurgence de symptômes invalidants, des traitements immunosuppresseurs de seconde ligne sont préconisés (cyclophosphamide et/ou rituximab 3,) [ 16]. Pronostic L’amélioration clinique se fait selon une cinétique lente, dans l’ordre inverse de celui qui était observé lors de l’installation du syndrome : les symptômes neurologiques disparaissent en premier, alors que les manifestations psychiatriques sont les dernières à s’amender. Chez certains patients, la récupération est incomplète, et des symptômes comportementaux persistent. L’administration précoce d’un traitement immunomodulateur dans les formes non paranéoplasiques, ou une exérèse tumorale rapide, représentent des facteurs de bon pronostic. Des rechutes peuvent survenir après des années d’intervalle libre ; elles sont plus fréquentes dans les formes non paranéoplasiques, moins sévères et plus souvent mono-symptomatiques. Une surveillance carcinologique s’impose, particulièrement chez la femme, chez qui une rechute de la maladie doit faire rechercher un tératome récidivant ou non détecté précédemment [ 17]. |
Physiopathologie des encéphalites anti-R-NMDA Rupture de tolérance aux molécules du soi Plusieurs mécanismes peuvent expliquer la rupture de tolérance aux molécules du soi dans les encéphalites anti-R-NMDA (Figure 2). L’analyse histologique des tératomes révèle la présence du R-NMDA au sein de tissu nerveux ectopique, mais le lien avec les autres tumeurs n’a pas été établi. La rencontre entre ces antigènes (normalement séquestrés au sein du SNC) et les cellules immunitaires déclenche une réaction auto-immune dirigée contre le tissu nerveux tumoral. La phase prodromale pseudo-infectieuse suggère, en outre, le rôle d’agents infectieux qui, par mimétisme moléculaire ou libération d’antigènes lors de dégâts tissulaires (infection du SNC), induisent une réaction auto-immune anti-R-NMDA. Ainsi, plusieurs agents infectieux pourraient être associés à la présence de ces auto-Ac : Mycoplasma pneumoniae [ 18], VZV (virus varicella-zona), virus de la grippe H1N1 [ 10], et les infections systémiques, comme les vaccins, pourraient jouer un rôle adjuvant. De plus, lors des encéphalites herpétiques, une réaction auto-immune anti-R-NMDA secondaire pourrait se développer [ 19]. Néanmoins, aucun de ces pathogènes n’a été retrouvé de façon systématique [ 10]. À l’instar d’autres maladies auto-immunes, des facteurs de susceptibilité génétiques ont également été suggérés, comme en témoigne une association entre la séropositivité anti-R-NMDA et le gène HLA-A03 [ 13], ou un cas d’encéphalite associé à une microdélétion du bras court du chromosome 6 (porteur des gènes du CMH [complexe majeur d’histocompatibilité]) [ 20] ( →). De plus, la présence d’un terrain prédisposant à l’auto-immunité (incidence accrue d’autres auto-Ac [Ac anti-nucléaires ou anti-thyroperoxydase]) pourrait favoriser la survenue des encéphalites anti-R-NMDA [ 10] .
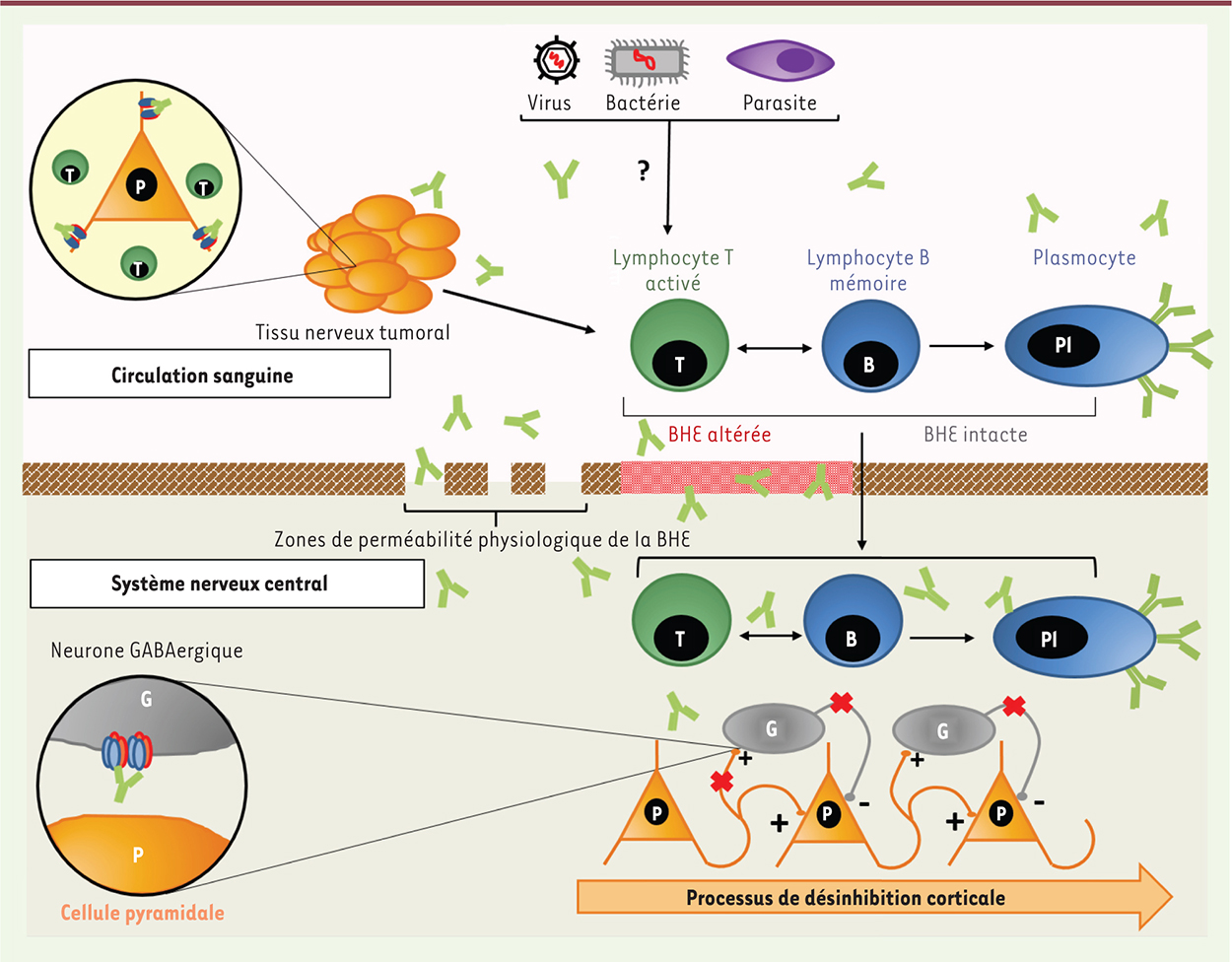
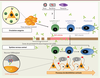 | Figure 2.
Physiopathologie des encéphalites anti-R-NMDA. Certains agents infectieux (virus, bactérie, parasite), par mimétisme moléculaire ou libération d’antigènes lors de dégâts tissulaires, induisent une réaction auto-immune anti-R-NMDA. Suite à l’altération de la perméabilité de la BHE dans certaines conditions pathologiques (stress, traumatisme, infection), les lymphocytes T activés et les lymphocytes B mémoires, générés par la réaction immunitaire initiée en périphérie, peuvent traverser la BHE, produisant alors une nouvelle stimulation antigénique dans le SNC et générant des plasmocytes producteurs d’IgG anti-NR1. |
(→) Voir aussi la synthèse de L. Jacob et Y. Dauvilliers, m/s, n° 12, décembre 2014, page 1136
Accès au système nerveux central La barrière hématoencéphalique (BHE) restreint normalement l’accès des cellules immunitaires et des Ac au SNC (Figure 2). Toutefois, elle est absente de façon physiologique dans les plexus choroïdes ou les organes circumventriculaires, et sa perméabilité est altérée dans certaines conditions pathologiques (stress, traumatisme, infection). Les lymphocytes T activés et B mémoires, générés lors de la réaction immunitaire qui survient en périphérie, peuvent traverser la BHE normale ou altérée, produisant alors une nouvelle stimulation antigénique dans le SNC et générant des plasmocytes producteurs d’IgG anti-NR1. Les Ac anti-R-NMDA sont retrouvés, par définition, dans le LCR, et les données suggèrent à la fois un transfert passif à travers une BHE altérée et une synthèse intrathécale [ 21, 22]. Effets des Ac anti-R-NMDA L’épitope ciblé par les IgG anti-NR1 est situé au niveau de l’acide aminé 369 de la région amino-terminale extracellulaire de la sous-unité NR1 [ 23]. La diffusion dans la membrane des récepteurs et le contenu synaptique en R-NMDA sont régulés par le niveau d’expression du récepteur à activité tyrosine kinase éphrine B2 (R-EPHB2), avec lequel R-NMDA s’associe au niveau de la région amino-terminale de GluN1. La fixation des Ac fragilise l’interaction entre le R-EPHB2 et le R-NMDA (Figure 1), induisant une dispersion latérale de ces deux récepteurs normalement synaptiques [ 21]. Les R-NMDA extra-synaptiques recouverts et dimérisés par les Ac sont finalement l’objet d’une internalisation intracellulaire secondaire [ 24]. Chez le rat, les études in vitro et in vivo ont démontré que les Ac anti-R-NMDA diminuent, de façon sélective, réversible et dépendante de la concentration, le contenu de surface et la densité des amas synaptiques de R-NMDA [ 21, 24]. Sur le plan électrophysiologique, ils induisent une modification sélective des courants synaptiques relayés par les R-NMDA, et inhibent les mécanismes de potentialisation à long terme [ 21, 25]. Cette diminution du nombre de R-NMDA affecte principalement les neurones GABAergiques (plus riches en R-NMDA que d’autres types neuronaux) et leur transmission inhibitrice, responsable d’une décharge excessive et désorganisée des cellules pyramidales glutamatergiques (processus de désinhibition corticale). Ces neurones sont alors inaptes à répondre de manière efficace aux stimulus afférents et à transmettre les activités neurales aux régions sous-corticales. Au niveau tissulaire, les biopsies cérébrales et les autopsies révèlent un infiltrat lymphocytaire périvasculaire modéré, une activation microgliale et une densité de R-NMDA diminuée dans les hippocampes, mais pas de lésion cellulaire [ 2, 24]. Alors que les effets pathogènes des IgG anti-NR1 dans les encéphalites anti-R-NMDA sont démontrés par ces nombreuses études fonctionnelles, ceux d’autres isotypes (IgM, IgA) restent encore discutés. |
Prévalence des auto-Ac anti-R-NMDA en psychiatrie Schizophrénie et troubles apparentés Depuis 2011, plusieurs auteurs ont étudié la présence d’auto-Ac anti-R-NMDA dans le sérum de patients psychotiques en l’absence de tout autre signe d’encéphalite. Récemment, Pollak et al. [ 26] ont réalisé une revue quantitative de la prévalence des auto-Ac anti-R-NMDA dans la schizophrénie et les troubles apparentés. Sur les sept études retenues dans leur analyse (Tableau I), ils disposaient des résultats des tests sériques de 1 441 patients et de 1 598 témoins sains. La séroprévalence des IgG anti-R-NMDA était significativement plus élevée chez les patients (χ2 = 11,70, p < 0,01), mais ne différait pas de celle des contrôles si l’on considérait l’ensemble des sous-classes (IgG + IgM + IgA). Néanmoins la présence d’IgG anti-NR1, qui sont les seuls dont la pathogénicité a été démontrée, reste rare : 1,46 % (95 % CI 0,94-2,23) pour l’ensemble des patients schizophrènes, et 1,8 % dans les premiers épisodes de psychose. De plus, la majorité de ces études reposent sur les résultats des seuls tests CBA, et le risque de faux-positifs ne peut pas être écarté ; la seule étude s’appuyant sur les méthodes constituant le gold standard ne retrouve aucun patient positif pour les IgG anti-NR1 [ 27]. Tableau I.
| Étude |
Population étudiée |
Isotype |
Méthodes de détection |
Résultats chez Szn/N |
Résultats chez Ctn/N |
| [3] |
Premier épisode psychotique |
IgG |
IF CBA |
3/46 (6,5 %) |
Pas de contrôle |
|
| [38] |
Schizophrénie |
IgG |
IF CBA (Euroimmun) (NR1) |
0/7 (0 %) |
0/3 (0 %) |
| [11] |
Schizophrénie et trouble schizoaffectif |
IgG |
IF CBA (NR1/NR2b) |
4/51 (7,8 %) |
Pas de contrôle |
| Culture de neurones hippocampiques |
|
| [39] |
Trouble psychotique |
? |
IF CBA (Euroimmun) (NR1a/NR1a; NR1a/NR2b) |
0/50 (0 %) |
Pas de contrôle |
|
| [27] |
Premier épisode psychotique |
IgG |
IF CBA (NR1) |
0/80 (0 %) |
0/40 (0 %) |
| Immunohistochimie |
| Culture de neurones hippocampiques |
|
| [12] |
Schizophrénie aiguë |
IgG + IgA + IgM |
IF CBA (Euroimmun) (NR1a ; NR1a/NR2b) |
12/121 (9,9 %) |
1/230 (0,4 %) |
|
| [13] |
Schizophrénie et trouble schizoaffectif |
IgG + IgA + IgM |
IF CBA (Euroimmun) (NR1 ; NR1/NR2b) |
93/1081 (8,6 %) |
143/1325 (10,8 %) |
Études des Ac anti-R-NMDA dans la schizophrénie et les troubles apparentés. Résultats exprimés n/N (%) : n : nombre de sujets positifs ; N : nombre de sujets testés. CBA : immunofluorescence indirecte sur cell-based assay (sous-unités R-NMDA transfectées dans HEK293) ; Ct : contrôle sain ; Euroimmun : kit commercial produit par Euroimmun (Lübeck, Allemagne) ; Sz : schizophrène. |
Selon Hammer et al., les séroprévalences sont identiques chez les patients et les témoins, et la différence entre les porteurs sains d’Ac anti-NR1 et ceux souffrant de troubles psychotiques est liée à un défaut de perméabilité de la BHE. Comme l’ont souligné Titulaer et Dalmau, cette théorie semble infondée au regard des limites de cette étude [28]. Cette hypothèse reste néanmoins intéressante et, bien que la littérature semble en défaveur d’anomalies structurales majeures de la BHE dans la schizophrénie, certaines études suggèrent un dysfonctionnement des cellules endothéliales qui la composent, induit par le stress oxydatif et l’inflammation [29]. Autres troubles psychiatriques Des IgG anti-NR1 sériques ont été retrouvées chez des patients ayant des tableaux psychiatriques variés (autisme, trouble conversif, dépression ou manie avec symptômes psychotiques, etc.), mais pour lesquels le diagnostic d’encéphalite anti-NMDA-R a été finalement retenu compte tenu de la présence de symptômes neurologiques ou de ces Ac dans le LCR [ 30– 33]. Steiner et al. retrouvent des IgA sériques anti-NR1 chez deux des 70 patients testés (2,8 %) présentant un diagnostic de premier épisode dépressif avec symptômes psychotiques, mais chez aucun des 38 patients ayant un trouble de la personnalité borderline [ 12]. L’étude de Hammer a révélé, quant à elle, des Ac anti-NR1 chez 24 des 148 patients souffrant d’un trouble de l’humeur (16,2 % tous isotypes confondus et 3,4 % pour les IgG seules). De plus, ces Ac anti-NR1 ont également été décrits dans diverses affections neuropsychiatriques (narcolepsie [ 41], démence, encéphalite herpétique), où ils pourraient être associés à la survenue de symptômes psychotiques [ 11, 20, 34]. Enfin, signalons que des Ac anti-NR2 ont été étudiés par des méthodes immuno-enzymatiques quantitatives, et trouvés à des concentrations plus élevées à l’admission chez les patients maniaques que chez des patients schizophrènes ou des sujets contrôles [ 35]. Ces Ac pourraient être en lien avec des dommages tissulaires ou une réaction immunitaire au sein du SNC. Néanmoins, les effets pathogènes de ces Ac, qui avaient déjà été évoqués dans le neurolupus, ne sont pas connus [ 36]. |
En conclusion, le concept d’encéphalite liée à l’action pathogène d’IgG anti-GluN1 est aujourd’hui parfaitement reconnu par la communauté médicale et scientifique. En effet, les manifestations cliniques compatibles avec les modèles d’antagonisme du R-NMDA, les études in vitro et in vivo démontrant leur effet pathogène, ou encore les effets des thérapeutiques immunologiques, sont très en faveur de cette hypothèse. Plusieurs études ont rapporté la présence de ces Ac chez des patients psychotiques, et il existe de forts arguments faisant suspecter leur action pathogène dans la schizophrénie, particulièrement lors des premiers épisodes. Toutefois, bien que la séroprévalence des IgG anti-NR1 chez les schizophrènes soit supérieure à celle des sujets contrôles, elle reste faible ; il est donc peu probable que ces Ac puissent expliquer la majorité des cas de schizophrénie [37]. De plus, l’accès de ces Ac au SNC et leurs effets pathogènes restent à démontrer dans cette pathologie, comme ils l’ont été en neurologie. Selon certains auteurs, certains cas de schizophrénie pourraient être des encéphalites frustes, situées à l’extrémité d’un continuum clinique de sévérité croissante en lien avec une pathogénicité graduelle des Ac, et culminant en des cas d’encéphalite pleinement constitués [26]. La comparaison des titres et des effets des Ac anti-R-NMDA dans le LCR des sujets présentant une encéphalite, une schizophrénie ou dans celui de sujets normaux, permettrait de discuter la pertinence de ce modèle. Au cours des dernières années, un nombre important d’autres encéphalites limbiques associées à des Ac anti-synaptiques (anti-VGKC, -R-AMPA, -mGluR5, -R-GABAB, -R-glycine) ont été décrits et tendent à rendre encore plus poreuse la frontière séparant les troubles psychotiques organiques et fonctionnels [15]. Ce sujet soulève également des questions diagnostiques et thérapeutiques majeures pour les patients psychotiques qui sont porteurs de tels anticorps. Ces patients pourraient, comme l’a suggéré Kayser, avoir une encéphalite et rechuter sous une forme plus complète de la maladie en l’absence de traitement adapté [17]. La recherche de pathologies somatiques (encéphalite, maladie auto-immune, cancer) s’impose compte tenu de leur gravité potentielle et de l’existence de traitements curatifs. L’identification de sous-groupes de patients chez lesquels ce marqueur biologique est associé à certaines caractéristiques cliniques ou anomalies paracliniques, pourrait permettre d’identifier des thérapeutiques au plus près des mécanismes étiopathogéniques responsables. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Dalmau J, Tüzün E, Wu H, et al. Paraneoplastic anti-N-methyl-D-aspartate receptor encephalitis associated with ovarian teratoma . Ann Neurol. 2007; ; 61 : :25.–36. 2.
Dalmau J, Gleichman AJ, Hughes EG, et al. Anti-NMDA-receptor encephalitis: case series and analysis of the effects of antibodies . Lancet Neurol. 2008; ; 7 : :1091.–1098. 3.
Zandi MS, Irani SR, Lang B, et al. Disease-relevant autoantibodies in first episode schizophrenia . J Neurol. 2011; ; 258 : :686.–688. 4.
Brown AS, Derkits EJ. Prenatal infection and schizophrenia: a review of epidemiologic and translational studies . Am J Psychiatry. 2010; ; 167 : :261.–280. 5.
Miller BJ, Buckley P, Seabolt W, et al. Meta-analysis of cytokine alterations in schizophrenia: clinical status and antipsychotic effects . Biol Psychiatry. 2011; ; 70 : :663.–671. 6.
Stefansson H, Ophoff RA, Steinberg S, et al. Common variants conferring risk of schizophrenia . Nature. 2009; ; 460 : :744.–747. 7.
Benros ME, Eaton WW, Mortensen PB. The epidemiologic evidence linking autoimmune diseases and psychosis . Biol Psychiatry. 2014; ; 75 : :300.–306. 8.
Henneberg AE, Horter S, Ruffert S. Increased prevalence of antibrain antibodies in the sera from schizophrenic patients . Schizophr Res. 1994; ; 14 : :15.–22. 9.
Kantrowitz JT, Javitt DC. N-methyl-D-aspartate (NMDA) receptor dysfunction or dysregulation: the final common pathway on the road to schizophrenia ? Brain Res Bull. 2010; ; 83 : :108.–121. 10.
Dalmau J, Lancaster E, Martinez-Hernandez E, et al. Clinical experience and laboratory investigations in patients with anti-NMDAR encephalitis . Lancet Neurol. 2011; ; 10 : :63.–74. 11.
Tsutsui K, Kanbayashi T, Tanaka K, et al. Anti-NMDA-receptor antibody detected in encephalitis, schizophrenia, and narcolepsy with psychotic features . BMC Psychiatry. 2012; ; 12 : :37.. 12.
Steiner J, Walter M, Glanz W, et al. Increased prevalence of diverse N-methyl-D-aspartate glutamate receptor antibodies in patients with an initial diagnosis of schizophrenia: Specific relevance of IgG NR1a antibodies for distinction from N-methyl-D-aspartate glutamate receptor encephalitis . JAMA Psychiatry. 2013; ; 70 : :271.–278. 13.
Hammer C, Stepniak B, Schneider A, et al. Neuropsychiatric disease relevance of circulating anti-NMDA receptor autoantibodies depends on blood-brain barrier integrity . Mol Psychiatry. 2014; ; 19 : :1143.–1149. 14.
Granerod J, Ambrose HE, Davies NW, et al. Causes of encephalitis and differences in their clinical presentations in England: a multicentre, population-based prospective study . Lancet Infect Dis. 2010; ; 10 : :835.–844. 15.
Vincent A, Bien CG, Irani SR, et al. Autoantibodies associated with diseases of the CNS: new developments and future challenges . Lancet Neurol. 2011; ; 10 : :759.–772. 16.
Gable MS, Sheriff H, Dalmau J, et al. The frequency of autoimmune N-methyl-D-aspartate receptor encephalitis surpasses that of individual viral etiologies in young individuals enrolled in the california encephalitis project . Clin Infect Dis. 2012; ; 54 : :899.–904. 17.
Titulaer MJ, McCracken L, Gabilondo I, et al. Treatment and prognostic factors for long-term outcome in patients with anti-NMDA receptor encephalitis: an observational cohort study . Lancet Neurol. 2013; ; 12 : :157.–165. 18.
Kayser MS, Titulaer MJ, Gresa-Arribas N, et al. Frequency and characteristics of isolated psychiatric episodes in anti–N-methyl-D-aspartate receptor encephalitis . JAMA Neurol. 2013; ; 70 : :1133.–1139. 19.
Gable MS, Gavali S, Radner A, et al. Anti-NMDA receptor encephalitis: report of ten cases and comparison with viral encephalitis . Eur J Clin Microbiol Infect Dis. 2009; ; 28 : :1421.–1429. 20.
Prüss H, Finke C, Höltje M, et al. N-methyl-D-aspartate receptor antibodies in herpes simplex encephalitis . Ann Neurol. 2012; ; 72 : :902.–911. 21.
Moscato EH, Jain A, Peng X, et al. Mechanisms underlying autoimmune synaptic encephalitis leading to disorders of memory, behavior and cognition: insights from molecular, cellular and synaptic studies . Eur J Neurosci. 2010; ; 32 : :298.–309. 22.
Irani SR, Bera K, Waters P, et al. N-methyl-D-aspartate antibody encephalitis: temporal progression of clinical and paraclinical observations in a predominantly non-paraneoplastic disorder of both sexes . Brain. 2010; ; 133 : :1655.–1667. 23.
Gresa-Arribas N, Titulaer MJ, Torrents A, et al. Antibody titres at diagnosis and during follow-up of anti-NMDA receptor encephalitis: a retrospective study . Lancet Neurol. 2014; ; 13 : :167.–177. 24.
Verhelst H, Verloo P, Dhondt K, et al. Anti-NMDA-receptor encephalitis in a 3 year old patient with chromosome 6p21.32 microdeletion including the HLA cluster . Eur J Paediatr Neurol. 2011; ; 15 : :163.–166. 25.
Zhang Q, Tanaka K, Sun P, et al. Suppression of synaptic plasticity by cerebrospinal fluid from anti-NMDA receptor encephalitis patients . Neurobiol Dis. 2012; ; 45 : :610.–615. 26.
Pollak TA, McCormack R, Peakman M, et al. Prevalence of anti-N-methyl-d-aspartate (NMDA) antibodies in patients with schizophrenia and related psychoses: a systematic review and meta-analysis . Psychol Med. 2014; ; 44 : :2475.–2487. 27.
Masdeu JC, González-Pinto A, Matute C, et al. Serum IgG antibodies against the NR1 subunit of the NMDA receptor not detected in schizophrenia . Am J Psychiatry. 2012; ; 169 : :1120.–1121. 28.
Titulaer MJ, Dalmau J. Antibodies to NMDA receptor, blood-brain barrier disruption and schizophrenia: a theory with unproven links . Mol Psychiatry. 2014; ; 19 : :1054.. 29.
Najjar S, Pearlman DM, Alper K, et al. Neuroinflammation and psychiatric illness . J Neuroinflammation. 2013; ; 10 : :43.. 30.
Creten C, van der Zwaan S, Blankespoor RJ, et al. Late onset autism and anti-NMDA-receptor encephalitis . Lancet. 2011; ; 378 : :98.. 31.
Caplan JP, Binius T, Lennon VA, et al. Pseudopseudoseizures: conditions that may mimic psychogenic non-epileptic seizures . Psychosomatics. 2011; ; 52 : :501.–506. 32.
Lebon S, Mayor-Dubois C, Popea I, et al. Anti-N-methyl-D-aspartate (NMDA) receptor encephalitis mimicking a primary psychiatric disorder in an adolescent . J Child Neurol. 2012; ; 27 : :1607.–1610. 33.
Choe C, Karamatskos E, Schattling B, et al. A clinical and neurobiological case of IgM NMDA receptor antibody associated encephalitis mimicking bipolar disorder . Psychiatry Res. 2013; ; 208 : :194.–196. 34.
Busse S, Busse M, Brix B, et al. Seroprevalence of N-methyl-D-aspartate glutamate receptor (NMDA-R) autoantibodies in aging subjects without neuropsychiatric disorders and in dementia patients . Eur Arch Psychiatry Clin Neurosci. 2014; ; 264 : :545.–550. 35.
Dickerson F, Stallings C, Vaughan C, et al. Antibodies to the glutamate receptor in mania . Bipolar Disord. 2012; ; 14 : :547.–553. 36.
Lauvsnes MB, Omdal R. Systemic lupus erythematosus, the brain, and anti-NR2 antibodies . J Neurol. 2012; ; 259 : :622.–629. 37.
Mikasova L, De Rossi P, Bouchet D, et al. Disrupted surface cross-talk between NMDA and Ephrin-B2 receptors in anti-NMDA encephalitis . Brain J Neurol. 2012; ; 135 : :1606.–1621. 38.
Rhoads J, Guirgis H, McKnight C, Duchemin AM. Lack of anti-NMDA receptor autoantibodies in the serum of subjects with schirophrenia . Schizophr Res. 2011; ; 129 : :213.–214. 39.
Haussleiter IS, Emons B, Schaub M, et al. Investigation of antibodies against synaptic proteins in a cross-sectional cohort of psychotic pateints . Schizophr Res. 2012; ; 140 : :258.–259. 40.
Gielen M.. Fonctionnement des récepteurs-canaux du glutamate . Med Sci (Paris). 2010; ; 26 : :65.–72. 41.
Jacob L, Dauvilliers Y. La narcolepsie : une maladie auto-immune ? Med Sci (Paris). 2014; ; 30 : :1136.–1143. |