| |
| Med Sci (Paris). 2014 December; 30(12): 1184–1186. Published online 2014 December 24. doi: 10.1051/medsci/20143012023.Chroniques génomiques - Hétérogénéité des tumeurs : l’apport du séquençage sur cellules individuelles Bertrand Jordan1,2*** 1UMR 7268 ADÉS, Aix-Marseille Université/EFS/CNRS, Espace éthique méditerranéen, hôpital d’adultes la Timone, 264, rue Saint-Pierre, 13385Marseille Cedex 05, France 2CoReBio PACA, case901, parc scientifique de Luminy, 13288Marseille Cedex 09, France MeSH keywords: Tumeurs du sein, génétique, Cellules, composition chimique, Hétérogénéité génétique, Humains, Tumeurs, anatomopathologie, Mutation ponctuelle, Analyse sur cellule unique |
L’hétérogénéité de beaucoup de tumeurs au niveau génomique, c’est-à-dire le fait que coexistent en leur sein des cellules portant des mutations différentes, est une réalité qui s’impose depuis quelques années, à mesure que progressent les techniques d’analyse et qu’elles permettent une évaluation de plus en plus fine des caractéristiques tumorales. Cette diversité a d’importantes conséquences cliniques, notamment en termes d’apparition de résistances aux traitements [
1]. Le perfectionnement des méthodes de séquençage de nouvelle génération (NGS, New generation sequencing) permet aujourd’hui d’envisager la lecture du génome d’une seule cellule [
2], grâce notamment à la mise au point de systèmes d’amplification qui assurent une représentation équilibrée des différentes séquences présentes dans l’échantillon de départ. L’approche reste néanmoins très délicate, et a surtout été utilisée dans un premier temps pour évaluer les profils d’amplification et de délétion (copy number profiles) [
3]. Mais différentes améliorations méthodologiques permettent aujourd’hui d’accéder aussi aux mutations ponctuelles et de poser la question de l’hétérogénéité à ce niveau. Une des études les plus marquantes, publiée cet été par la revue Nature [
4] et portant sur deux sous-types de cancer du sein, arrive à la conclusion que les cellules tumorales sont toutes différentes au niveau génétique (no two single tumour cells are genetically identical) - résultat dont les conséquences scientifiques et cliniques sont d’une très grande importance. Le but de cette chronique est de donner une idée de ces résultats ainsi que de la manière dont ils ont été obtenus, et d’évoquer leurs implications. |
Établir et vérifier des profils individuels Les auteurs ont étudié deux tumeurs du sein, l’une (dite ERBC) correspondant au sous-type luminal A (ER+/PR+/Her2-)1, l’autre (dite TNBC) au sous-type dit « triple négatif » (ER-/PR-/Her2-). Il est important de noter que les malades n’avaient pas été traités avant l’opération, et que ces tumeurs n’avaient dont été soumises ni à la chimiothérapie ni à la radiothérapie. La technique employée repose sur une lyse douce des cellules, suivie de l’isolement par cytométrie en flux de noyaux en phase G2/M, ayant déjà dupliqué leur ADN, donc tétraploïdes (contenu individuel 12 pg d’ADN). C’est à partir de tels noyaux qu’est pratiquée une amplification de type MDA (multiple displacement amplification [
5]), suivie de la construction d’une librairie et du séquençage sur une machine Illumina. En fait, un premier séquençage à basse redondance (1x) est pratiqué pour choisir les meilleures librairies en termes de couverture du génome, et celles-ci sont ensuite séquencées, dans la plupart des cas, au niveau de leur exome. La méthode a naturellement été étalonnée sur des lignées cellulaires monoclonales et des cellules isolées de ces lignées, et a montré un faible taux de faux positifs (10-6). Mais les auteurs ont de plus voulu s’assurer de la réalité des mutations détectées dans les cellules tumorales en utilisant une technique astucieuse récemment publiée [
6]. Sommairement, celle-ci repose sur la ligation d’un mélange très complexe de séquences aléatoires à l’ADN tumoral global (extrait d’un échantillon de tumeur) avant amplification, dans des conditions telles que chaque fragment d’ADN tumoral est attaché à une séquence unique. Après amplification et séquençage, on peut donc reconnaître les fragments qui correspondent à une molécule donnée à l’origine, et ainsi obtenir l’équivalent du séquençage d’une seule molécule. Cette approche, appelée « séquençage ciblé sur la molécule unique » (single-molecule targeted deep sequencing) est utilisée pour vérifier la présence dans l’ADN tumoral global des mutations repérées par séquençage d’un noyau isolé, et s’assurer ainsi qu’il ne s’agit pas d’artéfacts ou d’erreurs de séquençage. Elle permet aussi d’évaluer la fréquence de la mutation concernée au sein de l’ensemble des cellules tumorales. Le taux de validation pour les mutations rares va de 65 % (pour la tumeur TNBC) à 90 % (pour ERBC), ce qui est très satisfaisant pour une technique aussi acrobatique. Au total, ce travail, qui se situe aux limites de la technologie actuelle, apparaît bien contrôlé et devant être pris au sérieux, d’autant qu’il émane d’experts en la matière (MD Anderson cancer center, Texas, et Dana Farber cancer institute, Boston). Voyons donc ses conclusions. |
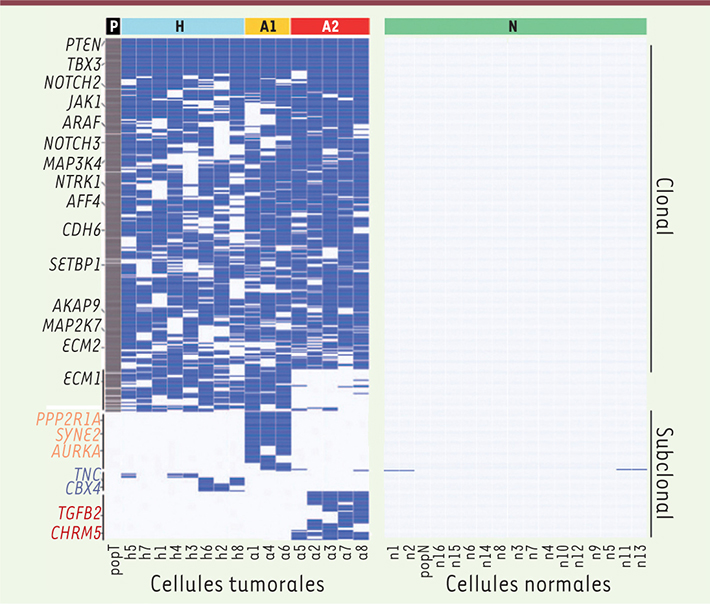
Pour chacune des deux tumeurs, il a été procédé au séquençage « en masse » de noyaux (quelques millions) et à la comparaison avec les résultats obtenus de la même manière sur le tissu normal correspondant, afin de déterminer quelles sont les mutations les plus représentées dans la tumeur. On repère ainsi 12 mutations non synonymes dans les régions codantes (validées par séquençage de l’exome) pour ERBC et 374 pour TNBC (sous-type dont on savait déjà qu’il portait plus de mutations), beaucoup d’entre elles touchent des gènes connus pour leur implication dans le cancer. On passe alors aux analyses sur cellule unique, d’abord pour évaluer les profils chromosomiques, qui indiquent une seule population pour ERBC, et deux pour TNBC. La diversité au niveau chromosomique est donc limitée, indiquant que les évènements correspondants ont dû avoir lieu assez tôt dans l’évolution de la tumeur. En revanche, l’analyse de séquence sur cellules isolées (51 cellules tumorales et 12 normales pour ERBC, 16 tumorales et 16 normales pour TNBC) montre des profils très diversifiés. Les mutations vues dans l’échantillon global sont retrouvées dans la grande majorité des cellules tumorales individuelles, mais des mutations supplémentaires sont détectées. On tient compte uniquement, par la suite, des mutations détectées deux fois (dans deux cellules individuelles différentes), appelées « subclonales » par les auteurs : celles qui sont trouvées dans une seule cellule sont trop difficiles à distinguer des erreurs de séquence, et d’ailleurs leur taux de confirmation par séquençage ciblé est faible (25 % au lieu de 65 à 90 % pour les « subclonales »). Au total, une cinquantaine de telles altérations sont trouvées pour la première tumeur, et près de deux cents pour la seconde. Et le profil individuel de chaque cellule est différent de tous les autres (Figure 1, montrant les données pour la tumeur TNBC). Bien entendu, les cellules normales ne montrent aucune mutation, à une exception près. Il s’agit donc de mutations qui ne concernent à chaque fois qu’un nombre limité de cellules tumorales, ce qui explique qu’elles n’apparaissent pas dans le profil global réalisé sur un mélange de cellules (de noyaux, plus précisément). Les évaluations de fréquence que permet le séquençage ciblé confirment ce point, indiquant pour ces « subclonales » une fréquence de l’ordre de 5 % contre 45 % en moyenne pour celles qui sont repérées lors du séquençage en masse. Restent encore les mutations observées sur une seule cellule individuelle (appelées de novo et non représentées sur la Figure 1), dont une partie doit bien correspondre à une réalité (et non à une erreur de séquence) et dont la fréquence tombe au-dessous de un pour mille. Une estimation du nombre de divisions et du nombre de cellules de la tumeur suggère que le taux de mutation reste normal pour ERBC (soit environ 10-10 par base et par division) tandis qu’il est significativement plus élevé, multiplié par 13, pour TNBC.
 | Figure 1.
Mutations observées dans la tumeur TNBC. Tout à gauche : répartition des 374 mutations ponctuelles observées par séquençage global de la tumeur, avec indication dans la marge de certains des gènes impliqués. à gauche, colonnes suivantes : mutations observées dans 16 noyaux individuels provenant de la tumeur. On voit (haut de la figure) que la plupart des mutations observées par séquençage global sont retrouvées dans chaque cellule, mais avec des différences notables de l’une à l’autre. De plus des mutations non observées par séquençage global (car trop minoritaires) sont vues dans les cellules individuelles (bas de la figure), avec de nouveau des différences entre cellules. Au total, le spectre de mutations de chaque cellule est différent de tous les autres. Les profils présentés sont regroupés, en fonction de leur similitude, en trois classes, H, A1 et A2 (en haut). à droite, résultats obtenus par la même technique sur des cellules témoin non tumorales. à une exception près, aucune mutation n’est observée (adaptée de la figure 3 de Wang et al. [4], avec la permission de MacMillan Publishers, 2014). |
On en arrive donc à une image de tumeurs qui évoluent - en l’absence de toute pression sélective due à un traitement - d’abord par réarrangements chromosomiques, puis par mutations ponctuelles accumulées au fil des divisions cellulaires. La masse tumorale n’est pas homogène, et n’est même pas formée de quelques clones différant par une ou plusieurs mutations : elle comporte quelques grandes catégories, mais chacune de celles-ci est fortement diversifiée. Les auteurs s’avancent sûrement un peu en affirmant que les cellules tumorales sont toutes différentes : leur échantillon est bien trop limité pour démontrer cela. Néanmoins, l’hétérogénéité observée est réelle, validée par une approche technique bien au point et confirmée par les résultats négatifs sur les cellules normales. Deux articles récents portant sur le cancer du poumon et analysant différents fragments de tumeur vont dans le même sens [
7,
8]. |
Quelle stratégie thérapeutique ? Les grands espoirs fondés sur les thérapies ciblées, s’attaquant à une anomalie repérée grâce à l’analyse moléculaire des cellules tumorales, ont été partiellement déçus. Dans bien des cas, ces traitements sont efficaces et réduisent, ou même font disparaître, la tumeur, mais celle-ci réapparaît au bout de quelques mois et n’est plus sensible à l’agent employé [1]. Il s’agit donc de la multiplication de cellules tumorales ne présentant pas l’anomalie précédemment ciblée, dont on pouvait se demander si l’apparition était liée au traitement utilisé. Les résultats de Wang et al. [4] montrent clairement (au moins pour les deux cancers étudiés) qu’une grande diversité génétique existe au sein de la tumeur avant tout traitement, et que celui-ci ne fait qu’exercer une sélection darwinienne qui favorise les cellules résistantes. Cela complique évidemment les choses, et éloigne la perspective de traitements combinés ciblant simultanément deux ou trois anomalies - puisque la tumeur s’avère avoir « en réserve » un grand nombre de mutations minoritaires. Cela renforce en revanche l’intérêt des immunothérapies qui sont actuellement l’objet d’un grand engouement [
9]. Visant à stimuler le système immunitaire, ou du moins à bloquer les mécanismes par lesquels la tumeur l’inactive, ces approches ont par nature un spectre d’action large et pourraient, combinés à une thérapie ciblée visant l’espèce cellulaire majoritaire au sein de la tumeur, assurer l’élimination des cellules encore minoritaires avant que celles-ci ne se développent. Plusieurs essais cliniques actuellement en cours nous diront si cette voie est aussi prometteuse qu’elle le semble. Enfin, on pourrait s’intéresser de façon plus marquée aux événements précoces dans la cancérogenèse, comme le suggèrent Hait et Levine dans un récent article [
10]. Leurs arguments en faveur d’un effort de recherche important sur les lésions précancéreuses, débouchant sur de nouvelles connaissances et de nouveaux moyens de prévention avant que les tumeurs n’aient eu le temps de se diversifier, sont assez séduisants. Néanmoins, le passé récent a montré que la mise en place de dépistages à grande échelle pouvait avoir des effets négatifs, en induisant une tendance au sur-traitement dont les risques apparaissent aujourd’hui, par exemple pour le cancer de la prostate [
11]. Une telle dérive semble difficile à éviter si l’on s’intéresse à des lésions très précoces, à moins que l’on dispose de marqueurs vraiment performants permettant de prédire à coup sûr leur évolution. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Saunders
NA
,
Simpson
F
,
Thompson
EW
, et al.
Role of intratumoural heterogeneity in cancer drug resistance: molecular and clinical perspectives . EMBO Mol Med.
2012; ; 4 : :675.–684. 2.
Zong
C
,
Lu
S
.,
Chapma, AR
,
Xie
XS
. Genome-wide detection of single nucleotide and copy-number variations of a single human cell . Science.
2012; ; 338 : :1622.–1626. 3.
Navin, N
.
Kendall
J
,
Troge
J
, et al.
Tumour evolution inferred by single-cell sequencing . Nature.
2011; ; 472 : :90.–94. 4.
Wang
Y
,
Waters
J
,
Leung
ML
, et al.
Clonal evolution in breast cancer revealed by single nucleus genome sequencing . Nature.
2014; ; 512 : :155.–160. 5.
Hou, Y
.
Song
L
,
Zhu
P
, et al.
Single-cell exome sequencing and monoclonal evolution of a JAK2-negative myeloproliferative neoplasm . Cell.
2012; ; 148 : :873.–885. 6.
Schmitt, M. W.
Kennedy
SR
,
Salk
JJ
, et al.
Detection of ultra-rare mutations by next-generation sequencing . Proc Natl Acad Sci USA.
2012; ; 109 : :14508.–14513. 7.
De Bruin
EC
,
McGranahan
N
,
Mitter
R
, et al.
Spatial and temporal diversity in genomic instability processes defines lung cancer evolution . Science.
2014; ; 346 : :251.–256. 8.
Zhang
J
,
Fujimoto
J
,
Zhang
J
, et al.
Intratumor heterogeneity in localized lung adenocarcinomas delineated by multiregion sequencing . Science.
2014; ; 346 : :256.–259. 9.
Rosenberg
SA
. Decade in review-cancer immunotherapy: Entering the mainstream of cancer treatment . Nature Rev Clin Onc.
2014; ; 11 : :630.–632. 10.
Hait
WN
,
Levine
AJ
. Genomic complexity: a call to action . Sci Transl Med.
2014; ; 6 : :255cm10.. 11.
Esserman
LJ
,
Thompson
IM, Jr
,
Reid
B
. Overdiagnosis and overtreatment in cancer: an opportunity for improvement . JAMA.
2013; ; 310 : :797.–798. |