| |
| Med Sci (Paris). 2014 December; 30(12): 1129–1135. Published online 2014 December 24. doi: 10.1051/medsci/20143012016.Prédiction de la réponse moléculaire à des perturbations mesurée sur des cellules uniques Françoise Remacle1* and Raphael D. Levine2 1Université de Liège, département de chimie, chimie-physique théorique, B6c, allée de la Chimie, 3, B4000Liège, Belgique 2Crump institute for molecular imaging, department of molecular and medical pharmacology, university of California, department of chemistry and biochemistry, David Geffen school of medicine, Los Angeles, CA 90095, États-Unis |
Les voies de signalisation des protéines participent à un grand nombre de processus cellulaires, qui vont de la tumorigenèse à l’inflammation, en passant par la cicatrisation [
1–
3]. La compréhension de leur rôle est souvent obscurcie par la nature hétérogène des tissus. En particulier, il n’est pas toujours aisé de séparer la réponse autocrine de la réponse paracrine [
4]. Un autre domaine où la mesure de la réponse cellulaire s’avère cruciale est celui des cellules de tumeurs cancéreuses solides, dont la réponse à un traitement [
5] peut être affectée par la pression réduite en oxygène à laquelle elles sont soumises [
6–
8]. Récemment, il est devenu possible de mesurer la réponse du protéome de cellules uniques à des perturbations comme l’application d’anticorps [
9] ou des conditions variables de pression en oxygène [
10]. La variation de l’expression du protéome de deux cellules en fonction de la distance entre ces dernières a également été mesurée quantitativement [
11,
12]. Ces mesures sont réalisées à l’aide d’une plateforme microfluidique intégrée, appelée single cell barcode chip (SCBC) [
13–
15], qui permet de mesurer quantitativement la réponse d’une dizaine de protéines fonctionnelles d’un ensemble statistique de cellules uniques piégées dans des microchambres. La détermination du nombre de protéines exprimées par la cellule piégée dans une microchambre se fait à partir de la mesure de fluorescence d’anticorps spécifiques des protéines visées. Ces dernières sont choisies pour que leur niveau d’expression par une cellule unique soit suffisamment élevé pour être mesurable par fluorescence. |
Version quantitative du principe de Le Châtelier La mesure des niveaux d’expression protéique dans des cellules uniques est un progrès important pour la compréhension de la réponse cellulaire à des perturbations, car elle donne accès aux fluctuations de cette réponse de cellule à cellule. Elle permet aussi d’aller au-delà de l’analyse basée sur les valeurs moyennes et de prédire la réponse à des perturbations [9, 10]. Nous avons montré que l’analyse de ces fluctuations par la théorie du maximum d’entropie permet de dériver une version quantitative [9, 10,
16] du principe de Le Châtelier1, [9, 10, 16,
17]. Le point de départ de cette analyse est la reconnaissance que les cellules sont des systèmes de taille finie et que leur réponse à des perturbations fluctue d’une cellule à l’autre. Les mesures expérimentales donnent accès au nombre de molécules de l’espèce i pour chaque cellule, i variant de un à une dizaine suivant le type d’expérience. Nous pouvons ainsi dériver la distribution qui correspond à la composition la plus probable du mélange des différentes espèces mesurées [9]. Nous faisons l’hypothèse que, dans une microchambre, la cellule dans une solution d’éléments nutritifs est en équilibre thermique. Suivant la loi de Boltzmann, cette distribution est la distribution d’entropie maximale, sujette à deux contraintes : la conservation de l’énergie et du nombre moyen de molécules,  , de chacune des espèces, calculé sur la distribution observée dans les différentes microchambres. La probabilité de chaque composition du système de m espèces différentes, ici les protéines (N
1, N
2, …, Nm
), peut alors être déterminée et prend une forme analogue à celle donnée par l’ensemble grand canonique2 donnée dans l’
Encart 1
. , de chacune des espèces, calculé sur la distribution observée dans les différentes microchambres. La probabilité de chaque composition du système de m espèces différentes, ici les protéines (N
1, N
2, …, Nm
), peut alors être déterminée et prend une forme analogue à celle donnée par l’ensemble grand canonique2 donnée dans l’
Encart 1
. |
1
Dans chaque microchambre, la cellule dans la solution d’éléments nutritifs est en équilibre thermique. La distribution d’entropie maximale est sujette à deux contraintes : la conservation de l’énergie et du nombre moyen de molécules,  , de chacune des espèces calculé sur la distribution observée dans les différentes microchambres. La probabilité de chaque composition du système de m espèces différentes, , de chacune des espèces calculé sur la distribution observée dans les différentes microchambres. La probabilité de chaque composition du système de m espèces différentes,  , peut alors être déterminée et prend une forme analogue à celle donnée par l’ensemble grand canonique. , peut alors être déterminée et prend une forme analogue à celle donnée par l’ensemble grand canonique.
β est le paramètre de Lagrange relié à la conservation de l’énergie ; β = 1/kT où k est la constante de Boltzmann et T la température. μ
i est le potentiel chimique de l’espèce i. Les μ
i’s sont les paramètres de Lagrange conjugués au nombre moyen de molécules calculé sur la distribution,  . La somme est sur toutes les compositions possibles, chacune pondérée par son poids donné par l’équation 2. Ξ est la fonction de partition grand canonique. Elle dépend de tous les paramètres de Lagrange et permet d’assurer la normalisation de la distribution. . La somme est sur toutes les compositions possibles, chacune pondérée par son poids donné par l’équation 2. Ξ est la fonction de partition grand canonique. Elle dépend de tous les paramètres de Lagrange et permet d’assurer la normalisation de la distribution. Nous considérons des changements de potentiel isothermiques. Un petit changement de  du potentiel de l’espèce i se traduit par un changement de la concentration en espèce i de du potentiel de l’espèce i se traduit par un changement de la concentration en espèce i de  à à  . Nous avons montré [9, 10, 16] que pour des petites variations isothermiques des potentiels chimiques, . Nous avons montré [9, 10, 16] que pour des petites variations isothermiques des potentiels chimiques,  , la variation de la distribution , la variation de la distribution  (équation 2) est donnée par (équation 2) est donnée par  ce qui indique que le changement dans la distribution sera plus important pour les hautes valeurs de ce qui indique que le changement dans la distribution sera plus important pour les hautes valeurs de  Nous obtenons alors la relation suivante pour la variation correspondante des concentrations : Nous obtenons alors la relation suivante pour la variation correspondante des concentrations :
La relation donnée par l’équation 3 indique que le changement dans la concentration de l’espèce j,  , due à une petite perturbation isothermique des potentiels chimiques, , due à une petite perturbation isothermique des potentiels chimiques,  , des espèces présentes dans le mélange dépend linéairement des petits changements appliqués aux potentiels chimiques et est gouvernée par la matrice de covariance, Σ, qui reflète l’étendue des fluctuations et leur corrélation. Σ est une matrice positive semi-définie dont les éléments, , des espèces présentes dans le mélange dépend linéairement des petits changements appliqués aux potentiels chimiques et est gouvernée par la matrice de covariance, Σ, qui reflète l’étendue des fluctuations et leur corrélation. Σ est une matrice positive semi-définie dont les éléments,  , sont des moyennes sur la distribution , sont des moyennes sur la distribution  donnée par l’équation 1 (voir page suivante). donnée par l’équation 1 (voir page suivante).
|
Les fluctuations de l’expression des protéines et leur corrélation sont reflétées par les éléments de la matrice de covariance, Σ, qui évalue les fluctuations des concentrations autour de leur valeur moyenne,  , à l’équilibre. Le calcul de la matrice de covariance, à partir des données expérimentales non perturbées, permet donc de prédire la réponse des espèces présentes dans le mélange à des petites perturbations de leurs potentiels chimiques. L’équation 3 de l’
Encart 1
est une version quantitative du principe de Le Châtelier [9, 10] et montre que, pour de petites perturbations, un système dans un état d’équilibre stable réagit pour revenir à un nouvel équilibre dans le même état [17]. Ce principe est connu comme l’homéostasie en biologie. L’approche développée ici est reliée au théorème fluctuation-dissipation [
18]. La relation donnée par l’équation 3 (Encart 1) peut être utilisée dans deux contextes différents : (1) pour prédire la réponse du système dans le cas où les perturbations sont faibles autour d’un état stable, de sorte que le système revient à l’équilibre dans le même état [9], ou (2) pour identifier les cas où la perturbation est forte et induit un changement d’état du système, le nouvel état étant différent de l’état initial non perturbé [10]. Dans ce cas, le principe de Le Châtelier n’est pas applicable. , à l’équilibre. Le calcul de la matrice de covariance, à partir des données expérimentales non perturbées, permet donc de prédire la réponse des espèces présentes dans le mélange à des petites perturbations de leurs potentiels chimiques. L’équation 3 de l’
Encart 1
est une version quantitative du principe de Le Châtelier [9, 10] et montre que, pour de petites perturbations, un système dans un état d’équilibre stable réagit pour revenir à un nouvel équilibre dans le même état [17]. Ce principe est connu comme l’homéostasie en biologie. L’approche développée ici est reliée au théorème fluctuation-dissipation [
18]. La relation donnée par l’équation 3 (Encart 1) peut être utilisée dans deux contextes différents : (1) pour prédire la réponse du système dans le cas où les perturbations sont faibles autour d’un état stable, de sorte que le système revient à l’équilibre dans le même état [9], ou (2) pour identifier les cas où la perturbation est forte et induit un changement d’état du système, le nouvel état étant différent de l’état initial non perturbé [10]. Dans ce cas, le principe de Le Châtelier n’est pas applicable. |
Analyse du réseau des voies de signalisation à partir de la matrice de covariance : application à la réponse de cellules macrophagiques Cette approche a été appliquée à l’analyse de la réponse de macrophages humains à un stress lipopolysaccharique (LPS), qui simule la réponse immune vis-à-vis des bactéries Gram négatif [9]. Les 12 protéines mesurées sont : l’interleukine (IL-2), la protéine monocytaire chimio-attractante 1 (MCP1), l’IL-6, le facteur stimulant la formation des colonies de granulocytes-macrophages (GM-CSF), l’inhibiteur de la migration du macrophage (MIF), l’interféron-γ (IFN-γ), le facteur de croissance de l’endothélium vasculaire (VEGF), l’IL-1β, l’IL-10, l’IL-8, la métalloprotéase matricielle 9 (MMP9), et le facteur de nécrose tumorale-α (TNF-α). L’IL-2 n’est pas sécrétée par les macrophages et sert pour la mesure du bruit de fond. Plus de détails sont donnés dans [9]. Les données expérimentales sont rassemblées dans une matrice rectangulaire, X, de dimension nombre de chambres, K, par nombre de protéines mesurées, m. La matrice de covariance, Σ, de l’état non perturbé est calculée à partir de la mesure des m = 12 protéines pour K = 125 cellules. Σ = (1/K)X
T
X, est une matrice m × m, semi-positive définie, dont les éléments sont définis par :
avec 
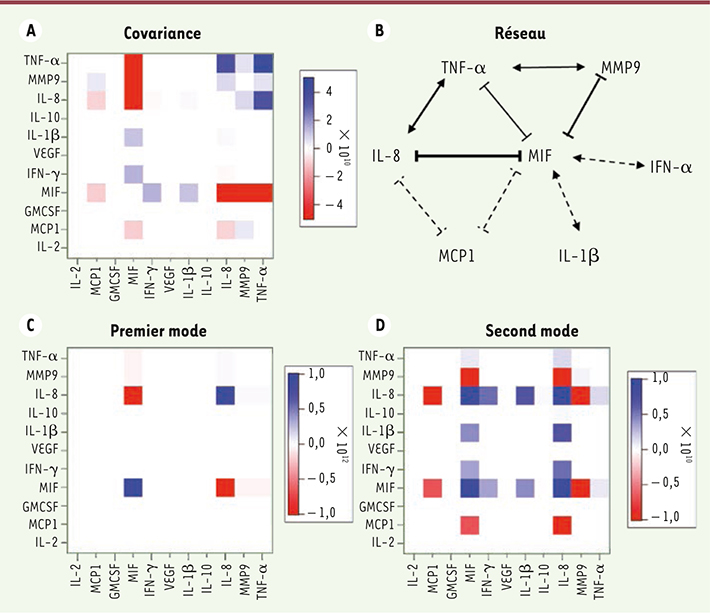
L’analyse de la matrice de covariance permet de caractériser le réseau des voies de signalisation dans lesquelles les protéines mesurées sont impliquées. Elle peut se faire à deux niveaux. Un niveau global, qui permet de déterminer directement les interactions les plus importantes entre les protéines à partir des valeurs relatives des éléments de la matrice Σ. Ses éléments diagonaux sont positifs et ses éléments non diagonaux peuvent être négatifs ou positifs. Leur signe donne donc la nature de la corrélation entre deux protéines, inhibition ou stimulation, mais pas le sens de l’interaction car la matrice Σ est symétrique, Σij = Σji. La matrice Σ est représentée sous forme de heatmap sur la
Figure 1A
, et le réseau qui lui correspond sur la
Figure 1B
. La protéine MIF est celle qui a les interactions les plus fortes avec les autres protéines, et ces dernières sont inhibitrices (IL-8, MMP9, MCP1 et TNF-α). Les interactions plus faibles sont stimulantes (IL-1β et IFN-γ). L’interaction de MIF avec l’IL-8 est forte ; elle est représentée dans le réseau de la
Figure 1B
par un trait épais. La valeur de l’élément de matrice ΣMIF-IL-8 est de 4 × 1011 et le bruit expérimental est estimé à 14 % [9], ce qui implique que les interactions pertinentes dans l’établissement du réseau de la
Figure 1B
doivent être au moins de l’ordre de 5 × 1010.
 | Figure 1.
Analyse de la matrice de covariance S et dérivation du réseau d’interactions entre les protéines mesurées pour des cellules uniques. A. Heatmap de la matrice Σ : les éléments diagonaux ne sont pas montrés ; l’échelle (– 5 × 1010 à + 5 × 1010) est ajustée pour faire ressortir les interactions les plus importantes et tenir compte du bruit (environ 14 %). B. Réseau des voies de signalisation établi à partir de l’analyse de la matrice de covariance. Les connexions terminées par un trait indiquent une inhibition, celles terminées par des flèches une stimulation. L’épaisseur du trait reflète la force des interactions. C. Analyse du mode principal de la matrice Σ. Seule l’action inhibitrice entre MIF et IL-8 apparaît. D. Second mode : les interactions secondaires reportées dans le réseau apparaissent clairement. |
MIF est sécrétée quand les cellules macrophagiques sont stimulées par le LPS (lipopolysaccharide), alors que l’IL-8 est sécrétée sans stimulation [
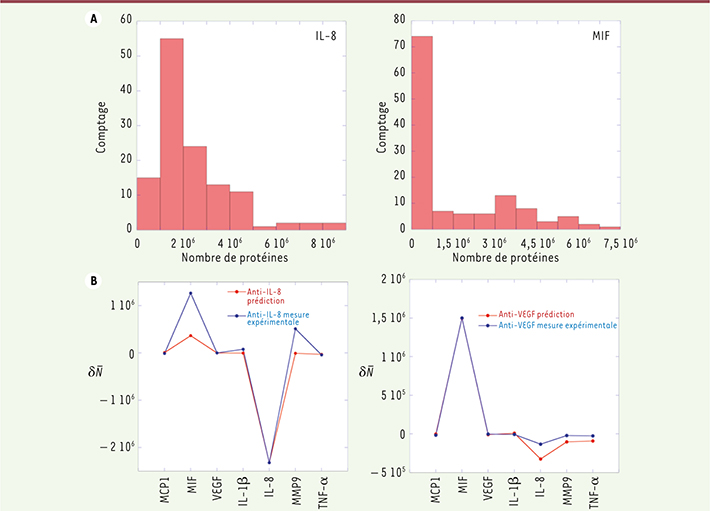
19]. Notre analyse indique que MIF est inhibée par l’IL-8 et, qu’en retour, elle inhibe trois autres protéines : MMP9, MPC1 et TNF-α. MIF stimule aussi la sécrétion de l’IL-1β et de l’IFN-γ. Ces interactions sont reflétées dans les fluctuations temporelles de la sécrétion des protéines. MIF, TNF-α et IL-1β sont sécrétées en réponse à la stimulation par le LPS et fluctuent temporellement [9]. Les fluctuations de MIF sont inversement corrélées à celles du TNF-α. Comme discuté plus haut, on constate aussi que les histogrammes des nombres de protéines qui interagissent présentent un épaulement pour les hautes valeurs de protéines exprimées (Figure 2A).
 | Figure 2.
Réponse protéique à des perturbations sur cellule unique. A. Histogramme des fluctuations du nombre de protéines sécrétées (IL-8 et MIF) entre cellules uniques. L’épaulement aux hautes valeurs est indicatif de l’interaction forte entre ces deux protéines. B. Réponse,  , du nombre de protéines sécrétées à la perturbation par un anticorps neutralisant une protéine spécifique (IL-8 ou VEGF). |
L’analyse fine du réseau d’interactions des protéines est obtenue en définissant sa représentation spectrale, ce qui permet d’identifier ses modes indépendants. Pratiquement, ces derniers sont obtenus par diagonalisation de la matrice de covariance, Σ, et en ordonnant ses valeurs propres par ordre décroissant, ce qui est analogue à analyser ses composantes principales. Σ est une matrice positive semi-définie et les modes correspondant aux valeurs propres les plus basses peuvent être corrompus par les incertitudes expérimentales [
20,
21]. Les deux modes indépendants les plus importants sont représentés sous forme de heatmap dans la
Figure 1C–D
. Le mode le plus important correspond bien à la corrélation inverse de MIF et de l’IL8. Le mode suivant (seulement trois fois moins important que le premier) correspond aux interactions plus faibles, mais supérieures au bruit expérimental. Les modes suivants sont corrompus par le bruit. |
Réponse à des perturbations et retour à l’équilibre dans le même état stable L’analyse du réseau des voies de signalisation des protéines dans leur état stable permet de prédire la réponse à des petites perturbations en utilisant l’équation 3 (voir
Encart 1
). Dans le cas des macrophages, les perturbations sont des anticorps qui neutralisent spécifiquement une protéine. Un seul potentiel chimique, μi
, est perturbé dans l’équation 3, mais toutes les protéines répondent à cette perturbation. Les anticorps choisis sont l’anti-VEGF, l’anti-IL-8 et l’anti-TNF-α. Les résultats des mesures expérimentales de la réponse sont comparés à ceux obtenus à partir de l’équation 3 dans la
Figure 2B
. La neutralisation de l’IL-8 entraîne un accroissement important du nombre de protéines MIF sécrétées, puisque ces deux protéines sont corrélées de façon inverse. Elle accroît légèrement le nombre de VEGF puisque ces deux protéines sont en interaction stimulante faible. La neutralisation de VEGF n’a, en revanche, pratiquement pas d’effet sur le nombre de protéines secrétées. La faible interaction avec l’IL-8 est de l’ordre de grandeur du bruit expérimental. |
Réponse à une perturbation forte : transition entre l’état de normoxie et l’état d’hypoxie Nous avons étudié, au moyen de l’approche détaillée ci-dessus, la réponse des voies de signalisation de la protéine mTOR (mammalian target of rapamycin) à des pressions variables en oxygène. mTOR est une cible thérapeutique prometteuse, car elle joue un rôle important dans la régulation de la réponse cellulaire à des signaux moléculaires environnementaux [6]. Elle est activée de manière très significative dans plusieurs tumeurs solides [
22]. Cependant, les résultats des thérapies inhibant mTOR dans les tests cliniques ne sont pas concluants [5]. Il est par ailleurs établi que la signalisation moléculaire de mTOR est affectée et altérée par une pression réduite en oxygène [
23]. |
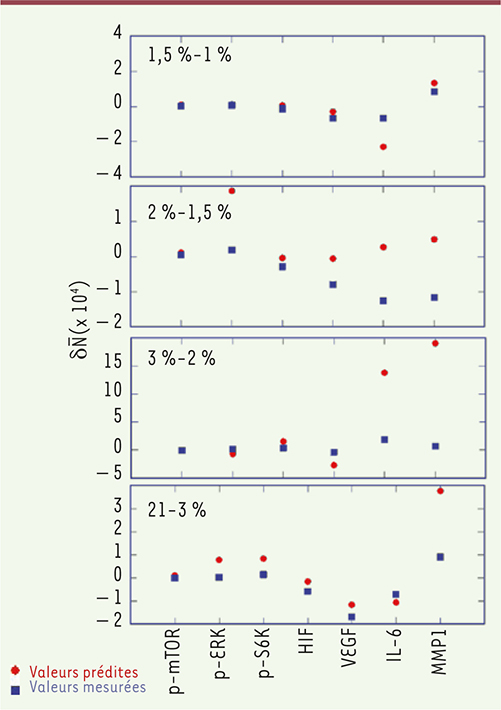
Analyse des protéines impliquées dans les voies de signalisation de mTOR en normoxie et hypoxie Les expériences consistent en des mesures des fluctuations de l’expression de protéines impliquées dans les voies de signalisation de mTOR et de HIF-1α (hypoxia-inducible factor-1α) d’une lignée de cellules cancéreuses d’un glioblastome multiforme (cellules GBM de la lignée U87 EGFRvIII qui expriment de manière stable le récepteur du facteur de croissance épidermique EGFRvIII) par la technique SCBC (single-cell barcode chip) [11, 13, 15]. Cette technique permet de mesurer le nombre de protéines exprimées par des cellules uniques soumises à des pressions décroissantes en oxygène (PO2 = 21, 3, 2, 1,5 et 1 %), qui vont de l’état de normoxie (21 %) à celui d’hypoxie (1 %) [10]. Le nombre de cellules analysées lors de la variation en PO2 est d’une centaine, ce qui est statistiquement significatif pour analyser les fluctuations et les corrélations. Les protéines choisies sont trois protéines sécrétées (VEGF, IL-6 et la MMP1) et quatre protéines cytoplasmiques (HIF-1α et trois phosphoprotéines, phospho[p]-mTOR, la p-extracellular signal-regulated kinase 1 [p-ERK1], et la sérine-thréonine kinase p-P70S6K). L’analyse des histogrammes d’expression des protéines révèle que la variation de la pression en O2 entre 2 % à 1,5 % n’est pas une perturbation faible. Les histogrammes des nombres de la protéine mTOR (Figure 3) présentent un épaulement aux valeurs hautes (21 à 3 %) et basse (1 %) de la pression en O2, mais la distribution est étroite à la pression intermédiaire de 1,5 %. Ce comportement est aussi observé pour les deux autres phosphoprotéines, p-ERK1 et p-P70S6K. En revanche, les histogrammes des valeurs de la protéine HIF-1α (Figure 3) sont étroits de 21 % à 1,5 % de PO2, mais à 1 %, la distribution devient très large. Quant aux histogrammes des valeurs de la protéine IL-6, qui n’est pas impliquée dans les voies de signalisation de mTORC1 et d’HIF-1α, ils ne présentent pas de variation marquée en fonction de la pression en O2. Le système passe de l’état de normoxie à l’état d’hypoxie dans la plage de PO2 2-1,5 %, un histogramme étroit indiquant que la protéine interagit peu avec les autres. Le découplage de mTOR dans cette plage de pression nous amène à prédire que mTOR ne peut pas être inhibée dans cette zone de pression. Nous avons vérifié cette hypothèse en analysant la réponse à un inhibiteur de mTOR en fonction de la pression en O2 dans deux types de cellules tumorales : des cellules issues de la lignées EGFRvIII et des cellules de neurosphères dérivées d’une tumeur d’origine humaine greffée chez l’animal [10].
 | Figure 3.
Réponse protéique à des variations de concentration en O2 sur cellule unique. A. Les trois plus basses valeurs propres de la matrice de covariance sont représentées en fonction de la PO2 ; elles correspondent aux modes impliqués dans la transition de phase. La plus basse valeur propre passe par une valeur proche de zéro, entre 2 % et 1,5 %. B. Histogrammes des nombres de protéines mesurées à 21 %, 1,5 % et 1 % de PO2 sur des cellules uniques pour mTOR. C. Participation des différentes protéines aux modes correspondant aux trois plus basses valeurs propres. Un changement de participation indique un changement dans les voies de signalisation. |
Notre analyse [10] permet de montrer que la protéine mTOR est impliquée dans des voies de signalisation différentes selon l’état de normoxie et d’hypoxie. En utilisant le principe de Le Châtelier, nous pouvons montrer que le réseau des voies de signalisation de mTOR subit l’équivalent d’une transition de phase dans la plage de pression en O2 de 2 % à 1,5 %, et modifie la stabilité de son état de part et d’autre de cette zone. |
Basculement du réseau des voies de signalisation mTOR de normoxie à l’état d’hypoxie Varier la pression en O2 conduit à changer des potentiels chimiques des protéines impliquées dans les voies de signalisation de mTOR et d’HIF-1α. La relation donnée par l’équation 3 qui relie la variation du nombre moyen de protéines,  , à de petites perturbations qui induisent la variation des potentiels chimiques, δμ
i
, ne permet pas de décrire un changement d’état. Elle peut être utilisée pour prédire la réponse des protéines à une variation de la pression en O2 entre 21 % à 3 %, qui correspond à une faible perturbation de l’état de normoxie, et de 1,5 % à 1 % pour l’état d’hypoxie, mais cependant pas dans la plage de 2 % à 1,5 % qui correspond à la transition de phase. Le fait de ne pas pouvoir prédire la réponse moléculaire dans la plage de pression en O2 de 2 % à 1,5 % est donc indicatif d’un changement d’état. Cette transition de phase est directement reflétée dans la représentation spectrale de la matrice de covariance, Σ, qui permet de caractériser les modes indépendants, et donc les voies de signalisation, en fonction de la pression en O2. Cette analyse montre que les voies de signalisation de mTOR subissent une transition de l’état de normoxie à l’état d’hypoxie. Dans la plage de pressions 2-1,5 %, qui correspond à la transition, mTOR est découplée, ce qui se traduit par le fait qu’une des valeurs propres de la matrice de covariance prend une valeur proche de zéro. Cette valeur n’est pas strictement zéro car une cellule est un système de taille finie. Cette transition de phase suit la règle de Gibbs, selon laquelle un degré de liberté est perdu quand deux phases coexistent. , à de petites perturbations qui induisent la variation des potentiels chimiques, δμ
i
, ne permet pas de décrire un changement d’état. Elle peut être utilisée pour prédire la réponse des protéines à une variation de la pression en O2 entre 21 % à 3 %, qui correspond à une faible perturbation de l’état de normoxie, et de 1,5 % à 1 % pour l’état d’hypoxie, mais cependant pas dans la plage de 2 % à 1,5 % qui correspond à la transition de phase. Le fait de ne pas pouvoir prédire la réponse moléculaire dans la plage de pression en O2 de 2 % à 1,5 % est donc indicatif d’un changement d’état. Cette transition de phase est directement reflétée dans la représentation spectrale de la matrice de covariance, Σ, qui permet de caractériser les modes indépendants, et donc les voies de signalisation, en fonction de la pression en O2. Cette analyse montre que les voies de signalisation de mTOR subissent une transition de l’état de normoxie à l’état d’hypoxie. Dans la plage de pressions 2-1,5 %, qui correspond à la transition, mTOR est découplée, ce qui se traduit par le fait qu’une des valeurs propres de la matrice de covariance prend une valeur proche de zéro. Cette valeur n’est pas strictement zéro car une cellule est un système de taille finie. Cette transition de phase suit la règle de Gibbs, selon laquelle un degré de liberté est perdu quand deux phases coexistent. Les vecteurs propres et des valeurs propres de la matrice de covariance, Σ, sont repris dans la
Figure 3
. L’analyse de la participation des protéines aux modes qui correspondent aux trois valeurs propres les plus basses de la matrice Σ indique que, pour des pressions supérieures à 2 %, ces trois modes capturent 75-95 % des interactions entre les protéines HIF-1α, p-mTOR et p-P70S6K. En revanche, pour des pressions de 1 %, il y a eu un basculement du réseau des voies de signalisation et ce sont les interactions entre p-mTOR, p-ERK et p-P70S6k qui dominent les trois modes (80 %-100 %). Pour une pression de 1,5 %, on constate que l’histogramme de p-mTOR est plus étroit, et cette réduction des fluctuations indique que p-mTOR est découplée des autres protéines, ce qui correspond à la perte d’un degré de liberté dans les modes de Σ et une valeur propre proche de zéro. Cette perte d’un degré de liberté est en accord avec l’expression quantitative du principe de Le Châtelier donnée par l’équation 3 :  = βΣδμ. La dimension de la matrice Σ, qui est égale à sept (puisque sept protéines sont mesurées), donne le nombre de modes de réponse à une perturbation linéairement indépendants. La perte d’une valeur propre de Σ correspond à la perte d’un mode de réponse indépendant, ce qui veut dire qu’il y a moins de possibilités de variations indépendantes des = βΣδμ. La dimension de la matrice Σ, qui est égale à sept (puisque sept protéines sont mesurées), donne le nombre de modes de réponse à une perturbation linéairement indépendants. La perte d’une valeur propre de Σ correspond à la perte d’un mode de réponse indépendant, ce qui veut dire qu’il y a moins de possibilités de variations indépendantes des  . Ceci implique que la voie de signalisation de mTORC1 ne peut pas être inhibée à la transition, mais bien avant et après la transition. À la transition, des changements importants dans le potentiel chimique de p-mTOR et des deux autres phosphoprotéines p-ERK et p-P70S6k ne conduisent pas à un changement important du nombre moyen de ces dernières. Ceci explique le fait qu’on ne puisse pas utiliser le principe de Le Châtelier pour prédire la réponse des . Ceci implique que la voie de signalisation de mTORC1 ne peut pas être inhibée à la transition, mais bien avant et après la transition. À la transition, des changements importants dans le potentiel chimique de p-mTOR et des deux autres phosphoprotéines p-ERK et p-P70S6k ne conduisent pas à un changement important du nombre moyen de ces dernières. Ceci explique le fait qu’on ne puisse pas utiliser le principe de Le Châtelier pour prédire la réponse des  dans cette plage de pression, mais bien avant et après (Figure 4). dans cette plage de pression, mais bien avant et après (Figure 4).
 | Figure 4.
Comparaison entre les variations du nombre de protéines mesurées entre deux pressions d’O2 et la prédiction à partir de l’équation 3. Les prédictions basées sur la version quantitative du principe de Le Châtelier sont en accord avec les mesures expérimentales pour les domaines 21-3 % et 3-2 %, qui correspondent à une perturbation de l’état stable de normoxie, et 1,5-1 %, qui correspond à une perturbation de l’état d’hypoxie. Pour le domaine 2-1,5 %, qui correspond à la transition, la prédiction est moins bonne. |
|
La mesure des fluctuations de la réponse de cellules uniques à des perturbations par la technique SBCB permet d’analyser les voies de signalisation dans lesquelles les protéines mesurées sont impliquées, et de prédire la réponse cellulaire à des petites perturbations. Dans le cas de perturbations fortes qui impliquent un changement d’état, comme dans le cas de la transition normoxie-hypoxie, il est possible d’analyser le changement des voies de signalisation qui accompagne cette transition et de mieux comprendre la réponse à des thérapies. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
F. Remacle est directeur de recherches du Fonds national de la recherche scientifique, FNRS-FRS, Belgique. Ces recherches ont reçu le support du projet européen FP7 FET open BAMBI (618024).
|
Footnotes |
1.
Gnecchi
M
,
He
H
,
Liang
OD
, et al.
Paracrine action accounts for marked protection of ischemic heart by Akt-modified mesenchymal stem cells . Nat Med.
2005; ; 11 : :367.–368. 2.
Polyak
K
,
Weinberg
RA
. Transitions between epithelial and mesenchymal states: acquisition of malignant and stem cell traits . Nat Rev Cancer.
2009; ; 9 : :265.–273. 3.
Seruga
B
,
Zhang
H
,
Bernstein
LJ
,
Tannock
IF
. Cytokines and their relationship to the symptoms and outcome of cancer . Nat Rev Cancer.
2008; ; 8 : :887.–899. 4.
Ariztia
EV
,
Lee
CJ
,
Gogoi
R
,
Fishman
DA
. The tumor microenvironment: key to early detection . Crit Rev Clin Lab Sci.
2006; ; 43 : :393.–425. 5.
Semenza
GL
. Oxygen sensing, homeostasis, and disease . N Engl J Med.
2011; ; 365 : :537.–547. 6.
Bertout
JA
,
Patel
SA
,
Simon
MC
. The impact of O2 availability on human cancer . Nat Rev Cancer.
2008; ; 8 : :967.–975. 7.
Goel
S
,
Duda
DG
,
Xu
L
, et al.
Normalization of the vasculature for treatment of cancer and other diseases . Physiol Rev.
2011; ; 91 : :1071.–1121. 8.
Provenzano Paolo
P
,
Cuevas
C
,
Chang Amy
E
, et al.
Enzymatic targeting of the stroma ablates physical barriers to treatment of pancreatic ductal adenocarcinoma . Cancer Cell.
2012; ; 21 : :418.–429. 9.
Shin
YS
,
Remacle
F
,
Fan
R
, et al.
Protein signaling networks from single cell fluctuations and information theory profiling . Biophys J.
2011; ; 100 : :2378.–2386. 10.
Wei
W
,
Shi
Q
,
Remacle
F
, et al.
Hypoxia induces a phase transition within a kinase signaling network in cancer cells . Proc Natl Acad Sci USA.
2013; ; 110 : :E1352.–E1E60. 11.
Wang
J
,
Tham
D
,
Wei
W
, et al.
Quantitating cell-cell interaction functions with applications to glioblastoma multiforme cancer cells . Nano Letters.
2012; ; 12 : :6101.–6106. 12.
Kravchenko-Balasha
N
,
Wang
J
,
Remacle
F
, et al.
Glioblastoma cellular architectures are predicted through the characterization of two-cell interactions . Proc Natl Acad Sci USA.
2014; ; 111 : :6521.–6526. 13.
Shin
YS
,
Ahmad
H
,
Shi
Q
, et al.
Chemistries for patterning robust DNA microbarcodes enable multiplex assays of cytoplasm proteins from single cancer cells . ChemPhysChem.
2010; ; 11 : :3063.–3069. 14.
Shi
Q
,
Qin
L
,
Wei
W
, et al.
Single-cell proteomic chip for profiling intracellular signaling pathways in single tumor cells . Proc Natl Acad Sci USA.
2012; ; 109 : :419.–424. 15.
Wei
W
,
Shin
YS
,
Ma
C
, et al.
Microchip platforms for multiplex single-cell functional proteomics with applications to immunology and cancer research . Genome Medicine.
2013; ; 5 : :75.. 16.
Remacle
F
,
Graeber
TG
,
Levine
RD
. Whose entropy: a maximal entropy analysis of phosphorylation signaling . J Stat Phys.
2011; ; 144 : :429.–442. 17.
Callen
HB.
Thermodynamics and an introduction to thermostatics. ; NY: : Wiley; , 1985
18.
Sevick
EM
,
Prabhakar
R
,
Williams
SR
,
Searles
DJ
. Fluctuation theorems . Annu Rev Phys Chem.
2008; ; 59 : :603.–633. 19.
Roger
T
,
David
J
,
Glauser
MP
,
Calandra
T
. MIF regulates innate immune responses through modulation of Toll-like receptor 4 . Nature.
2001; ; 414 : :920.–924. 20.
Agmon
N
,
Alhassid
Y
,
Levine
RD
. Algorithm for finding the distribution of maximal entropy . J Comput Phys.
1979; ; 30 : :250.–258. 21.
Alhassid
Y
,
Levine
RD
. Experimental and inherent uncertainties in the information theoretic approach . Chemical Physics Letters.
1980; ; 73 : :16.–20. 22.
Menon
S
,
Yecies
JL
,
Zhang
HH
, et al.
Chronic activation of mTOR complex 1 is sufficient to cause hepatocellular carcinoma in mice . Science Signaling.
2012; ; 51 : :ra24.. 23.
Wouters
BG
,
Koritzinsky
M
. Hypoxia signalling through mTOR and the unfolded protein response in cancer . Nat Rev Cancer.
2008; ; 8 : :851.–864. |



 , de chacune des espèces, calculé sur la distribution observée dans les différentes microchambres. La probabilité de chaque composition du système de m espèces différentes, ici les protéines (N
1, N
2, …, Nm
), peut alors être déterminée et prend une forme analogue à celle donnée par l’ensemble grand canonique
, de chacune des espèces, calculé sur la distribution observée dans les différentes microchambres. La probabilité de chaque composition du système de m espèces différentes, ici les protéines (N
1, N
2, …, Nm
), peut alors être déterminée et prend une forme analogue à celle donnée par l’ensemble grand canonique , de chacune des espèces calculé sur la distribution observée dans les différentes microchambres. La probabilité de chaque composition du système de m espèces différentes,
, de chacune des espèces calculé sur la distribution observée dans les différentes microchambres. La probabilité de chaque composition du système de m espèces différentes,  , peut alors être déterminée et prend une forme analogue à celle donnée par l’ensemble grand canonique.
, peut alors être déterminée et prend une forme analogue à celle donnée par l’ensemble grand canonique.
 . La somme est sur toutes les compositions possibles, chacune pondérée par son poids donné par l’équation 2. Ξ est la fonction de partition grand canonique. Elle dépend de tous les paramètres de Lagrange et permet d’assurer la normalisation de la distribution.
. La somme est sur toutes les compositions possibles, chacune pondérée par son poids donné par l’équation 2. Ξ est la fonction de partition grand canonique. Elle dépend de tous les paramètres de Lagrange et permet d’assurer la normalisation de la distribution. du potentiel de l’espèce i se traduit par un changement de la concentration en espèce i de
du potentiel de l’espèce i se traduit par un changement de la concentration en espèce i de  à
à  . Nous avons montré [
. Nous avons montré [ , la variation de la distribution
, la variation de la distribution  (équation 2) est donnée par
(équation 2) est donnée par  ce qui indique que le changement dans la distribution sera plus important pour les hautes valeurs de
ce qui indique que le changement dans la distribution sera plus important pour les hautes valeurs de  Nous obtenons alors la relation suivante pour la variation correspondante des concentrations :
Nous obtenons alors la relation suivante pour la variation correspondante des concentrations :
 , due à une petite perturbation isothermique des potentiels chimiques,
, due à une petite perturbation isothermique des potentiels chimiques,  , des espèces présentes dans le mélange dépend linéairement des petits changements appliqués aux potentiels chimiques et est gouvernée par la matrice de covariance, Σ, qui reflète l’étendue des fluctuations et leur corrélation. Σ est une matrice positive semi-définie dont les éléments,
, des espèces présentes dans le mélange dépend linéairement des petits changements appliqués aux potentiels chimiques et est gouvernée par la matrice de covariance, Σ, qui reflète l’étendue des fluctuations et leur corrélation. Σ est une matrice positive semi-définie dont les éléments,  , sont des moyennes sur la distribution
, sont des moyennes sur la distribution  donnée par l’équation 1 (voir page suivante).
donnée par l’équation 1 (voir page suivante).
 , à l’équilibre. Le calcul de la matrice de covariance, à partir des données expérimentales non perturbées, permet donc de prédire la réponse des espèces présentes dans le mélange à des petites perturbations de leurs potentiels chimiques. L’équation 3 de l’
, à l’équilibre. Le calcul de la matrice de covariance, à partir des données expérimentales non perturbées, permet donc de prédire la réponse des espèces présentes dans le mélange à des petites perturbations de leurs potentiels chimiques. L’équation 3 de l’


 , du nombre de protéines sécrétées à la perturbation par un anticorps neutralisant une protéine spécifique (IL-8 ou VEGF).
, du nombre de protéines sécrétées à la perturbation par un anticorps neutralisant une protéine spécifique (IL-8 ou VEGF).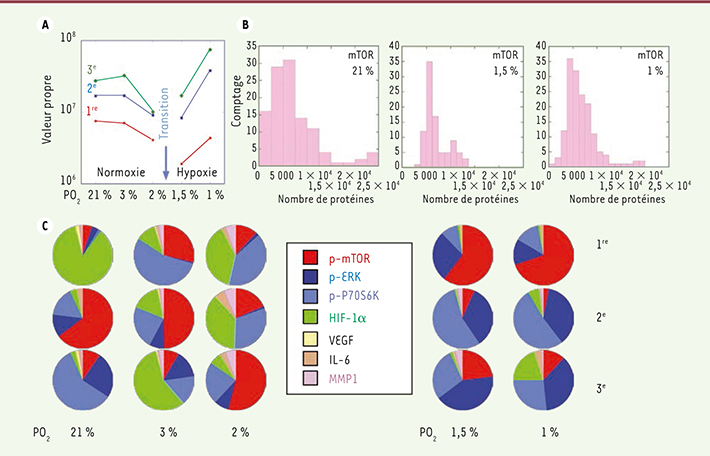
 , à de petites perturbations qui induisent la variation des potentiels chimiques, δμ
i
, ne permet pas de décrire un changement d’état. Elle peut être utilisée pour prédire la réponse des protéines à une variation de la pression en O2 entre 21 % à 3 %, qui correspond à une faible perturbation de l’état de normoxie, et de 1,5 % à 1 % pour l’état d’hypoxie, mais cependant pas dans la plage de 2 % à 1,5 % qui correspond à la transition de phase. Le fait de ne pas pouvoir prédire la réponse moléculaire dans la plage de pression en O2 de 2 % à 1,5 % est donc indicatif d’un changement d’état. Cette transition de phase est directement reflétée dans la représentation spectrale de la matrice de covariance, Σ, qui permet de caractériser les modes indépendants, et donc les voies de signalisation, en fonction de la pression en O2. Cette analyse montre que les voies de signalisation de mTOR subissent une transition de l’état de normoxie à l’état d’hypoxie. Dans la plage de pressions 2-1,5 %, qui correspond à la transition, mTOR est découplée, ce qui se traduit par le fait qu’une des valeurs propres de la matrice de covariance prend une valeur proche de zéro. Cette valeur n’est pas strictement zéro car une cellule est un système de taille finie. Cette transition de phase suit la règle de Gibbs, selon laquelle un degré de liberté est perdu quand deux phases coexistent.
, à de petites perturbations qui induisent la variation des potentiels chimiques, δμ
i
, ne permet pas de décrire un changement d’état. Elle peut être utilisée pour prédire la réponse des protéines à une variation de la pression en O2 entre 21 % à 3 %, qui correspond à une faible perturbation de l’état de normoxie, et de 1,5 % à 1 % pour l’état d’hypoxie, mais cependant pas dans la plage de 2 % à 1,5 % qui correspond à la transition de phase. Le fait de ne pas pouvoir prédire la réponse moléculaire dans la plage de pression en O2 de 2 % à 1,5 % est donc indicatif d’un changement d’état. Cette transition de phase est directement reflétée dans la représentation spectrale de la matrice de covariance, Σ, qui permet de caractériser les modes indépendants, et donc les voies de signalisation, en fonction de la pression en O2. Cette analyse montre que les voies de signalisation de mTOR subissent une transition de l’état de normoxie à l’état d’hypoxie. Dans la plage de pressions 2-1,5 %, qui correspond à la transition, mTOR est découplée, ce qui se traduit par le fait qu’une des valeurs propres de la matrice de covariance prend une valeur proche de zéro. Cette valeur n’est pas strictement zéro car une cellule est un système de taille finie. Cette transition de phase suit la règle de Gibbs, selon laquelle un degré de liberté est perdu quand deux phases coexistent. = βΣδμ. La dimension de la matrice Σ, qui est égale à sept (puisque sept protéines sont mesurées), donne le nombre de modes de réponse à une perturbation linéairement indépendants. La perte d’une valeur propre de Σ correspond à la perte d’un mode de réponse indépendant, ce qui veut dire qu’il y a moins de possibilités de variations indépendantes des
= βΣδμ. La dimension de la matrice Σ, qui est égale à sept (puisque sept protéines sont mesurées), donne le nombre de modes de réponse à une perturbation linéairement indépendants. La perte d’une valeur propre de Σ correspond à la perte d’un mode de réponse indépendant, ce qui veut dire qu’il y a moins de possibilités de variations indépendantes des  . Ceci implique que la voie de signalisation de mTORC1 ne peut pas être inhibée à la transition, mais bien avant et après la transition. À la transition, des changements importants dans le potentiel chimique de p-mTOR et des deux autres phosphoprotéines p-ERK et p-P70S6k ne conduisent pas à un changement important du nombre moyen de ces dernières. Ceci explique le fait qu’on ne puisse pas utiliser le principe de Le Châtelier pour prédire la réponse des
. Ceci implique que la voie de signalisation de mTORC1 ne peut pas être inhibée à la transition, mais bien avant et après la transition. À la transition, des changements importants dans le potentiel chimique de p-mTOR et des deux autres phosphoprotéines p-ERK et p-P70S6k ne conduisent pas à un changement important du nombre moyen de ces dernières. Ceci explique le fait qu’on ne puisse pas utiliser le principe de Le Châtelier pour prédire la réponse des  dans cette plage de pression, mais bien avant et après (
dans cette plage de pression, mais bien avant et après (