| |
| Med Sci (Paris). 2014 December; 30(12): 1091–1100. Published online 2014 December 24. doi: 10.1051/medsci/20143012012.Médecine régénératrice du disque intervertébral De la physiopathologie à l’application clinique Nina Henry,1,3,4 Pauline Colombier,1,3 Laurent Lescaudron,1,3,4 Olivier Hamel,1,3,5,6 Jean Le Bideau,2 Jérôme Guicheux,1,3,7* and Johann Clouet1,3,8,9 1Inserm UMRS791-LIOAD (laboratoire d’ingénierie ostéo-articulaire et dentaire), groupe STEP (skeletal tissue engineering and physiopathology), 1, place Alexis Ricordeau, 44042Nantes, France 2Institut des matériaux Jean Rouxel (IMN), UMR6502 université de Nantes-CNRS, 44322Nantes, France 3Université de Nantes, UFR odontologie, 44042Nantes, France 4Université de Nantes, UFR sciences et techniques, 44042Nantes, France 5CHU Nantes, PHU4 OTONN, service de neurotraumatologie, 44042Nantes, France 6Université de Nantes, UFR Médecine, 44042Nantes, France 7CHU Nantes, PHU 4 OTONN, 44042Nantes, France 8CHU Nantes, PHU 7 biologie-pharmacie, pharmacie centrale, 44042Nantes, France 9Université de Nantes, UFR sciences biologiques et pharmaceutiques, 44042Nantes, France |
Environ 80 % de la population générale souffriront, au moins une fois au cours de la vie, de douleurs lombaires, qui sont reconnues comme le mal du xxi
e siècle par l’Organisation mondiale de la santé (OMS). Ainsi, la lombalgie représente la seconde cause de consultation médicale dans les pays industrialisés, derrière les troubles cardiaques, et son impact médico-économique est considérable. Aux États-Unis, le coût annuel de cette pathologie a été estimé entre 100 et 200 milliards de dollars [
1]. Ces lombalgies s’expliquent, dans 40 % des cas, par une dégénérescence du disque intervertébral (DIV). Les mécanismes de cette dégénérescence sont aujourd’hui mieux documentés et offrent de nouvelles opportunités de traitements. Il est aujourd’hui admis que le nucleus pulposus (NP), partie centrale du DIV, est la première structure affectée. La disparition des cellules du NP est considérée comme un élément pivot du processus de dégénérescence, qui entraîne une atteinte qualitative et quantitative des constituants de la matrice extracellulaire (MEC). Celle-ci devient fibreuse et déshydratée, entraînant une perte des fonctions biomécaniques du DIV. Actuellement, la prise en charge des patients lombalgiques se fonde sur des traitements médicamenteux et chirurgicaux (arthrodèse et arthroplastie) qui présentent néanmoins certaines limites. Il s’agit notamment du caractère invasif des approches chirurgicales, des risques de dégénérescence des étages adjacents liés à la technique d’arthrodèse, et de descellement de la prothèse liés à la technique d’arthroplastie. Dans ce contexte, la médecine régénératrice basée sur l’apport au NP dégénéré de cellules fonctionnelles (thérapie cellulaire) pourrait constituer une option thérapeutique prometteuse. Plusieurs sources de cellules sont actuellement proposées présentant chacune des avantages et des inconvénients. Afin de favoriser la survie et l’intégration tissulaire de ces cellules et restaurer les propriétés mécaniques du DIV, l’utilisation d’un biomatériau est également parfois envisagée (ingénierie tissulaire). Actuellement, des études précliniques et cliniques ont d’ores et déjà débuté et leurs résultats sont encourageants. |
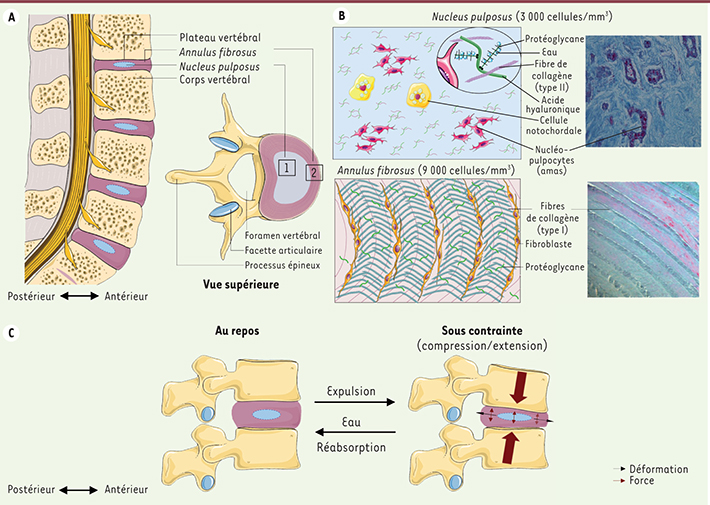
Disque intervertébral sain, disque intervertébral dégénéré Le disque intervertébral sain Historiquement considérés comme des ligaments intervertébraux servant d’amortisseurs fibro-hydrauliques unissant les vertèbres, les DIV constituent en fait les articulations semi-mobiles (amphiarthroses) de la colonne vertébrale. Vingt-trois DIV permettent le maintien de la stabilité et de la dynamique rachidienne. Chaque DIV sain est composé de trois éléments : l’anneau fibreux ( annulus fibrosus, AF) entourant le noyau pulpeux ( nucleus pulposus, NP) et les plateaux cartilagineux, qui permettent la jonction entre le DIV et les vertèbres sus- et sous-jacentes. Ces structures présentent chacune une organisation spécifique illustrée sur la
Figure 1
[
2]. Dans les années 1990, la coexistence de deux types cellulaires au sein du NP a été démontrée : les cellules du NP, dont le phénotype est proche de celui des chondrocytes articulaires, et les cellules notochordales (CNT). Depuis 2007, plusieurs publications ont démontré l’existence d’un phénotype singulier de ces cellules du NP, nous amenant à les dénommer nucléopulpocytes (NPCytes). Ces nucléopulpocytes expriment spécifiquement différents marqueurs (OVOS2 [ ovostatin 2], PAX1 [ paired box protein 1], CD24, CA12 [ carbonic anhydrase XII]) et partagent l’expression des marqueurs ACAN (agrécane) et COL2A1 (collagène de type II) avec les chondrocytes articulaires. Cependant, le rapport ACAN/COL2A1 est de 2:1 pour le cartilage articulaire et de 27:1 pour le NP, ce qui démontre l’activité de synthèse spécifique des nucléopulpocytes [
3–
8].
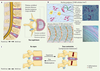 | Figure 1.
Le disque intervertébral sain. A. Organisation du rachis lombaire et aspect général d’un DIV lombaire : nucleus pulposus (1) et annulus fibrosus (2). B. Organisation matricielle du DIV. C. Biomécanique du DIV au repos et sous contrainte. |
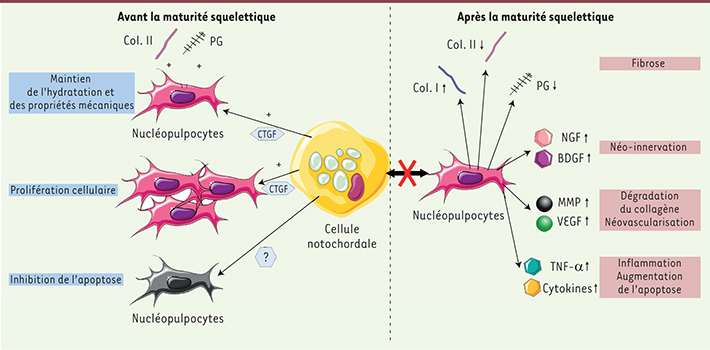
Les cellules notochordales sont des vestiges de la notochorde embryonnaire. Au cours de la troisième semaine de développement embryonnaire humain, une structure spécifique appelée « le nœud » se met en place. Les cellules du nœud s’invaginent ensuite dans l’espace mésodermique pour former l’axe médian de l’embryon qu’est la notochorde. Cet organe est responsable de la mise en place du squelette axial grâce à son activité sécrétoire (Shh, chordin, noggin). Dès la 8e semaine de développement, la notochorde disparaît progressivement pour laisser place aux vertèbres et à l’anneau fibreux. Entre les vertèbres, ces cellules notochordales prolifèrent et forment le NP [
9]. Dès la naissance, ce dernier subit des processus de maturation marqués, notamment par la disparition progressive des cellules notochordales selon un mécanisme encore inconnu [
10]. Grâce au développement de souris génétiquement modifiées et d’outils moléculaires qui permettent le suivi des cellules notochordales, deux études ont démontré que les cellules du NP, ou nucléopulpocytes, provenaient de la notochorde [
7, 8]. Ainsi, l’hypothèse d’une différenciation progressive des cellules notochordales en nucléopulpocytes fait actuellement l’objet d’investigations. De plus, de récentes études ont démontré que les cellules notochordales stimulent la synthèse de protéoglycanes (PG) par les nucléopulpocytes ainsi que leur prolifération, grâce à la sécrétion notamment du connective tissue growth factor (CTGF/CCN2) (Figure 2) [
11]. Ces protéoglycanes retiennent les molécules d’eau et offrent au NP des propriétés de déformabilité et de résistance aux contraintes mécaniques incomparables et indispensables au maintien de la dynamique rachidienne [2].
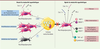 | Figure 2.
Dialogue moléculaire entre les cellules notochordales et les nucléopulpocytes. Les cellules notochordales, présentes dès la formation du DIV, favorisent la prolifération des nucléopulpocytes et la synthèse d’une matrice extracellulaire (MEC) riche en eau, en collagène de type II et en protéoglycanes. Quand les cellules notochordales disparaissent, ce dialogue moléculaire est rompu et les nucléopulpocytes s’engagent dans un programme catabolique conduisant à une fibrose de la MEC, une néo-innervation, une néo-vascularisation, une inflammation, ainsi qu’à une augmentation de l’apoptose. : médiateur inconnu ; X : rupture de la communication moléculaire ; + : stimulation de la synthèse ; ↑ augmentation de la synthèse ; PG : protéoglycane ; Col. I : collagène de type I ; Col. II : collagène de type II ; CTGF/CCN2 : connective tissue growth factor/CCN2 ; NGF : nerve growth factor ; BDGF : brain derived growth factor ; MMP : matrix metalloproteinase ; VEGF : vascular endothelial growth factor ; TNF-α : tumor necrosis factor-α. |
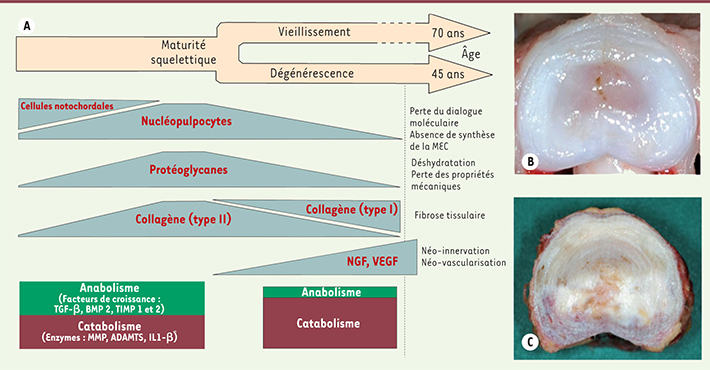
Ces relations moléculaires et cellulaires sont primordiales pour le maintien de l’homéostasie discale. Elles restent néanmoins fragiles et sont particulièrement affectées au cours du vieillissement. Le disque intervertébral dégénéré L’amortisseur fibro-hydraulique, constitué par le DIV et surtout par le NP, voit ses capacités de résistance aux contraintes mécaniques diminuer avec de l’âge. La région lombaire est particulièrement touchée, et l’hypothèse d’une usure liée à des contraintes mécaniques répétées a été longtemps défendue. L’origine multifactorielle de la dégénérescence discale est aujourd’hui bien décrite (composantes génétique, biomécanique, environnementale) et le rôle clé des cellules du NP dans la mise en place de ce processus est privilégié [ 2]. En effet, la disparition progressive des cellules notochordales s’accompagne d’une rupture du dialogue moléculaire avec les nucléopulpocytes, ce qui entraîne un déséquilibre de l’homéostasie discale. Ainsi, au moment de la maturité squelettique, période coïncidant avec les premiers signes de dégénérescence discale, la disparition des cellules notochordales est observée, et elle précède la disparition progressive des nucléopulpocytes. En parallèle, une atteinte qualitative et quantitative des composants de la MEC se met progressivement en place (Figure 3). Cette atteinte touche particulièrement les protéoglycanes et s’accompagne d’une déshydratation de la MEC et d’une diminution des capacités de résistance aux contraintes mécaniques.
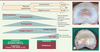 | Figure 3.
La dégénérescence discale. A. Représentation schématique de l’évolution des composants du DIV au cours de la dégénérescence discale. B. Vue macroscopique d’un DIV sain (hautement hydraté). C. Vue macroscopique d’un DIV dégénéré (déshydraté et fibrotique). MEC : matrice extracellulaire ; DIV : disque intervertébral ; NGF : nerve growth factor ; VEGF : vascular endothelial growth factor ; TGF-β : transforming growth factor-b ; BMP2 : bone morphogenic protein 2 ; TIMP1-2 : tissue inhibitor of metalloproteinase 1 and 2 ; MMP : matrix metalloproteinase ; ADAMTS : a disintegrin and metalloproteinase with thrombospondin motifs ; IL1-β : interleukine 1-β. |
Aujourd’hui, le rôle pivot de la disparition des cellules discales dans la mise en place de la dégénérescence du DIV contribue à faire de la médecine régénératrice une approche thérapeutique particulièrement prometteuse. Basée sur l’utilisation de cellules capables de restaurer les compartiments cellulaires altérés, associées ou non à un biomatériau, la médecine régénératrice du DIV a pour objectif de restaurer la MEC discale afin de rétablir ses propriétés de résistance aux contraintes mécaniques. |
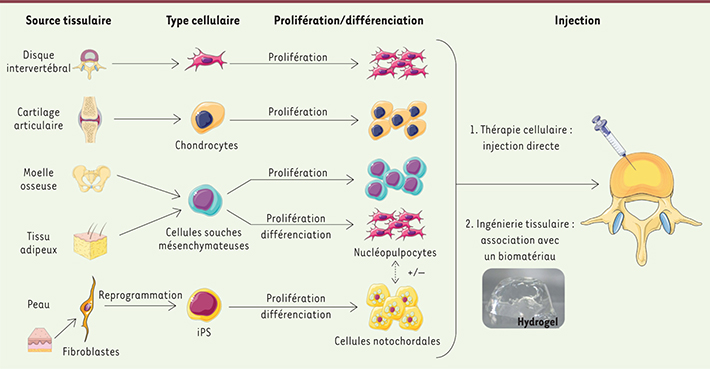
La médecine régénératrice du disque intervertébral : contexte et résultats actuels Trois approches thérapeutiques sont susceptibles d’être utilisées : la thérapie génique, la thérapie cellulaire et l’ingénierie tissulaire. Ces deux dernières, qui ont en commun l’utilisation de cellules régénératrices, retiennent aujourd’hui l’attention au regard de l’origine multifactorielle de la dégénérescence discale (Figure 4).
 | Figure 4.
Médecine régénératrice : de la thérapie cellulaire à l’ingénierie tissulaire. Le principe de la thérapie cellulaire repose sur l’injection in situ d’un ou plusieurs types de cellules, différenciées ou non. L’ingénierie tissulaire fait appel à un biomatériau qui permet de protéger les cellules injectées, et leur fournit un environnement adapté. IPS : induced pluripotent stem cell ; +/- : possibilité d’association des nucléopulpocytes et des cellules notochordales. |
La thérapie cellulaire Cette première approche est basée sur l’utilisation de cellules fonctionnelles afin de restaurer la MEC discale. Les différentes sources cellulaires
• Les cellules du NP et les chondrocytes articulaires. L’utilisation de cellules du NP issues de DIV sains étant impossible du fait de la morbidité associée au prélèvement, des cellules provenant de DIV herniés ont fait l’objet d’investigations précliniques et cliniques avec des résultats satisfaisants [
12]. Ainsi, chez l’animal, mais également chez des patients présentant une hernie discale, l’injection de ces cellules a permis de restaurer l’intensité du signal en T2 à l’IRM (imagerie par résonance magnétique), reflétant une amélioration de l’état d’hydratation discal. Cependant, leur usage à grande échelle est aujourd’hui peu envisageable du fait de la trop faible quantité de cellules obtenues lors des prélèvements, et de la nature pathologique des cellules de DIV herniés, dont le phénotype est différent de celui des cellules de NP sain (Figure 4). Compte tenu de certaines similitudes des chondrocytes articulaires avec les nucléopulpocytes (capacité à synthétiser une MEC riche en protéoglycanes et en collagène de type II), l’utilisation des premiers a été proposée pour traiter la dégénérescence discale (Figure 4). Ainsi, la formation d’un tissu cartilagineux a pu être démontrée [
13]. Aujourd’hui cependant, la description d’une signature phénotypique singulière des nucléopulpocytes a remis en question la pertinence de l’utilisation de chondrocytes pour la médecine régénératrice du DIV. Dans ce contexte, l’utilisation d’autres types cellulaires a été envisagée.
• Les cellules souches mésenchymateuses. La multipotence des cellules souches mésenchymateuses (CSM) en fait des candidates prometteuses pour la médecine régénératrice. Leur accessibilité est également un atout par rapport aux cellules décrites précédemment. Actuellement, les travaux utilisant les CSM de la moelle osseuse et du tissu adipeux sont les plus avancés. La nature indifférenciée ou pré-différenciée de ces cellules souches lors de leur injection in situ constitue un point de discussion majeur modifiant les stratégies mises en œuvre (Figure 4). Des cellules souches non différenciées, répondant aux signaux locaux une fois injectées dans le DIV, pourraient se différencier en un type cellulaire compatible avec une régénérescence discale. Cette hypothèse se fonde sur les propriétés de plasticité des CSM [
14], ainsi que sur leurs propriétés anti-inflammatoires et trophiques1 [
15,
16]. Pour le moment, à notre connaissance, cette plasticité en réponse à l’environnement n’a pas été démontrée pour les cellules implantées dans un site discal. L’utilisation de cellules indifférenciées expose aussi au risque de leur migration vers d’autres organes, pouvant y faire émerger des processus carcinogéniques. Aucune étude ne s’est intéressée à la biodistribution des CSM après injection intradiscale, et aucun processus cancérigène n’a été démontré ou infirmé. Ce risque théorique reste faible. L’utilisation de cellules pré-différenciées se heurte à un autre obstacle, d’ordre technique : aucun laboratoire n’a clairement identifié le(s) protocole(s) de différenciation adéquat(s) permettant d’induire la différenciation des CSM en nucléopulpocytes. Plusieurs pistes sont actuellement envisagées utilisant des facteurs de croissance, la modulation de la pression d’oxygène et la culture tridimensionnelle (3D). En effet, il a été montré qu’en présence de 2 % d’oxygène, de growth differentiation factor 5 (GDF5) et de transforming growth factor-β (TGF-β), des CSM de moelle osseuse cultivées en 3D (micromasses) synthétisent de l’agrécane et des glycosaminoglycanes [
17]. Parallèlement à cette stratégie d’enrichissement d’un milieu de culture, l’utilisation d’un milieu conditionné à partir de cellules notochordales issues de NP jeunes pourrait s’avérer efficace pour différencier des CSM en nucléopulpocytes. En effet, une étude a pu montrer une synthèse de glycosaminoglycanes sulfatés dans ces conditions [
18].
• Les iPS : la nouvelle donne ? Les cellules iPS (induced pluripotent stem cell) proviennent de la reprogrammation de cellules somatiques (le plus souvent des fibroblastes cutanés) par l’expression forcée de facteurs de transcription caractéristiques de l’état pluripotent [
19]. Elles possèdent les propriétés des cellules souches embryonnaires (CSE) et pourraient être un outil particulièrement intéressant en médecine régénératrice [
20]. Un essai utilisant des cellules iPS autologues différenciées en cellules de l’épithélium rétinien pigmenté a d’ailleurs débuté au Japon à l’été 2014 pour traiter la dégénérescence maculaire liée à l’âge [
21]. Les cellules iPS – qui, contrairement aux CSE, ne posent pas les problèmes éthiques d’utilisation d’embryons - pourraient constituer un tournant dans la stratégie de prise en charge de la dégénérescence discale. Ainsi, il a été récemment montré que des cellules iPS murines, différenciées en corps embryoïdes, dont les cellules sont triées selon leur expression de CD24, un marqueur de cellules progénitrices du NP [
22], pouvaient se différencier en une population cellulaire proche des nucléopulpocytes. Ces cellules se sont révélées capables de synthétiser les composants de la MEC d’un NP natif (protéoglycanes et collagène de type II) [
23]. La différenciation des iPS en cellules notochordales pourrait constituer également une approche intéressante au regard de l’absence d’une source de cellules notochordales. Ainsi, l’apport de cellules notochordales issues d’iPS permettrait de rétablir le dialogue moléculaire avec les nucléopulpocytes décrit précédemment afin de restaurer un environnement discal intègre (Figure 4).
• Cellules autologues ou allogéniques ? L’origine autologue ou allogénique des cellules thérapeutiques fait également l’objet de nombreuses discussions. Le développement de banques de cellules allogéniques garantirait la qualité des procédés de fabrication selon des normes GMP (good manufacturing practice) et offrirait des cellules « prêtes à l’emploi ». Cette validation est primordiale afin de garantir aux patients toute la sécurité indispensable à l’utilisation de ces médicaments de thérapie innovante (MTI ou ATMP [advanced therapy medicinal products]) selon le règlement européen 1394/2007 [
45]. Un premier essai clinique ayant pour objectif de traiter l’infarctus du myocarde de patients avec des cellules souches mésenchymateuses préalablement différenciées in vitro en cellules cardioprogénitrices selon différentes combinaisons de facteurs a d’ores et déjà été mené [
24]. L’utilisation de cellules allogéniques présente théoriquement plusieurs risques ou contraintes. Une première contrainte est celle des aspects éthiques et des exigences liées au prélèvement de tissus ou de cellules chez les donneurs potentiels. Le risque est aujourd’hui limité au regard des règlementations existantes, notamment au niveau européen (directive 2004/23 CE : normes de qualité et de sécurité pour le don, l’obtention, le contrôle, la transformation, le stockage et la distribution de tissus et cellules humains). Dans le contexte de la thérapie du DIV, l’obtention de CSM de donneurs peut être envisagée et n’expose pas aux mêmes risques ni questions éthiques que d’autres prélèvements (cellules d’embryon, de cordon ombilical, etc.). Le second risque auquel expose une utilisation de cellules allogéniques est le risque infectieux. Ce dernier semble maîtrisable grâce à une sélection des donneurs et à la mise en place de tests de sécurité sanitaire sur les cellules prélevées. Le dernier risque, immunogénique, est lié au développement de réactions immunitaires lors de l’injection de cellules allogéniques à l’origine d’un potentiel rejet. Ce risque semble cependant faible dans le contexte discal. En effet, il a été démontré que les CSM présentent des propriétés immunogéniques faibles [16,
25]. De plus, l’environnement discal constitue un site immunoprivilégié qui pourrait limiter ce risque [
26]. L’utilisation de cellules autologues peut également être envisagée mais pourrait conduire à une augmentation des coûts de production par rapport à la production des cellules régénératrices d’origine allogénique. L’harmonisation des procédés entre les établissements sera également un élément à surveiller. Dans les deux cas, et conformément au statut des MTI, l’obtention d’une autorisation des établissements pharmaceutiques sera nécessaire et ils devront se doter de procédures et de lieux adaptés à la manipulation des cellules. Thérapie cellulaire : résultats cliniques actuels Plusieurs études précliniques ont permis de démontrer la capacité de cellules « régénératrices » (cellules du NP, cellules adultes, CSM non différenciées) à synthétiser une MEC cartilagineuse en l’absence de matériau [ 13,
27,
28]. Parfois imparfaites, notamment par l’absence d’uniformité entre les matériels et les méthodes, ces études précliniques ont malgré tout permis d’envisager la mise en œuvre d’études cliniques. Une étude avec des cellules autologues du NP (isolées d’un DIV hernié adjacent) cultivées pendant 12 semaines avant leur réimplantation montre à deux ans, au niveau morphologique, une restauration des signaux IRM reflétant l’état d’hydratation du tissu discal et une réduction des douleurs (essai EuroDisc chez environ 60 patients) [ 12]. Dans une autre étude, ayant pour objectif de traiter 15 patients avec des chondrocytes juvéniles d’origine allogénique [
29], une amélioration de l’indice de hauteur discale et des symptômes douloureux était notée après un an. Aucune amélioration de l’hydratation des DIV des patients n’a cependant été observée. Concernant les études utilisant des CSM, seules des CSM non différenciées ont été utilisées. Une première étude, portant sur 10 patients et utilisant des cellules précurseurs autologues, n’a montré aucune amélioration des symptômes douloureux [
30]. À l’inverse, deux autres études (2 et 10 patients), utilisant de la moelle osseuse autologue (contenant environ 0,01 % de CSM indifférenciées), ont démontré une amélioration significative des douleurs chez les patients, ainsi qu’une restauration partielle de l’hydratation du DIV [
31,
32]. Le faible nombre de patients de ces études ne permet pas de conclure quant à l’efficacité de l’utilisation des CSM. Des études complémentaires, dont certaines sont déjà en cours (Tableau I), sont nécessaires afin de consolider ces premiers résultats cliniques. De plus, l’avancée de nos connaissances de la différenciation des CSM en nucléopulpocytes s’accompagnera probablement d’études précliniques et cliniques. Ces investigations devraient permettre de décider quelle stratégie, parmi celles décrites précédemment (Figure 4), sera la plus efficace.
Tableau I.
| Promoteur |
Produit |
Nbre patients |
Indications |
Nature des cellules |
Caractéristiques de l'étude |
Contrôle |
Références |
|
Celling treatment center (Austin, États-Unis) |
RegenaDISC |
NA |
Dégénérescence discale et hernie discale |
CSM autologues (moelle osseuse ou tissu adipeux) |
NA |
NA |
http://www.regenadisc.com
|
|
| Mesoblast Ltd (New York, États-Unis) |
- |
100 |
Dégénérescence discale |
CSM allogéniques |
Prospective, interventionnelle, randomisée, double aveugle |
Solution saline, solution d'acide hyaluronique |
ClinicalTrial.govNCT01290367 |
|
| Tetec AG (Rentlingen, Allemagne) |
Novocart Disc plus |
120 |
Hernie discale |
Cellules du NP autologues |
Prospective, interventionnelle, randomisée, ouverte |
Novocart Disc basic (pas de cellules), Séquestrectomie |
ClinicalTrial.govNCT01640457 |
|
| RNL Bio Company Ltd. (Séoul, Corée) |
- |
8 |
Dégénérescence discale |
CSM autologues (tissu adipeux) |
Prospective, interventionnelle, non randomisée, ouverte |
Un seul bras expérimental |
ClinicalTrial.gov NCT01643681 |
|
| Red de Terapia Celular (Valladolid, Espagne) |
- |
24(2x12) |
Dégénérescence discale |
CSM allogéniques (moelle osseuse) |
Prospective, interventionnelle, randomisée, double aveugle |
Mépicavaïne |
ClinicalTrial.govNCT01860417 |
|
| Bioheart, Inc(Sunrise, États-Unis) |
- |
100 |
Dégénérescence discale |
Cellules souches adipeuses |
Prospective, interventionnelle, ouverte, multicentrique |
Un seul bras expérimental |
ClinicalTrial.govNCT02097862 |
Médecine régénératrice du disque intervertébral : dispositifs et essais cliniques. NA : non applicable, signifie qu’il ne s’agit pas d’un essai clinique. |
L’ingénierie tissulaire L’ingénierie tissulaire a pour principe l’utilisation de cellules associées à un biomatériau ou à une matrice. Les approches utilisant un biomatériau dépourvu de cellules (prothèses partielles du DIV) ne seront pas traitées ici. Rôles du biomatériau Associée aux cellules « régénératrices », l’utilisation d’un biomatériau est envisagée pour plusieurs raisons. La première s’explique par le pourcentage élevé de mort cellulaire qui accompagne l’injection in situ des cellules et qui risque de limiter la réparation du tissu discal. Ainsi, l’utilisation d’un biomatériau cytoprotecteur favoriserait la survie, la prolifération et la différenciation des cellules injectées [
33]. Ce biomatériau pourrait également permettre de reproduire les propriétés de résistance aux contraintes mécaniques du DIV. Dans ce contexte, les progrès dans le domaine de la physico-chimie des matériaux et de l’ingénierie biomédicale ont permis le développement de multiples biomatériaux avec des propriétés biomécaniques variées [
34]. Propriétés des biomatériaux Parmi les biomatériaux développés, une famille se distingue pour des applications discales. Il s’agit de la famille des hydrogels, qui regroupe des polymères capables de former des réseaux hautement hydrophiles (> 90 % d’eau) rappelant la structure de la MEC du NP [ 2,
35,
36]. Les polymères utilisés dans la formation des hydrogels peuvent être d’origine naturelle (alginate, chitosan, acide hyaluronique, cellulose, etc.) ou synthétique (poly acide lactique co-glycolique [PLGA], poly acide lactique [PLA], etc.). Les avantages des polymères d’origine naturelle sont leur faible toxicité et leur biocompatibilité. Une variabilité importante lors de l’extraction des polymères naturels et de leur formulation doit être néanmoins soulignée, car elle limite l’homogénéité des résultats des expérimentations. À l’inverse, la variabilité des polymères synthétiques est faible et leurs propriétés peuvent être modulées aisément. Il n’existe actuellement pas de consensus concernant le choix du biomatériau le plus adapté pour une application en ingénierie tissulaire du DIV. Le biomatériau utilisé doit néanmoins présenter certaines propriétés intrinsèques (Tableau II). Le caractère auto-durcissant (dépendant du pH ou de la température) de l’hydrogel [
37] constitue une propriété intéressante, car elle permet d’envisager la mise en œuvre d’approches chirurgicales mini-invasives dont le bénéfice médico-économique est certain.
Tableau II.
| Propriétés |
Définition |
Implications en ingénierie tissulaire du DIV |
| Biocompatibilité |
Capacité à provoquer une réponse appropriée de l’organisme hôte dans une application spécifique |
Absence de réactions inflammatoires |
|
| Cytocompatibilité |
Capacité à conserver la viabilité des cellules |
Maintien des caractéristiques cellulaires propices à la synthèse d’une MEC adaptée |
|
| Biofonctionnalité |
Capacité à remplir in vivo les fonctions biologiques auxquelles la matrice est destinée |
Synthèse d’une MEC nucléopulpogénique riche en protéoglycanes offrant une résistance aux contraintes mécaniques |
|
| Injectabilité |
Biomatériau injectable |
Prise en charge ambulatoire du patient par chirurgie mini-invasive (percutanée) |
|
| Perméabilité |
Diffusion des nutriments et des déchets |
Échanges de gaz, nutriments et déchets. Maintien de la viabilité cellulaire et de la synthèse de la matrice extracellulaire discale |
|
| Biodégradabilité |
Dégradation du biomatériau au cours du temps |
Remplacement du biomatériau par une MEC discale intègre |
Propriétés des biomatériaux/matrices et implications en ingénierie tissulaire du DIV.
|
La biofonctionnalité est également une propriété indispensable. Ainsi, le biomatériau doit supporter, voire stimuler, la synthèse d’une MEC par les cellules régénératrices (cellules du NP, chondrocytes articulaires, CSM) ; cela a d’ores et déjà été démontré par certaines études [
38–
40]. La nature hyper-hydratée des hydrogels permet, en outre, de reproduire l’environnement discal natif (hydratation du NP > 95 %) et renforce leur intérêt en ingénierie tissulaire du DIV. Dans le choix du biomatériau pour l’ingénierie tissulaire discale, une autre propriété intrinsèque doit être prise en compte au regard du rôle du DIV dans la résistance aux contraintes mécaniques rachidiennes. Les propriétés mécaniques des biomatériaux sont ainsi souvent explorées et comparées aux propriétés de compression du NP isolé qui sont d’environ 10-kPa [34]. Dans ce contexte, la nature hyper-hydratée des hydrogels offre des propriétés de résistance hydraulique (swelling) particulièrement intéressantes. La modulation de ces propriétés mécaniques fait actuellement l’objet de multiples investigations basées notamment sur l’ajout de renforts mécaniques. Ingénierie tissulaire : résultats actuels Contrairement aux études de thérapie cellulaire, aucun essai clinique chez l’homme n’a actuellement été effectué en ingénierie tissulaire. Seules des études précliniques associant cellules régénératrices et biomatériau ont été réalisées. Toutes utilisent des CSM non différenciées d’origine médullaire [
41–
43] couplées à différents biomatériaux (atélocollagène, PLGA, collagène II/acide hyaluronique/chondroïtine). Les résultats de ces études démontrent la formation de novo d’une MEC cartilagineuse. Comme pour les études précliniques en thérapie cellulaire, il existe des disparités entre les matériels et les méthodes utilisés dans ces études (modèles animaux tels que le rat, le chien ou le lapin ; concentration en cellules injectées ; nature du biomatériau utilisé) qui compliquent l’analyse des résultats. Néanmoins, une méta-analyse récente a permis de comparer l’ensemble de ces études animales. Elle montre une amélioration au cours du temps des signaux IRM, reflétant l’hydratation des DIV traités [
44]. L’absence de données biomécaniques ne permet cependant pas de conclure quant à l’efficacité de cette stratégie d’ingénierie tissulaire sur l’amélioration de la résistance aux contraintes mécaniques des DIV traités. De multiples questions restent donc encore en suspens, à commencer par la définition du biomatériau le plus adapté ; la combinaison avec des types cellulaires, autres que les CSM non différenciées, peut être également envisagée. |
L’amélioration des connaissances physiopathologiques de la dégénérescence discale permet d’envisager la thérapie cellulaire et l’ingénierie tissulaire du NP comme des approches particulièrement prometteuses pour le traitement des lombalgies discogéniques. Pour faire de celles-ci des innovations de rupture dans la prise en charge des patients lombalgiques et répondre aux limites des traitements actuels, de nombreuses questions devront être résolues. Cependant, l’approfondissement des connaissances acquises dans le domaine des cellules souches et des biomatériaux devrait permettre d’envisager prochainement la restauration d’un tissu discal et de ses propriétés mécaniques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Fondation de l’avenir pour la recherche médicale appliquée (FARMA), Fondation pour la recherche médicale (FRM), Start-up grant AO Foundation.
|
Footnotes |
1.
Katz
JN
. Lumbar disc disorders and low-back pain : socioeconomic factors and consequences . J Bone Joint Surg Am.
2006; ; 88 : :21.–24. 2.
Clouet
J
,
Vinatier
C
,
Merceron
C
, et al.
The intervertebral disc : from pathophysiology to tissue engineering . Joint Bone Spine.
2009; ; 76 : :614.–618. 3.
Lee
CR
,
Sakai
D
,
Nakai
T
, et al.
A phenotypic comparison of intervertebral disc and articular cartilage cells in the rat . Eur Spine J.
2007; ; 16 : :2174.–2185. 4.
Clouet
J
,
Grimandi
G
,
Pot-Vaucel
M
, et al.
Identification of phenotypic discriminating markers for intervertebral disc cells and articular chondrocytes . Rheumatology.
2009; ; 48 : :1447.–1450. 5.
Sakai
D
,
Nakai
T
,
Mochida
J
, et al.
Differential phenotype of intervertebral disc cells : microarray and immunohistochemical analysis of canine nucleus pulposus and anulus fibrosus . Spine (Phila Pa 1976).
2009; ; 34 : :1448.–1456. 6.
Minogue
BM
,
Richardson
SM
,
Zeef
LA
, et al.
Characterization of the human nucleus pulposus cell phenotype and evaluation of novel marker gene expression to define adult stem cell differentiation . Arthritis Rheum.
2010; ; 62 : :3695.–3705. 7.
McCann
MR
,
Tamplin
OJ
,
Rossant
J
,
Seguin
CA
. Tracing notochord-derived cells using a Noto-cre mouse : implications for intervertebral disc development . Dis Model Mech.
2012; ; 5 : :73.–82. 8.
Choi
KS
,
Cohn
MJ
,
Harfe
BD
. Identification of nucleus pulposus precursor cells and notochordal remnants in the mouse : implications for disk degeneration and chordoma formation . Dev Dyn.
2008; ; 237 : :3953.–3958. 9.
Peacock
A
. Observations on the postnatal structure of the intervertebral disc in man . J Anat.
1952; ; 86 : :162.–179. 10.
Roberts
S
,
Evans
H
,
Trivedi
J
,
Menage
J
. Histology and pathology of the human intervertebral disc . J Bone Joint Surg Am.
2006; ; 88
(Suppl 2) : :10.–14. 11.
Erwin
WM
,
Ashman
K
,
O’Donnel
P
,
Inman
RD
. Nucleus pulposus notochord cells secrete connective tissue growth factor and up-regulate proteoglycan expression by intervertebral disc chondrocytes . Arthritis Rheum.
2006; ; 54 : :3859.–3867. 12.
Hohaus
C
,
Ganey
TM
,
Minkus
Y
,
Meisel
HJ
. Cell transplantation in lumbar spine disc degeneration disease . Eur Spine J.
2008; ; 17
(Suppl 4) : :492.–503. 13.
Acosta
FL, Jr
,
Metz
L
,
Adkisson
HD
, et al.
Porcine intervertebral disc repair using allogeneic juvenile articular chondrocytes or mesenchymal stem cells . Tissue Eng Part A.
2011; ; 17 : :3045.–3055. 14.
Pittenger
MF
,
Mackay
AM
,
Beck
SC
, et al.
Multilineage potential of adult human mesenchymal stem cells . Science.
1999; ; 284 : :143.–147. 15.
Bernardo
ME
,
Fibbe
WE
. Mesenchymal stromal cells : sensors and switchers of inflammation . Cell Stem Cell.
2013; ; 13 : :392.–402. 16.
Ankrum
JA
,
Ong
JF
,
Karp
JM
. Mesenchymal stem cells : immune evasive, not immune privileged . Nat Biotechnol.
2014; ; 32 : :252.–260. 17.
Stoyanov
JV
,
Gantenbein-Ritter
B
,
Bertolo
A
, et al.
Role of hypoxia and growth and differentiation factor-5 on differentiation of human mesenchymal stem cells towards intervertebral nucleus pulposus-like cells . Eur Cell Mater.
2011; ; 21 : :533.–547. 18.
Korecki
CL
,
Taboas
JM
,
Tuan
RS
,
Iatridis
JC.
, Notochordal cell conditioned medium stimulates mesenchymal stem cell differentiation toward a young nucleus pulposus phenotype . Stem Cell Res Ther.
2010; ; 1 : :18.. 19.
Takahashi
K
,
Tanabe
K
,
Ohnuki
M
, et al.
Induction of pluripotent stem cells from adult human fibroblasts by defined factors . Cell.
2007; ; 131 : :861.–872. 20.
Coulombel
L
. Cellules iPS humaines : déjà !
Med Sci (Paris).
2008; ; 24 : :102.–104. 21.
Song
P
,
Inagaki
Y
,
Sugawara
Y
,
Kokudo
N
. Perspectives on human clinical trials of therapies using iPS cells in Japan : reaching the forefront of stem-cell therapies . Biosci Trends.
2013; ; 7 : :157.–158. 22.
Tang
X
,
Jing
L
,
Chen
J.
, Changes in the molecular phenotype of nucleus pulposus cells with intervertebral disc aging . PLoS One.
2012; ; 7 : :e52020.. 23.
Chen
J
,
Lee
EJ
,
Jing
L
, et al.
Differentiation of mouse induced pluripotent stem cells (iPSCs) into nucleus pulposus-like cells in vitro . PLoS One.
2013; ; 8 : :e75548.. 24.
Bartunek
J
,
Behfar
A
,
Dolatabadi
D
, et al.
Reply : The C-CURE randomized clinical trial (cardiopoietic stem cell therapy in heart failure) . J Am Coll Cardiol.
2013; ; 62 : :2454.–2456. 25.
Goldschlager
T
,
Jenkin
G
,
Ghosh
P
, et al.
Potential applications for using stem cells in spine surgery . Curr Stem Cell Res Ther.
2010; ; 5 : :345.–355. 26.
Sun
Z
,
Zhang
M
,
Zhao
XH
, et al.
Immune cascades in human intervertebral disc : the pros and cons . Int J Clin Exp Pathol.
2013; ; 6 : :1009.–1014. 27.
Li
X
,
Lee
JP
,
Balian
G
,
Greg Anderson
D
. Modulation of chondrocytic properties of fat-derived mesenchymal cells in co-cultures with nucleus pulposus . Connect Tissue Res.
2005; ; 46 : :75.–82. 28.
Sakai
D
. Future perspectives of cell-based therapy for intervertebral disc disease . Eur Spine J.
2008; ; 17
(Suppl 4) : :452.–458. 29.
Coric
D
,
Pettine
K
,
Sumich
A
,
Boltes
MO
. Prospective study of disc repair with allogeneic chondrocytes presented at the 2012 Joint Spine Section Meeting . J Neurosurg Spine.
2013; ; 18 : :85.–95. 30.
Haufe
SM
,
Mork
AR
. Intradiscal injection of hematopoietic stem cells in an attempt to rejuvenate the intervertebral discs . Stem Cells Dev.
2006; ; 15 : :136.–137. 31.
Yoshikawa
T
,
Ueda
Y
,
Miyazaki
K
, et al.
Disc regeneration therapy using marrow mesenchymal cell transplantation : a report of two case studies . Spine (Phila Pa 1976).
2010; ; 35 : :E475.–E480. 32.
Orozco
L
,
Soler
R
,
Morera
C
, et al.
Intervertebral disc repair by autologous mesenchymal bone marrow cells : a pilot study . Transplantation.
2011; ; 92 : :822.–828. 33.
Liang
Y
,
Walczak
P
,
Bulte
JW
. The survival of engrafted neural stem cells within hyaluronic acid hydrogels . Biomaterials.
2013; ; 34 : :5521.–5529. 34.
Iatridis
JC
,
Nicoll
SB
,
Michalek
AJ
, et al.
Role of biomechanics in intervertebral disc degeneration and regenerative therapies : what needs repairing in the disc and what are promising biomaterials for its repair?
Spine J.
2013; ; 13 : :243.–262. 35.
Silva-Correia
J
,
Correia
SI
,
Oliveira
JM
,
Reis
RL
. Tissue engineering strategies applied in the regeneration of the human intervertebral disk . Biotechnol Adv.
2013; ; 31 : :1514.–1531. 36.
Leung
VY
,
Tam
V
,
Chan
D
, et al.
Tissue engineering for intervertebral disk degeneration . Orthop Clin North Am.
2011; ; 42 : :575.–583. 37.
Vinatier
C
,
Magne
D
,
Weiss
P
, et al.
A silanized hydroxypropyl methylcellulose hydrogel for the three-dimensional culture of chondrocytes . Biomaterials.
2005; ; 26 : :6643.–6651. 38.
Collin
EC
,
Grad
S
,
Zeugolis
DI
, et al.
An injectable vehicle for nucleus pulposus cell-based therapy . Biomaterials.
2011; ; 32 : :2862.–2870. 39.
Cheng
YH
,
Yang
SH
,
Su
WY
, et al.
Thermosensitive chitosan-gelatin-glycerol phosphate hydrogels as a cell carrier for nucleus pulposus regeneration : an in vitro study . Tissue Eng Part A.
2010; ; 16 : :695.–703. 40.
Huang
B
,
Li
CQ
,
Zhou
Y
, et al.
Collagen II/hyaluronan/chondroitin-6-sulfate tri-copolymer scaffold for nucleus pulposus tissue engineering . J Biomed Mater Res B Appl Biomater.
2010; ; 92 : :322.–331. 41.
Sakai
D
,
Mochida
J
,
Iwashina
T
, et al.
Regenerative effects of transplanting mesenchymal stem cells embedded in atelocollagen to the degenerated intervertebral disc . Biomaterials.
2006; ; 27 : :335.–345. 42.
Ruan
DK
,
Xin
H
,
Zhang
C
, et al.
Experimental intervertebral disc regeneration with tissue-engineered composite in a canine model . Tissue Eng Part A.
2010; ; 16 : :2381.–2389. 43.
Huang
B
,
Zhuang
Y
,
Li
CQ
, et al.
Regeneration of the intervertebral disc with nucleus pulposus cell-seeded collagen II/hyaluronan/chondroitin-6-sulfate tri-copolymer constructs in a rabbit disc degeneration model . Spine (Phila Pa 1976).
2011; ; 36 : :2252.–2259. 44.
Mehrkens
A
,
Muller
AM
,
Valderrabano
V
, et al.
Tissue engineering approaches to degenerative disc disease-a meta-analysis of controlled animal trials . Osteoarthritis Cartilage.
2012; ; 20 : :1316.–1325. 45.
Chabannon
C
,
Sabatier
F
,
Rial-Sebbag
E
, et al.
Les unités de thérapie cellulaire à l’épreuve de la réglementation sur les médicaments de thérapie innovante . Med Sci (Paris).
2014; ; 30 : :576.–583. |