| |
| Med Sci (Paris). 2014 December; 30(12): 1084–1086. Published online 2014 December 24. doi: 10.1051/medsci/20143012010.Allumer la lumière et ré-activer les souvenirs perdus… Stéphanie Daumas1* 1Neuroscience Paris Seine (NPS) ; Institut de biologie Paris Seine (IBPS) ; Sorbonne universités ; UPMC UM CR18 ; Inserm U1130 ; CNRS UMR 8246, 9, quai Saint-Bernard, bâtiment B, case 37, 75005Paris, France MeSH keywords: Animaux, Mémoire, physiologie, Plasticité neuronale, Stimulation lumineuse |
Nos souvenirs reflètent l’accumulation de nos expériences - ce que nous avons fait, avec qui et où - et, en ce sens, ils nous façonnent, forgent notre identité. Mais comment expliquer que certains souvenirs restent ancrés dans notre mémoire à jamais alors que d’autres s’estompent avec le temps ? L’une des plus anciennes théories de la cognition postule que ces souvenirs, aussi appelés traces mnésiques, sont le résultat de modifications moléculaires, cellulaires et anatomiques des réseaux neuronaux mis en jeu. Le cerveau a donc cette capacité de créer, modifier et défaire les réseaux neuronaux, en particulier en modifiant les connexions entre neurones, appelées synapses. Ce phénomène, nommé plasticité synaptique, serait essentiel à l’élaboration de nos souvenirs. Le journal Nature a publié le 17 juillet dernier la première preuve expérimentale de cette nécessité [
1]. |
Le lien entre plasticité synaptique et mémoire Ce lien supposé entre plasticité synaptique et mémoire a été explicité par Richard Morris et ses collègues sous le terme de « l’hypothèse de la plasticité synaptique et de la mémoire ». Selon cette hypothèse, pendant la formation de la mémoire, l’activité neuronale induirait une plasticité au niveau de certaines synapses, qui serait nécessaire et suffisante au stockage de l’information [
2]. Il y a maintenant plus de 40 ans que Bliss et Lømo [
3] ont découvert que le renforcement de ces connexions synaptiques pouvait perdurer des heures, des jours, voire des semaines. Ce phénomène a été nommé plasticité à long terme (PLT) et il existe un mécanisme inverse et complémentaire de cette PLT : la dépression à long terme (DLT), qui semblerait aussi jouer un rôle dans les phénomènes mnésiques en diminuant le couplage entre deux neurones. D’après Richard Morris [
4], plasticité synaptique et mémoire sont intimement liées et cela pour au moins deux raisons. D’une part, toutes deux présentent des propriétés cellulaires et physiologiques communes et, d’autre part, il a été montré que la PLT, ainsi que la DLT, répondaient à trois des quatre critères nécessaires et suffisants pour que le stockage de l’information se fasse dans les structures cérébrales présentant cette plasticité [
5]. Ces critères sont les suivants : 1. un changement des poids synaptiques doit être observé après apprentissage. En d’autres termes, la force des connexions entre les neurones est modifiée ; 2. interférer avec les mécanismes responsables de l’induction et de l’expression de la plasticité synaptique modifie les capacités d’apprentissage dans de nombreux paradigmes expérimentaux ; 3. altérer l’organisation des poids synaptiques après apprentissage affecte les capacités de l’animal à se souvenir des expériences précédemment acquises ; 4. en altérant de façon appropriée les poids synaptiques d’un réseau neuronal donné, l’animal devrait se comporter comme s’il se souvenait de quelque chose qui, en pratique, ne s’est pas déroulé. Ce quatrième critère constitue le mimétisme. De nombreuses études ont vérifié certains de ces critères. Ainsi, l’équipe d’Agnés Gruart et José Delgado-Garcia de l’Université de Séville a permis de mettre en évidence chez le rongeur l’occurrence de modifications synaptiques (PLT) au cours d’un apprentissage [
6]. Les travaux entrepris par l’équipe de Todd Sacktor ont montré que l’inhibition spécifique de la protéine kinase M zêta (PKMz) - protéine impliquée dans le renforcement des connexions synaptiques - dans diverses structures empêchait la maintenance de la PLT et abolissait la mémoire à long terme correspondante [
7]. Enfin, deux études publiées dans la revue Science [
8,
9] ces dernières années ont, pour la première fois, permis de montrer que l’on pouvait créer de toute pièce de faux souvenirs en activant un réseau neuronal précis. Bien que représentant des avancées majeures, ces études n’ont jamais clairement pu établir expérimentalement de lien direct entre cette plasticité synaptique à long terme et la mise en place de la mémoire. L’une des raisons peut être liée à la structure du cerveau sur laquelle ces études on été menées. En effet, la plupart de ces études se sont intéressées au rôle de la PLT dans la formation hippocampique, et aux mémoires associées. Or, le réseau hippocampique est complexe, et son implication précise dans les processus mnésiques associés est encore mal définie. |
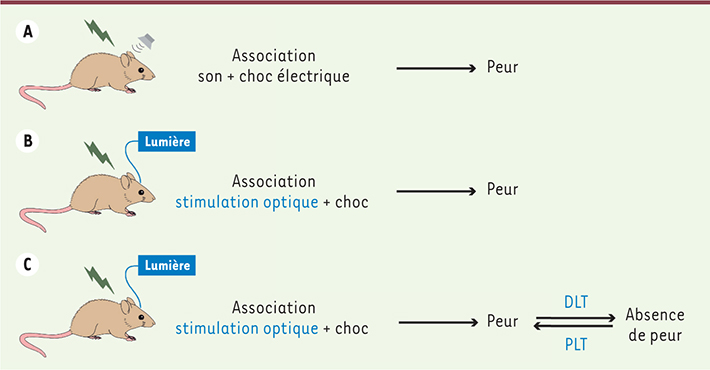
Plasticité synaptique et réponse de peur Mais la plasticité synaptique existe aussi dans d’autres régions cérébrales comme l’amygdale, une structure profonde du lobe temporal très fortement impliquée dans les processus de peur et d’anxiété. La peur constitue une émotion de base, qui peut néanmoins être acquise dans le but d’éviter des situations désagréables. Chez le rongeur, l’utilisation d’un conditionnement de peur de type pavlovien nous permet d’étudier cette adaptation comportementale [
10]. Durant la phase de conditionnement, l’animal apprend à associer un stimulus aversif dit inconditionné (SI), tel qu’un choc électrique léger délivré aux pattes, à un stimulus conditionné (SC) originellement neutre comme un son. Par la suite, la présentation isolée du son entraînera une réponse de peur conditionnée : l’immobilisation de l’animal (Figure 1A). Plus l’association entre le stimulus aversif inconditionné et le stimulus conditionné sera forte, plus le niveau d’immobilisation de l’animal sera élevé. Il a été montré que les informations sensorielles et auditives du stimulus aversif inconditionné et du stimulus conditionné transitent par les aires corticales puis thalamiques avant d’être, in fine, associées au niveau de l’amygdale latérale. Ainsi, sans surprise, chez le rongeur, des lésions de l’amygdale latérale entraînent un défaut de formation, mais aussi de rétention, de cette mémoire associative de peur.
 | Figure 1.
Modulation de la mémoire aversive par stimulations optogénétiques. A. Dans un protocole classique de peur conditionnée chez le rongeur, la présentation simultanée du son et du choc électrique permet leur association. Par la suite, la présentation seule du son pourra alors prédire l’occurrence du choc et entraîner un comportement de peur chez l’animal. B. Dans le protocole utilisé ici par les auteurs [ 8], le son a été remplacé par une stimulation optogénétique des afférences auditives de l’amygdale latérale. L’association de la lumière au choc électrique entraîne bien un comportement de peur associé au stimulus optique. C. Par la suite, la genèse artificielle de DLT pourra inactiver cette mémoire, alors que l’application de protocoles de PLT réactivera cette mémoire aversive. |
|
L’optogénétique permet d’établir un lien causal entre plasticité synaptique et mémoire associative Dans l’étude récemment publiée dans la revue Nature [1], l’équipe de Roberto Malinow de l’Université de Californie à San Diego a apporté la preuve que la plasticité synaptique était nécessaire à l’établissement de nos souvenirs. Cette étude n’aurait pas été possible sans les avancées techniques importantes acquises ces dernières années. En effet, l’utilisation du protocole de peur conditionnée décrit ci-dessus a été couplée à une approche optogénétique permettant aux auteurs de modifier de façon artificielle les connexions neuronales dans l’amygdale latérale. L’approche optogénétique consiste à rendre certains neurones sensibles à la lumière dans le but de pouvoir contrôler leur activité par des impulsions lumineuses. Dans l’étude, cette technique de stimulation lumineuse a permis de remplacer le stimulus sonore par une stimulation artificielle des voies auditives recrutées dans cet apprentissage aversif. L’association entre le stimulus optique et le choc électrique a non seulement permis l’expression d’une réponse de peur conditionnée chez le rat (Figure 1B), mais a aussi entraîné un phénomène de PLT au niveau des synapses stimulées. Cette réponse comportementale est bien due à un apprentissage associatif entre le stimulus lumineux et le choc électrique puisque si ces deux stimulus ne sont pas présentés simultanément lors de l’apprentissage, la réponse de peur n’est pas observée. Par la suite, les auteurs se sont servis de cette technique afin de créer artificiellement un phénomène de DLT ou de PLT des afférences auditives, et d’étudier ses effets sur la mémoire associative préalablement acquise par le rat. De façon incroyable, ils ont pu montrer que l’induction optique de DLT par des impulsions de lumière à basse fréquence (1 Hz) inactive cette mémoire, qui peut par la suite être réactivée grâce à l’application d’un protocole de stimulation optique de PLT en utilisant des impulsions de lumière à haute fréquence (100 Hz). Ainsi, la DLT permettrait d’inactiver cette mémoire aversive alors que la PLT, quant à elle, permettrait de la rétablir. L’ensemble de ces travaux constitue une avancée considérable dans la compréhension des mécanismes sous-tendant la mémoire. Ils établissent pour la première fois un lien direct entre les phénomènes de plasticité (PLT et DLT) et la mémoire associative. Toutefois, comme le soulignent les auteurs, cette PLT des voies auditives est nécessaire, mais non suffisante, pour créer une mémoire aversive, puisqu’elle doit pour cela être associée au choc électrique. Ainsi, la démonstration ultime serait de pouvoir générer artificiellement une mémoire en modifiant artificiellement les connexions synaptiques et ainsi valider le quatrième des critères énoncés ci-dessus : le mimétisme. Il est certain que nous n’avons jamais été aussi prêts du but. ‡ |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Nabavi
S
,
Fox
R
,
Proulx
CD
, et al.
Engineering a memory with LTD and LTP . Nature.
2014; ; 511 : :348.–352. 2.
Martin
SJ
,
Grimwood
PD
,
Morris
RG
. Synaptic plasticity and memory: an evaluation of the hypothesis . Annu Rev Neurosci.
2011; ; 23 : :649.–711. 3.
Bliss
TVP
,
Lømo
T
. Long-lasting potentiation of synaptic transmission in the dentate area of the anaesthetized rabbit following stimulation of the perforant path . J Physiol (Lond.).
1973; ; 232 : :331.–356. 4.
Morris
RGM
. Long-term potentiation and memory . Phil Trans R Soc Lond B.
2003; ; 358 : :643.–647. 5.
Martin
SJ
,
Morris
RGM
. New life in an old idea: the synaptic plasticity and memory hypothesis revisited . Hippocampus.
2002; ; 12 : :609.–636. 6.
Gruart
A
,
Munoz
MD
,
Delgado-Garcia
JM
. Involvement of the CA3-CA1 synapse in the acquisition of associative learning in behaving mice . J Neurosci.
2006; ; 26 : :1077.–1087. 7.
Sacktor
TC
. Memory maintenance by PKMz: an evolutionary perspective . Mol Brain.
2012; ; 5 : :31.–42. 8.
Garner
AR
,
Rowland
DC
,
Hwang
SY
, et al.
Generation of a synthetic memory trace . Science.
2012; ; 335 : :1513.–1516. 9.
Ramirez
S
,
Liu
X
,
Lin
PA
, et al.
Creating a false memory in the hippocampus . Science.
2013; ; 341 : :387.–391. 10.
Courtin
J
,
Dejean
C
,
Herry
C
. Comportement de peur : rôle des interneurones exprimant la parvalbumin edu cortex préfrontal médian . Med Sci (Paris).
2014; ; 30 : xxx sous presse.
|