| |
| Med Sci (Paris). 2014 December; 30(12): 1070–1073. Published online 2014 December 24. doi: 10.1051/medsci/20143012005.Réponse aux dommages à l’ADN durant l’embryogenèse Le rôle inattendu de la rétention nucléaire des ARN messagers Carole Iampietro1 and Eric Lécuyer1,2,3* 1Institut de recherches cliniques de Montréal (IRCM), laboratoire de biologie des ARN, 110 avenue des Pins, Ouest, MontréalH2W 1R7, Québec, Canada 2Département de biochimie, Université de Montréal, Montréal, Québec, Canada 3Division of experimental medicine, McGill University, Montréal, Québec, Canada MeSH keywords: Animaux, Noyau de la cellule, métabolisme, Altération de l'ADN, Drosophila, embryologie, Développement embryonnaire, génétique, Humains, ARN messager |
Tout au long de sa vie, une cellule peut être exposée à une panoplie d’agents génotoxiques internes et environnementaux, tels que des métabolites cellulaires néfastes, polluants et irradiations multiples, qui induisent des dommages à son ADN. Si rien n’est fait, cela peut mener à l’accumulation de mutations et d’anomalies des chromosomes pouvant prédisposer l’individu à une variété de pathologies. Heureusement, il existe des mécanismes qui permettent à la cellule de préserver l’intégrité de son génome. En effet, il est connu depuis longtemps que les dommages à l’ADN induisent l’activation de voies de signalisation dont les acteurs importants incluent les protéines à activité kinase ATM (ataxia telangiectasia mutated), ATR (ATM and Rad3-related), Chk1 (Checkpoint, S. pombe, homolog of, 1) et Chk2 [
1]. Les fonctions de ces protéines ont été très conservées au cours de l’évolution, de la levure jusqu’à l’être humain, et leur perte de fonction est impliquée dans l’étiologie de plusieurs maladies génétiques qui prédisposent les individus au développement de cancers [
2]. Ces protéines jouent un rôle primordial dans l’établissement de points de contrôle, communément nommés checkpoints, afin de prévenir la progression du cycle cellulaire en cas de lésions génomiques. En effet, l’activation de ces kinases aboutit à des réponses moléculaires variées, permettant de bloquer le cycle cellulaire, stimuler les mécanismes de réparation de l’ADN, ou induire la mort de la cellule lorsque les dommages s’avèrent irréparables [1]. Cependant, l’éventail des voies moléculaires modulées en réponse aux stress génotoxiques n’est pas entièrement élucidé, surtout si l’on considère que des voies distinctes pourraient être enclenchées selon le contexte cellulaire ou développemental. Dans cet article, nous survolons les résultats d’une étude récente établissant un nouveau lien fonctionnel entre la voie de réponse au stress génotoxique induite par la kinase Chk2 et l’export nucléaire des ARN messagers (ARNm) durant l’embryogenèse précoce chez la drosophile. Cette voie moléculaire joue un rôle clé dans un processus de contrôle de qualité qui permet l’élimination de génomes endommagés durant le développement de cet organisme. |
Stress génotoxique durant l’embryogenèse : l’exemple de la drosophile En contraste avec la littérature étoffée traitant des voies d’adaptation au stress génotoxique dans des modèles de lignées cellulaires différenciées, les mécanismes agissant durant les stades précoces du développement embryonnaire s’avèrent moins bien compris. Chez les métazoaires, à la suite de la fertilisation de l’œuf, les premières divisions cellulaires se succèdent rapidement, conduisant à une augmentation importante du nombre de cellules dans un court intervalle de temps. Les chercheurs ont depuis longtemps émis l’hypothèse que cette prolifération rapide pourrait se faire au détriment du maintien de l’intégrité du génome [
3]. En effet, il a été observé chez plusieurs organismes que les points de contrôle du cycle cellulaire semblent inactifs ou moins efficaces durant l’embryogenèse précoce. Cette inactivation des checkpoints est d’autant plus fréquente durant la période qui précède la transition mi-blastuléenne, étape à laquelle le programme développemental devient dépendant de la transcription zygotique [
4]. Par conséquent, les organismes doivent avoir développé des mécanismes leur permettant d’éliminer les cellules défectueuses générées lors des mitoses rapides de l’embryon précoce. Chez la drosophile, l’embryon se développe initialement sous forme d’un syncytium (les noyaux partageant le même cytoplasme) dans lequel les 13 premières divisions nucléaires se succèdent de manière synchrone, les noyaux passant directement de la phase M à la phase S, en l’absence apparente de phases G1 et G2 [
5]. À partir du cycle mitotique 9, les noyaux migrent vers le cortex de l’embryon où ils seront éventuellement encapsulés d’une membrane plasmique durant le processus de cellularisation, au début du cycle 14. L’épithélium embryonnaire ainsi formé contiendra environ 6 000 cellules progénitrices nécessaires à la formation des tissus somatiques de l’adulte [5]. Or, il a précédemment été démontré qu’en réponse à différents stress génotoxiques subis durant les cycles mitotiques 10 à 13, un processus de triage sera enclenché afin d’induire la chute des noyaux endommagés vers le cytoplasme central de l’embryon, où ils seront détruits [
6,
7]. Ce processus de tri nucléaire, nommé nuclear fallout, représente un mécanisme ingénieux de contrôle de qualité permettant de préserver l’intégrité du répertoire cellulaire de l’embryon. |
Mécanismes modulant l’élimination nucléaire : rétention nucléaire d’ARNm zygotiques induite par la kinase Chk2 Des études précédentes ont établi un lien entre l’inactivation fonctionnelle des centrosomes embryonnaires et le processus d’élimination nucléaire. Ces organites, qui représentent les points de nucléation des microtubules cellulaires, jouent un rôle important dans le maintien des noyaux au cortex de l’embryon syncytial. Or, il a été démontré que l’exposition à des agents génotoxiques conduit à une perte d’expression de certaines protéines constituantes des centrosomes, telles que dGrip91 et dGrip85, suggérant ainsi que la perturbation de l’activité normale de cet organite pourrait faciliter l’élimination des noyaux associés [
8]. De plus, les auteurs ont souligné l’implication dans ce processus de la kinase Chk2, encodée par le gène mnk (maternal nuclear kinase) chez la drosophile. En effet, les embryons mutants pour mnk sont incapables d’induire l’élimination de noyaux défectueux et accumulent des agrégats nucléaires anormaux dans l’épithélium embryonnaire [7,
9]. Cependant, les mécanismes moléculaires par lesquels Chk2 module le triage nucléaire et l’inactivation des centrosomes restaient toujours énigmatiques. Des expériences d’hybridation in situ fluorescente (FISH) à haut débit sur des embryons de drosophile ont précédemment permis l’identification d’une quinzaine d’ARNm zygotiques qui s’accumulent dans le nucléoplasme de noyaux en cours de fallout (Figure 1A) [
10,
11]. Cette collection inclut des transcrits codant pour des protéines nucléaires (par exemple histones H1, H2A, H2B, H3 et H4), mitotiques (par exemple Bsg25D/dNinéine, dGrip91) et cytosquelettiques (par exemple Nullo, Sry-alpha, Halo) dont les fonctions sont importantes pour le maintien de la viabilité nucléaire. Des études de co-marquages ARN/protéine ont d’ailleurs révélé que la rétention nucléaire de ces ARNm est associée à une perte d’expression localisée des protéines correspondantes au voisinage des noyaux fallout [11]. Curieusement, la rétention nucléaire de ces ARNm est fortement induite dans des embryons exposés à différents agents génotoxiques et s’avère dépendante de l’activation de la kinase Chk2 (Figure 1B), puisqu’elle n’est pas observée dans des embryons mnk mutants. Ces résultats suggèrent que la rétention nucléaire des ARNm représente une nouvelle facette de la voie de réponse au stress chez la drosophile, permettant de moduler l’accessibilité des ARNm à la machinerie traductionnelle située dans le cytoplasme. Ce processus pourrait ainsi expliquer, par exemple, l’origine de la perturbation de l’expression de protéines centrosomales en présence de dommages à l’ADN [7, 8].
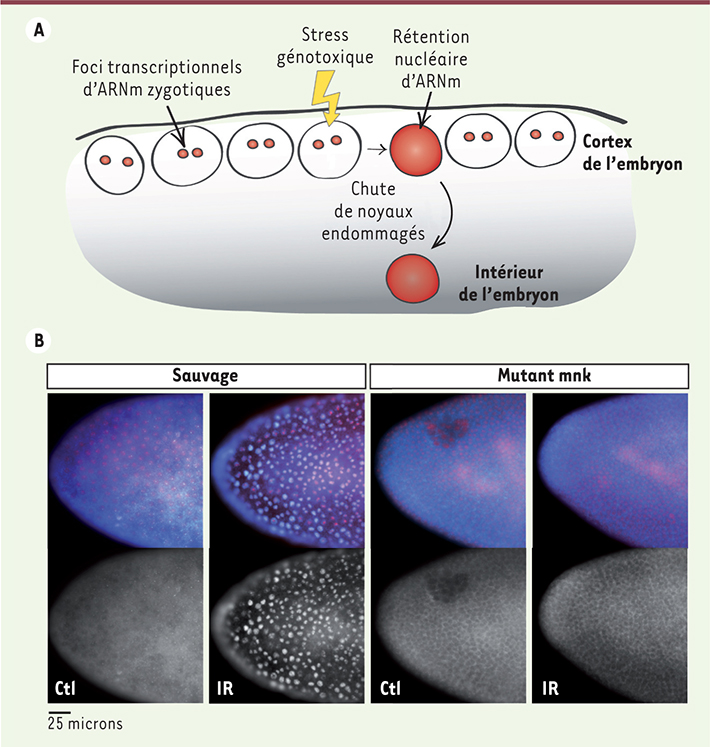
 | Figure 1.
Rétention nucléaire d’ARN messagers zygotiques induite par des agents génotoxiques. A. Schéma illustrant la région corticale d’un embryon de drosophile au stade de développement syncytial. Dans des noyaux normaux, l’expression d’ARN messagers zygotiques est détectable par FISH via la présence de foci nucléaires marquant les sites de transcription actifs. Normalement, ces ARNm zygotiques sont rapidement exportés vers le cytoplasme. Cependant, à la suite de l’exposition à des agents génotoxiques (éclair jaune), on observe une accumulation nucléaire de certains ARNm dans des noyaux qui chuteront vers l’intérieur de l’embryon. B. Images de FISH pour l’ARNm de l’histone H3 démontrant une rétention nucléaire marquée dans un embryon de drosophile sauvage exposé à des rayons ionisants (IR) par rapport aux embryons contrôles (Ctl). Dans les mutants du gène mnk, qui code pour la protéine Chk2, aucune rétention nucléaire n’est observée. Dans les images couleurs du haut, l’ARNm de l’histone H3 est en bleu, alors que les noyaux des embryons sont colorés en rouge. Les images en gris du bas démontrent le signal de l’ARNm de l’histone H3 seul. |
Afin de comprendre plus en détail le mécanisme moléculaire modulant la rétention nucléaire des ARNm induite par Chk2, nous avons focalisé notre attention sur un groupe bien particulier de transcrits, qui codent pour les protéines d’histones. Chez les eucaryotes supérieurs, ces ARNm ont la particularité d’être non polyadénylés à leur extrémité 3’ et de contenir une structure en tige-boucle hautement conservée dans leur région 3’ non traduite [11]. Cette dernière représente un site de liaison pour une protéine désignée SLBP, pour stem loop binding protein, un régulateur très spécifique des ARNm d’histones [
12]. Il a été démontré, à la fois chez la drosophile et l’humain, que SLBP est importante pour la maturation, l’export nucléaire et la traduction cytoplasmique des ARNm codant pour les histones [12]. Par des études de structure-fonction in vivo impliquant l’expression d’ARNm chimériques, nous avons pu montrer que la structure tige-boucle des histones était suffisante pour assurer la rétention de ces ARNm dans le noyau en réponse à un stress [11]. Cela nous a menés à émettre l’hypothèse selon laquelle la rétention nucléaire des ARNm d’histones pouvait être une conséquence de l’inactivation de SLBP par la signalisation Chk2. Cette hypothèse fut d’abord validée grâce à des analyses in vitro qui ont démontré que Chk2 phosphorylait SLBP sur un résidu sérine en position 118. In vivo, nous avons constaté que l’expression de SLBP était fortement diminuée au niveau des noyaux fallout et chez des embryons sauvages exposés à des agents génotoxiques. De plus, la substitution du résidu S118 par une alanine conduit à une stabilisation de la protéine, qui n’est plus dégradée en réponse aux inductions de dommages à l’ADN. En l’absence de SLBP endogène, l’expression de cette forme mutante de SLBP (S118A) bloque l’induction de la rétention nucléaire des transcrits d’histones en réponse aux irradiations gamma et perturbe l’élimination de noyaux endommagés [11]. Dans leur ensemble, ces expériences ont donc consolidé notre modèle suivant lequel la phosphorylation de SLBP entraîne sa dégradation, provoquant ainsi un blocage de l’export des ARNm d’histones (Figure 2).
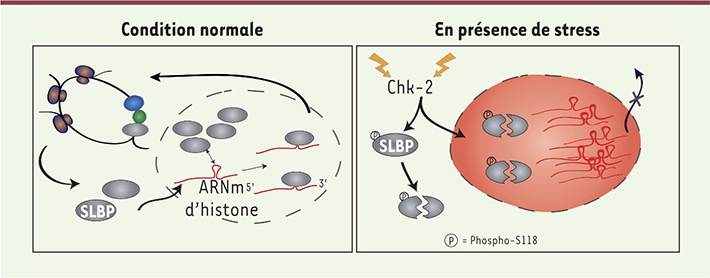
 | Figure 2.
Modèle de régulation de la protéine SLBP par la protéine kinase Chk2 en réponse au stress génotoxique. Dans des conditions de croissance normales (schéma de gauche), la protéine SLBP est impliquée dans l’export nucléaire et la traduction cytoplasmique des ARNm d’histones. En présence de stress génotoxique, la protéine Chk2 est activée et phosphoryle SLBP au niveau du résidu sérine 118 (S118). Cet événement de phosphorylation induit une dégradation de SLBP et une réduction de sa concentration nucléaire, menant à une perturbation de l’export nucléaire des ARNm d’histones. |
|
En résumé, cette étude récente a permis d’établir un lien inattendu entre le métabolisme des ARN et la voie de réponse aux dommages à l’ADN, tout en identifiant une nouvelle cible directe de la kinase Chk2 au cours du développement précoce de l’embryon. En stimulant la rétention nucléaire d’ARNm codant pour des protéines essentielles, plusieurs fonctions cellulaires, vitales pour l’embryon, seraient perturbées spécifiquement dans les noyaux endommagés. La réduction d’histones conduirait à un blocage de la réplication, alors que l’inactivation de protéines centrosomales et cytosquelettiques faciliterait la dissociation des noyaux de la zone corticale de l’embryon. L’ensemble de ces perturbations culmineraient alors dans l’élimination des noyaux défectueux. Si le rôle de la protéine SLBP a été démontré, il reste probable que Chk2 puisse aussi coordonner la rétention nucléaire des ARN messagers en phosphorylant d’autres protéines impliquées dans l’export nucléaire des ARNm. Des analyses phénotypiques de mutants affectant les voies de réponse au stress génotoxique suggèrent que des mécanismes semblables pourraient prévaloir au cours de l’embryogenèse chez les organismes vertébrés. Ainsi, l’identification des autres acteurs impliqués dans cette voie permettra sans doute de mieux comprendre les mécanismes mis en place par les organismes pour protéger leur génome au cours du développement. ‡ |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ce travail fut réalisé grâce à l’appui d’une subvention d’opération des Instituts de recherche en santé du Canada et d’une bourse salariale du Fonds de recherche Québec-Santé à Eric Lécuyer, ainsi qu’une bourse postdoctorale IRCM Angelo Pizzagalli décernée à Carole Iampietro. Nous remercions Julie Bergalet et Fabio Alexis Lefebvre pour leurs commentaires sur ce manuscrit.
|
1.
Ciccia
A
,
Elledge
SJ
. The DNA damage response: making it safe to play with knives . Mol Cell.
2010; ; 40 : :179.–204. 2.
Jackson
SP
,
Bartek
J
. The DNA-damage response in human biology and disease . Nature.
2009; ; 461 : :1071.–1078. 3.
Hartwell
LH
,
Weinert
TA
. Checkpoints: controls that ensure the order of cell cycle events . Science.
1989; ; 246 : :629.–634. 4.
O’Farrell
PH
,
Stumpff
J
,
Su
TT
. Embryonic cleavage cycles: how is a mouse like a fly?
Curr Biol.
2004; ; 14 : :R35.–R45. 5.
Foe
VE
,
Alberts
BM
. Studies of nuclear and cytoplasmic behaviour during the five mitotic cycles that precede gastrulation in Drosophila embryogenesis . J Cell Sci.
1983; ; 61 : :31.–70. 6.
Sullivan
W
,
Fogarty
P
,
Theurkauf
W
. Mutations affecting the cytoskeletal organization of syncytial Drosophila embryos . Development.
1993; ; 118 : :1245.–1254. 7.
Takada
S
,
Kelkar
A
,
Theurkauf
WE
. Drosophila checkpoint kinase 2 couples centrosome function and spindle assembly to genomic integrity . Cell.
2003; ; 113 : :87.–99. 8.
Sibon
OC
,
Kelkar
A
,
Lemstra
W
,
Theurkauf
WE
. DNA-replication/DNA-damage-dependent centrosome inactivation in Drosophila embryos . Nat Cell Biol.
2000; ; 2 : :90.–95. 9.
Xu
J
,
Du
W
. Drosophila chk2 plays an important role in a mitotic checkpoint in syncytial embryos . FEBS Lett.
2003; ; 545 : :209.–212. 10.
Lecuyer
E
,
Yoshida
H
,
Parthasarathy
N
, et al.
Global analysis of mRNA localization reveals a prominent role in organizing cellular architecture and function . Cell.
2007; ; 131 : :174.–187. 11.
Iampietro
C
,
Bergalet
J
,
Wang
X
, et al.
Developmentally regulated elimination of damaged nuclei involves a Chk2-dependent mechanism of mRNA nuclear retention . Dev Cell.
2014; ; 29 : :468.–481. 12.
Marzluff
WF
,
Wagner
EJ
,
Duronio
RJ
. Metabolism and regulation of canonical histone mRNAs: life without a poly(A) tail . Nat Rev Genet.
2008; ; 9 : :843.–854. |