| |
| Med Sci (Paris). 2014 November; 30(11): 946–948. Published online 2014 November 10. doi: 10.1051/medsci/20143011005.Chez les drépanocytaires, le pneumocoque se joue de la prévention et s’adapte à la maladie Conséquences vaccinales Dominique Labie1* and Jacques Elion2 1Institut Cochin, Inserm U1016, CNRS UMR 8104, Université René Descartes, Paris V, département de génétique, développement et pathologie moléculaire, Institut Cochin, 24, rue du Faubourg Saint-Jacques, 75014Paris, France 2Inserm UMR 1134, Université Paris Diderot, Sorbonne Paris Cité ; laboratoire d’excellence sur le globule rouge (GR-Ex), hôpital Robert Debré et Institut national de la transfusion sanguine, Paris, France MeSH keywords: Adaptation physiologique, génétique, immunologie, Drépanocytose, complications, métabolisme, microbiologie, Animaux, Antibioprophylaxie, Protéines bactériennes, Transport biologique, Porteur sain, Enfant d'âge préscolaire, Protéines du système du complément, déficit, Modèles animaux de maladie humaine, Conception de médicament, Multirésistance bactérienne aux médicaments, Prédisposition génétique à une maladie, Interactions hôte-pathogène, Humains, Nourrisson, Fer, sang, Métabolome, Souris, Partie nasale du pharynx, Résistance aux pénicillines, Infections à pneumocoques, prévention et contrôle, Vaccins antipneumococciques, Polyosides bactériens, Sélection génétique, Streptococcus pneumoniae, classification, pathogénicité, Virulence |
L’adaptation des agents infectieux à l’environnement, et en particulier à la pression des antibiotiques et des vaccins, est un phénomène bien connu et largement étudié en raison des enjeux thérapeutiques qui en résultent1. Parallèlement, la pression des maladies infectieuses sur l’évolution de l’espèce humaine, et tout particulièrement sur le maintien de certaines maladies génétiques fréquentes, telles que la drépanocytose ou la mucoviscidose, est également reconnue [
1]. Mais, à l’inverse, peu d’études ont analysé l’influence de l’hôte porteur sain d’une mutation pathogène, ou du patient atteint d’une maladie génétique, sur l’évolution des populations d’agents infectieux. Un travail coordonné par des équipes de l’hôpital d’enfants St Jude de Memphis (TN, états-Unis), publié récemment dans Cell Host Microbe, portant sur plus de 300 souches de pneumocoque (Streptococcus pneumoniae) isolées d’enfants drépanocytaires et en population générale pendant une période de plus de 20 ans, documente l’influence spécifique de l’environnement de l’hôte drépanocytaire sur l’évolution des populations pneumococciques [
2]. |
La drépanocytose et le pneumocoque Première maladie moléculaire identifiée en 1949, la drépanocytose (sickle cell disease - SCD) a, depuis l’origine, été un paradigme pour l’étude de l’interrelation adaptative hôte-pathogène. La mutation drépanocytaire, apparue à plusieurs reprises, probablement au début du Néolithique, en Afrique et en Inde, est toujours la même et aboutit à la production de l’hémoglobine pathologique (HbS). Elle s’est maintenue par l’avantage sélectif qu’elle confère aux porteurs sains (hétérozygotes AS) vis-à-vis du paludisme [
12], au prix d’une mortalité infantile dramatique chez les enfants atteints (homozygotes SS), le plus souvent au cours d’une infection paludique ou bactérienne. En Afrique, en dehors des zones urbaines où l’accès aux soins est facilité, la mortalité avant l’âge de cinq ans peut atteindre 95 % chez les enfants homozygotes pour la mutation. De fait, la drépanocytose est caractérisée par une extrême sensibilité aux infections par les bactéries encapsulées, spécifiquement pneumocoque - et aussi salmonelle en Afrique -, environ 600 fois plus élevée que celle de la population générale. Dans les pays industrialisés, et ponctuellement en Afrique et en Inde, c’est le dépistage néonatal de la drépanocytose qui a fait drastiquement chuter le taux de mortalité (< 5 % à 20 ans), essentiellement grâce à la prévention précoce des infections par l’instauration d’un traitement antibiotique prophylactique systématique et d’une vaccination antipneumococcique. Cependant, l’effet n’en est pas complet, et les complications infectieuses restent fréquentes chez de nombreux sujets drépanocytaires. D’une façon générale, S. pneumoniae colonise le nasopharynx, surtout chez les enfants, et sa diffusion invasive dans l’organisme est à l’origine de pathologies graves : pneumonie, méningite, septicémie ; la bactérie est responsable chaque année d’environ un million de décès. S. pneumoniae fait preuve d’une haute adaptabilité à l’environnement en raison d’une variabilité génétique rapide, faisant intervenir différents mécanismes, essentiellement de recombinaison, que reflètent plus de 90 sérotypes différant par leurs protéines de capsule et modifiés dans leur virulence [
3]. Quelques années après l’emploi du vaccin conjugué heptavalent (PCV7- PREVENAR) on a constaté le remplacement à peu près complet des sérotypes du vaccin par un sérotype virulent 19A [
4,
5]. Néanmoins, l’utilisation de vaccins de plus en plus polyvalents dans la population générale (GP), actuellement le vaccin polysaccharidique 23-valent (PPV23 - Pneumo 23®), a permis une diminution importante de la morbidité et de la mortalité. Qu’en est-il dans la population drépanocytaire ? |
Le pneumocoque présente un profil adaptatif particulier chez les drépanocytaires Chez les sujets drépanocytaires, le risque accru d’infections est classiquement expliqué par une asplénie fonctionnelle2 et un déficit du complément [
6]. Mais, les études récentes de métabolomique ont montré chez les patients l’existence d’un métabolisme particulier du zinc et du fer, des purines, acides aminés et glucides, reflété par des modifications spécifiques du taux plasmatique des métabolites correspondants [
7]. De plus, la vaccination anti-pneumococcique systématique et la penicillinothérapie préventive jusqu’à au moins l’âge de 5 ans expliquent que chez le sujet drépanocytaire, le pneumocoque évolue dans un environnement clairement différent de celui qu’il trouve dans la population générale. Les chercheurs de Memphis montrent que, malgré la prévention vaccinale et l’antibiothérapie, le taux de colonisation des sujets drépanocytaires par S. pneumoniae est similaire à celui de la population générale. Le taux de résistance à la pénicilline est élevé (> 50 %), ainsi que le taux d’émergence de sérotypes non inclus dans les vaccins (NVT > 95 %). Le séquençage systématique de l’ADN génomique de 320 souches isolées de patients drépanocytaires a permis de caractériser de façon globale les modifications génétiques sélectionnées par comparaison avec les souches isolées en population générale ou avec les souches historiques de sujets drépanocytaires [
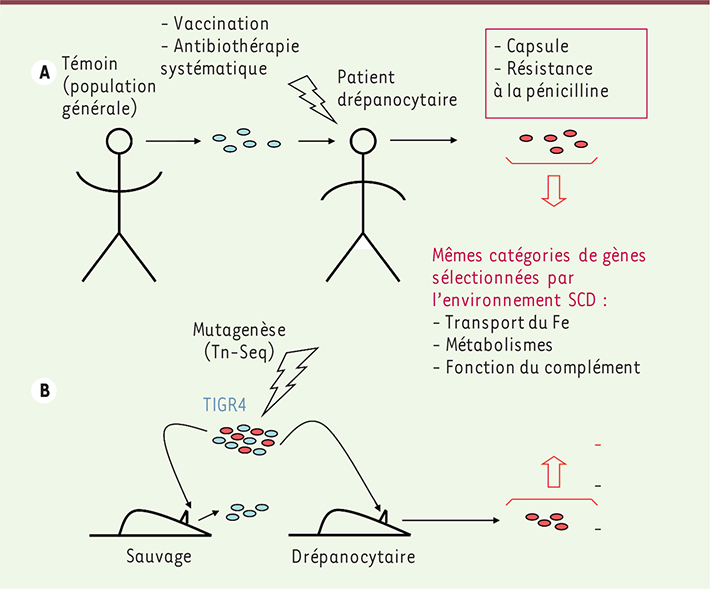
8]. Une constante des isolats de S. pneumoniae chez les patients contemporains est l’existence d’une diminution du nombre de gènes (environ 76 gènes en moins sur un total d’environ 2 200) résultant soit d’une perte absolue du gène considéré, soit d’un chimérisme par recombinaison intragénique. Une analyse en termes fonctionnels identifie quatre groupes de gènes affectés intervenant dans : la résistance à la pénicilline, la biosynthèse de la capsule, les voies métaboliques et le transport d’ions métalliques (Figure 1A). Si l’atteinte des deux premiers groupes est une conséquence attendue de l’intervention vaccinale et de l’antibiothérapie, celle des deux autres groupes est le reflet direct d’une adaptation spécifique du pneumocoque au microenvironnement particulier rencontré chez le sujet drépanocytaire.
 | Figure 1.
Représentation schématique comparée de l’infestation par le pneumocoque chez les patients et les souris drépanocytaires. A. Comparaison du sujet témoin (représentatif de la population générale), à gauche et du patient drépanocytaire à droite. Les sujets drépanocytaires sont vaccinés et sous antibiothérapie prophylactique. Le taux de colonisation par le pneumocoque est le même chez l’un et l’autre. Comme attendu, le pneumocoque s’adapte en modifiant ses protéines de capsule et en acquérant une résistance à la pénicilline. Mais on observe aussi chez les patients drépanocytaires des remaniements génétiques importants (perte de gènes, recombinaisons et gènes chimères) qui ne sont pas retrouvés dans les souches isolées en population générale et qui inactivent les gènes impliqués dans trois types de fonction : transport du fer, métabolisme des purines, fonction du complément. B. La souris sauvage (à gauche) et la souris drépanocytaire (à droite) ont été inoculées avec des mutants du même isolat invasif TIGR4 obtenus par la technique Tn-Seq. La sélection est différente dans les deux organismes. Alors que la souris sauvage élimine les pneumocoques mutés, la souris drépanocytaire sélectionne les pneumocoques ayant des mutations des gènes appartenant aux trois mêmes groupes fonctionnels que les mutations observées dans les souches isolées de sujets drépanocytaires. Six des gènes mutés sont même communs aux isolats obtenus expérimentalement chez la souris drépanocytaire et naturels isolés chez les patients. |
|
Cette signature adaptative est reproduite dans le modèle animal Les mutations de gènes impliqués dans le transport d’ions métalliques (et les métabolismes) suggèrent que dans l’environnement drépanocytaire, elles confèrent un avantage à S. pneumoniae, alors que ces mutants négatifs sont éliminés dans la population générale. Pour tester cette hypothèse, les auteurs ont utilisé l’approche dite Tn-Seq [
9]. Dans une première étape, des milliers de mutants ont été obtenus par mutagenèse médiée par des transposons à partir d’un isolat invasif isolé de la population générale (TIGR4) ; ces mutants ont été inoculés à des souris sauvages ou drépanocytaires (Figure 1B). Dans un second temps, les souches isolées de chacune des souris sont analysées par séquençage à haut débit. Soixante gènes se sont avérés inégalement adaptés chez l’animal sauvage et chez la souris drépanocytaire. Une corrélation nette est observée avec la physiopathologie humaine : les gènes dont les mutants négatifs sont sélectionnés chez la souris drépanocytaire concernent l’homéostasie du fer, le métabolisme des purines et la fonction du complément. Six des gènes de S. pneumoniae identifiés chez la souris drépanocytaire étaient aussi absents ou modifiés dans les isolats de sujets malades. Un de ces gènes code pour la protéine de transport du fer (PiaA). Cette protéine, qui appartient à un complexe hautement immunogénique, semble donc non nécessaire, voire nuisible au pneumocoque dans l’environnement riche en fer du sujet drépanocytaire. Il en est de même de l’enzyme dégradant le complément CppA (SP1449), qui est, elle aussi, est une protéine immunogène. Le modèle animal s’est également révélé intéressant pour montrer que la virulence des souches NVT isolées de patients était variable chez les souris sauvages, mais très élevée chez les souris drépanocytaires [
10]. |
Conclusion et perspectives L’ensemble de ces résultats montrent que l’existence d’un microenvironnement spécifique de l’hôte, ici le malade drépanocytaire, influence le profil de sélection des populations bactériennes pneumococciques par rapport à la population générale. Les patients drépanocytaires sont notoirement très sensibles aux infections par cette bactérie, et c’est malheureusement chez ces patients - et pas dans la population générale - qu’apparaissent des souches NVT particulièrement virulentes. Clairement, des procédures spécifiques doivent être élaborées pour des interventions thérapeutiques efficaces dans les infections graves du sujet drépanocytaire. Ces résultats ont des conséquences majeures en termes de développement vaccinal. Les protéines PiaA et CppA, très immunogènes, sont déjà, ou seront sûrement, utilisées pour la préparation de nouveaux vaccins. Il est prévisible que ces vaccins, dont on espère qu’ils seront plus efficaces dans la population générale que les vaccins actuels, seront totalement inefficaces chez les patients drépanocytaires puisque les souches isolées de ces patients n’expriment pas ces protéines [
11]. Voici donc encore un exemple où les avancées vers une médecine personnalisée, ici ciblée sur une population vulnérable, sont vivement attendues. Le problème des infections à pneumocoques chez le patient drépanocytaire est encore loin d’être résolu. Comme toujours, une avancée de la recherche soulève de nouvelles questions ; il s’en pose une dans le cas présent. Pourquoi, dans une même série et chez des sujets drépanocytaires soumis au même traitement prophylactique, certains présentent-ils des syndromes infectieux graves, parfois mortels, et pas les autres ? Au-delà des variants de l’agent pathogène, pourrait-on envisager des variantes interindividuelles de l’immunité innée, facilitant ou non l’expression de la virulence du pathogène ? Pour finir, l’analogie est frappante avec la mucoviscidose. Comme pour la drépanocytose, il s’agit d’une maladie génétique fréquente, probablement elle aussi sélectionnée par un avantage sélectif des porteurs sains (hétérozygotes) à la pression des maladies infectieuses, ici les diarrhées infectieuses. Comme pour la drépanocytose, chez les malades homozygotes atteints de mucoviscidose les complications graves sont au premier plan, ici les infections bronchiques à Pseudomonas aeruginosa. La question est donc : quelle est l’influence du microenvironnement bronchique spécifique chez ces patients sur le schéma évolutif des populations de P. aeruginosa et quelles en sont les conséquences éventuelles sur la prise en charge des patients ? |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Karlsson
EK
,
Kwiatkowski
DP
,
Sabeti
PC
. Natural selection and infectious disease in human populations.
Nat Rev Genet.
2014; ; 15 : :379.–393. 2.
Carter
R
,
Wolf
J
,
van Opijnen
T
, et al.
Genomic analysis of Pneumococci from children with sickle cell disease expose host-specific bacterial adaptations and deficits in current interventions . Cell Host Microbe.
2014; ; 15 : :587.–599. 3.
Croucher
NJ
,
Harris
SR
,
Fraser
C
, et al.
Rapid pneumococci evolutionin response to clinical interventions . Science.
2011; ; 331 : :430.–434. 4.
Wroe
PC
,
Lee
GM
,
Finkelstein
JA
, et al.
Pneumococcal carriage and antibiotic resistance in young children before 13-valent conjugate vaccine . Pediatr Infect Dis J.
2012; ; 31 : :249.–254. 5.
Croucher
NJ
,
Finkelstein
JA
,
Pelton
SI
, et al.
Population genomics of post-vaccine changes in pneumococcal epidemiology . Nat genet.
2013; ; 45 : :656.–663. 6.
Ram
S
,
Lewis LAvRice
PA
. Infections of people with complement deficiencies and patients who have undergone splenectomy . Clin Microbiol Rev.
2010; ; 23 : :740.–780. 7.
Dargouth
D
,
Koehl
B
,
Madalinski
G
, et al.
Pathophysiology of sickle cell disease is mirrored by the red blood cell metabolome . Blood.
2011; ; 117 : :e57.–e66. 8.
Daw
NC
,
Wilimas
JA
,
Wang
VC
, et al.
Nasopharyngeal carriage of penicillin-resistant Streptococcus pneumoniae in children with sickle cell disease . Pediatrics.
1997; ; 99 : :E7.. 9.
Van Opijnen
T
,
Camilli
A
. Transposon insertion sequencing: a new tool for systems-level analysis of microorganisms . Nat Rev Microbiol.
2013; ; 11 : :435.–442. 10.
Syk
A
,
Norman
M
,
Fernebro
J
, et al.
Emergence of hypervirulent mutants resistant to early clearance during systemic serotype 1 pneumococcal infection in mice and humans . J Infect Dis.
2014; ; 210 : :4.–13. 11.
Mitchell
TJ
,
Mitchell
AM
. Pneumococcus adapts to the sickle cell host . Cell Host Microbe.
2014; ; 15 : :521.–523. 12.
Labie
D
. Les relations complexes entre hémoglobinopathies et paludisme . Med Sci (Paris).
2010; ; 26 : :685.–687. |