 |
| |||
Med Sci (Paris). 2014 October; 30(10): 882–888. Published online 2014 October 14. doi: 10.1051/medsci/20143010015.Rôle de l’heme regulated inhibitor (HRI) dans la résistance à l’apoptose 1Département de biologie moléculaire, biochimie médicale et pathologie, faculté de médecine, université Laval, CHU de Québec St-François d’Assise, 10, rue de l’Espinay, G1L 3L5Québec, Canada Corresponding author. | ||||||
| ||||||
La cellule est constamment exposée à des stress physiologiques comme le manque de nutriments, les chocs thermiques et les chocs ischémiques. Pour y résister, la cellule doit rapidement répondre en activant des voies de survie. Les agents exogènes, tels que les drogues utilisées en chimiothérapie, provoquent également d’importants stress cellulaires. L’activation des voies de réponse au stress peut alors interférer avec la mort cellulaire, menant à une chimiorésistance. Or, ce problème de chimiorésistance est fréquemment observé en cancérologie. Les traitements anticancéreux ciblent souvent les voies d’induction de la mort cellulaire par apoptose dans les cellules tumorales. L’instabilité génomique des cellules cancéreuses, source de mutations additionnelles, et les modifications épigénétiques qui aboutissent à une augmentation de la prolifération ou une diminution de l’apoptose cellulaire [ 1], sont des mécanismes clés de la résistance de ces cellules aux drogues génotoxiques. Plusieurs études ont aussi démontré l’intervention, dans la diminution de la sensibilité cellulaire à certaines drogues ou l’échappement des cellules aux contrôles du cycle cellulaire, d’une reprogrammation de certaines voies de signalisation ciblées par ces drogues, même si ces dernières induisaient des dommages à l’ADN [1– 3]. Plus récemment, un mécanisme de résistance à l’apoptose induite par les radiations [ 4] et par les drogues chimiothérapeutiques a été mis en évidence [ 5– 8] ; il implique la formation de granules de stress anti-apoptotiques. Les granules de stress sont des corps cytoplasmiques non membranaires et dynamiques constitués, entre autres, d’ARNm, de protéines de liaison à l’ARN, et de molécules de signalisation intervenant dans la mort cellulaire. La séquestration des molécules de signalisation telles que RACK1 (receptor for activated C kinase 1), TRAF2 (TNF receptor-associated factor 2), ROCK1 (rho-associated, coiled-coil containing protein kinase 1) et RSK2 (ribosomal protein S6 kinase 2) dans les granules de stress inactive leur fonction dans les voies apoptotiques et le processus de mort cellulaire correspondant. Ceci contribue à la survie des cellules soumises au stress [5, 9, 10]. Les granules de stress peuvent aussi interférer avec l’apoptose via la stabilisation d’ARNm codant pour des protéines intervenant dans la survie cellulaire, telles que les cytokines ou p21 [4, 8]. De plus, en séquestrant les facteurs d’initiation de la traduction, les granules de stress contribuent à la répression de cette dernière. En effet, l’initiation de la traduction est inhibée dans la plupart des conditions induisant ces granules, comme les infections virales, le stress oxydant, les radiations ionisantes, les chocs thermiques et ischémiques, ainsi que les inhibiteurs du protéasome [ 7, 11– 13]. Cette inhibition fait intervenir la phosphorylation du facteur d’initiation de la traduction eIF2α (eukaryotic translation initiation factor 2α) [ 14]. Cette modification prévient la formation du complexe ternaire eIF2-GTP-ARNt fonctionnel, et résulte en la formation de complexes d’initiation incompétents pour la traduction, dont l’accumulation aboutit à la formation de granules de stress (Figure 1) [ 15]. eIF2α est phosphorylée sur la sérine 51 par une kinase, qui diffère selon le type de stress. Ces kinases sont au nombre de quatre [ 16, 17] : la protéine kinase R (PKR) intervient lors d’infections virales, la kinase PERK (PKR-like endoplasmic reticulum kinase) lors d’un stress du réticulum endoplasmique, la protéine kinase GCN2 (general control non-derepressible 2) en réponse aux radiations et à la carence en acides aminés, et, enfin, HRI (heme-regulated inhibitor) dans des conditions de déficit en hème. HRI est également activée lors d’une réponse au stress oxydant et au cours de traitements par des inhibiteurs du protéasome induisant la formation de granules de stress [7, 18]. Dans cette revue, nous proposons un nouveau rôle pour HRI dans la résistance à l’apoptose, en partie par l’induction des granules de stress.
| ||||||
HRI fut identifiée comme une kinase régulée par le niveau de l’hème dans les précurseurs des globules rouges. Elle comporte deux domaines de liaison à l’hème, dont l’un est inclus dans son domaine kinase (Figure 2) [ 19– 21]. Bien que le domaine kinase soit conservé dans les trois autres kinases mentionnées ci-dessus phosphorylant eIF2α, seule l’activité de HRI est affectée par le niveau de l’hème (Figure 3). En effet, la fixation de l’hème en position amino-terminale, dès la synthèse de HRI, entraîne la formation d’un homodimère de HRI pouvant s’autophosphoryler. Cette forme dimérique ne peut cependant pas fixer les molécules d’hème additionnelles qui sont nécessaires à la régulation de son activité kinase, sans l’intervention d’étapes d’autophosphorylation supplémentaires ; cette fixation d’hème au domaine catalytique inactive la kinase, qui ne peut plus phosphoryler eIF2α. En cas de déficit en hème, HRI s’active par autophosphorylation, particulièrement au niveau de la Thr485, grâce à la libération du site kinase auparavant occupé par l’hème. Ceci permet au dimère HRI de phosphoryler eIF2α [ 22]. Ce processus provoque l’inhibition de la traduction des α- et β-globines, qui constituent les protéines majeures des globules rouges. L’équilibre entre les taux de globines et d’hème, important pour la formation d’hémoglobine, est ainsi assuré [ 20]. En l’absence de HRI, et si le taux d’hème est insuffisant, la traduction des α- et β-globines se poursuit aboutissant à l’accumulation de ces molécules. Les globines en excès ont tendance à précipiter et à former des inclusions toxiques [20, 23], provoquant la lyse des globules rouges et donc une anémie [22].
De plus, l’anémie causée par une déficience en fer pourrait être aggravée par la déplétion en HRI via une apoptose accrue des précurseurs érythrocytaires [20, 22]. La perte de HRI a également des conséquences délétères dans d’autres modèles murins d’anémie, comme dans la protoporphyrie érythropoïétique, causée par une mutation d’une enzyme de la synthèse de l’hème. Une perte d’expression de HRI accentue les symptômes, baisse de l’hématocrite, toxicité hépatique des dépôts protéiques et photosensibilité [20, 22]. Dans la β-thalassémie – due à une mutation qui bloque l’expression du gène codant la β-globine – l’anémie est causée par une accumulation anormale d’α-globine. Puisque HRI sous sa forme active inhibe la traduction protéique, sa déplétion ne fait qu’aggraver l’accumulation toxique d’α-globine dans les précurseurs érythrocytaires [23, 24]. L’anémie sévère qui en résulte explique la létalité des embryons homozygotes pour la mutation de la β-globine. La perte d’un seul allèle du gène codant HRI aggrave significativement le phénotype des animaux modèles de β-thalassémie [23]. HRI est donc essentielle pour l’adaptation des précurseurs érythroblastiques à ces trois causes d’anémie [22]. L’ensemble de ces données démontrent que HRI s’oppose à la cytotoxicité érythroblastique dans des conditions de déficience en hème. | ||||||
HRI promeut la résistance des précurseurs des cellules sanguines au stress oxydant en activant la voie de signalisation ATF4 Le rôle de HRI n’est pas limité au contrôle de la synthèse des globines. D’autres études ont montré que cette kinase réduirait l’érythropoïèse inefficace causée par le stress oxydant induit par l’arsénite [24]. Dans les conditions de stress oxydant, la production de dérivés réactifs de l’oxygène (ROS, reactive oxygen species) est augmentée [ 25]. Or, ce taux élevé de ROS entraîne l’activation de HRI en induisant son autophosphorylation [24]. La kinase activée phosphoryle eIF2α, ce qui provoque une inhibition générale de l’initiation de la traduction, à l’exception toutefois de la traduction d’ARNm spécifiques ayant des petits cadres de lecture dans leur région 5’UTR (5’ untranslated region) [ 26]. Un de ces ARNm, dont la traduction est sélectivement activée par la phosphorylation d’eIF2α, code pour ATF4 (activating transcription factor 4), un facteur de transcription de la famille des protéines bZIP (basic leucine zipper protein) [26, 27]. La traduction sélective d’ATF4 se produit quelle que soit la kinase phosphorylant eIF2α. Un des rôles majeurs d’ATF4 est de faciliter l’induction d’un programme d’expression des gènes en réponse à l’activation des kinases de stress, une réponse connue sous le nom de réponse intégrée au stress [26, 28– 30]. Dans les précurseurs érythroïdes soumis à un stress oxydant, l’activation de la voie de signalisation ATF4, via la phosphorylation d’eIF2α par HRI, est nécessaire à l’expression d’anti-oxydants, dont l’hème oxygénase 1 (HO-1), qui réduisent le stress (Figure 4) [ 31, 32] et promeuvent la différenciation érythroïde [32]. Un autre gène cible d’ATF4 code pour le facteur de transcription CHOP (C/EBP homologous protein-10), dont l’induction entraîne celle de GADD34 (growth arrest and DNA damage-inducible protein 34) ; ce dernier recrute la forme phosphorylée d’eIF2α qui subira une déphosphorylation par la phosphatase 1. Cette étape permet de régénérer eIF2α sous une forme non phosphorylée compétente pour la traduction, événement nécessaire au rétablissement de la synthèse protéique à la fin de la réponse au stress.
Ainsi, l’inactivation de HRI prévient l’activation d’ATF4, empêchant ainsi l’expression des gènes codant pour les anti-oxydants. Ce phénomène rend les cellules érythroïdes très sensibles au stress oxydant qui induit leur apoptose. Cependant, il faut noter que l’hème régule également la transcription de gènes codant pour des protéines telles que HO-1 via sa liaison avec le facteur de transcription BACH1 (BTB and CNC homology 1 factor) [ 33]. Ce facteur forme des complexes protéiques avec ses partenaires MAF (musculoaponeurotic fibrosarcoma oncogene homolog) qui, en se liant sur des séquences de reconnaissance de MAF présentes au niveau des gènes cibles tel HO-1, répriment la transcription de ces derniers. Dans les conditions d’excès en hème, la fixation de l’hème sur BACH1 déstabilise la liaison des complexes BACH1 sur les séquences MAF, ce qui permet l’activation des gènes hébergeant ces séquences, comme le gène HO-1. Cette voie contrebalance ainsi la perte de l’expression de HO-1 qui résulte de l’inactivation de la voie HRI-ATF4 par l’hème. | ||||||
Récemment, l’équipe du Dr Anderson a décrit la formation des granules de stress via HRI dans les précurseurs érythroïdes lors d’un traitement par l’arsénite [ 34]. L’inhibition de HRI réduit la formation des granules de stress en présence d’arsénite, induisant ainsi l’apoptose de ces cellules. Les mécanismes par lesquels les granules de stress induits par HRI inhibent la mort des cellules sanguines en conditions de stress oxydant restent cependant inconnus. De même, on ignore encore si la formation des granules de stress en réponse à l’activation physiologique de HRI dans les cellules hématopoïétiques lors d’une déficience en hème pourrait ainsi contribuer à leur survie. Néanmoins, ces études suggèrent un rôle critique de HRI dans la résistance des cellules hématopoïétiques au stress, en partie en induisant la formation des granules de stress via la phosphorylation d’eIF2α. | ||||||
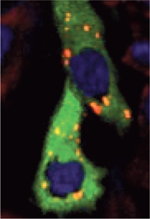
Le rôle de HRI dans la résistance à l’apoptose induite par le stress fut aussi décrit dans les fibroblastes embryonnaires de souris (MEF). Le laboratoire du Dr. Kaufman a montré que, contrairement aux MEF de type sauvage, les MEF n’exprimant pas HRI ne forment pas de granules de stress en présence d’arsénite et meurent par apoptose [18]. Dans une étude pionnière [7], nous avons établi que l’activation de HRI est critique pour la formation des granules de stress dans des cellules cancéreuses exposées au bortézomib, un inhibiteur du protéasome approuvé pour le traitement des myélomes. L’inactivation de HRI par interférence à ARN inhibe la phosphorylation d’eIF2α, donc aussi la formation des granules de stress. Les mécanismes d’activation de HRI par le bortézomib sont encore inconnus, mais ils pourraient faire intervenir la production de ROS ou l’accumulation de protéines ubiquitinées. Les protéines de choc thermique HSP90 et HSC70 ont aussi été décrites comme régulatrices de HRI dans les cellules sanguines soumises à différents types de stress [24]. L’activation de HRI par HSP90 fut attribuée à son activité chaperonne : elle permettrait la renaturation correcte de HRI ainsi que sa maturation, comme cela fut décrit dans les lysats des réticulocytes de lapin [ 35]. HSC70 semble jouer un double rôle dans la biologie de HRI [ 36]. D’une part, elle permet la renaturation de HRI pendant sa synthèse, ainsi que sa transformation en une kinase active. D’autre part, elle semble être requise pour inhiber la suractivation de HRI pendant le stress, en inhibant son hyperphosphorylation. Des études futures sont cependant nécessaires pour valider le rôle de HSP90 et HSC70 dans la régulation de HRI in vivo en conditions de stress. Ces deux chaperonnes pourraient donc aussi contribuer à l’activation de HRI dans les cellules exposées aux inhibiteurs du protéasome. Nous proposons que l’activation de HRI observée lorsque le protéasome est inhibé puisse être due à sa stabilisation, avec comme conséquence sa surexpression. Dans ce contexte, on note que la surexpression de HRI par transfection transitoire induit la formation des granules de stress, démontrant un rôle clé de HRI dans la formation de ces granules (Figure 5). Notre résultat suggère que l’activation de HRI menant à la formation des granules de stress peut être régulée par son niveau d’expression. Il serait ainsi intéressant de rechercher si le niveau d’expression de HRI dans des lignées cellulaires cancéreuses est corrélé avec la formation des granules de stress et la résistance des cellules à l’apoptose qui leur est associée. Comme prémisse, nous avons montré que l’inhibition de l’expression de HRI dans les cellules cancéreuses HeLa traitées par le bortézomib supprime la formation des granules de stress, sensibilisant ainsi les cellules à la drogue [7]. Ces travaux suggèrent donc un nouveau rôle de HRI dans la résistance à l’apoptose des cellules cancéreuses traitées par le bortézomib. Ces résultats doivent cependant être vérifiés in vivo par l’inactivation – génétique ou pharmacologique – de HRI, ce qui sensibiliserait les tumeurs humaines transplantées chez la souris au bortézomib, postulant ainsi un rôle thérapeutique de HRI.
| ||||||
Développement de drogues inhibitrices de HRI Plusieurs études récentes ont mis en évidence l’implication des kinases phosphorylant eIF2α dans le développement du cancer. Les expériences de déplétion par des siARN ont révélé un rôle potentiel de la protéine PKR dans le développement tumoral via la résistance des cellules cancéreuses au traitement anticancéreux, ainsi que leur prolifération [
37–
39]. De même, l’inactivation de PERK, par des approches génétique [
40] ou pharmacologique [
41], induit une surproduction des ROS induisant des dommages oxydants de l’ADN ; ceux-ci provoquent l’activation des points de contrôle du cycle cellulaire, inhibant ainsi la prolifération des cellules cancéreuses in vitro et ralentissant la croissance tumorale in vivo. Ces résultats montrent un rôle protumoral de PERK et suggèrent aussi une fonction protectrice potentielle de cette kinase contre des agents chimiothérapeutiques qui fonctionnent via la génération des ROS. Le rôle protumoral des kinases ciblant eIF2α est aussi illustré par l’induction de l’expression de la kinase GCN2, qui survient dans les tumeurs dépourvues de nutriments. Cette surexpression de GCN2 induit l’activation d’ATF4, ce qui facilite l’expression de la protéine VEGF (vascular endothelial growth factor), induisant ainsi l’angiogenèse et le développement tumoral [
42]. Des inhibiteurs de PERK, GCN2 ou PKR pourraient donc constituer d’excellents outils pour réduire la croissance tumorale, ainsi que la résistance des cellules cancéreuses aux traitements.Au cours de ces dernières années, des molécules permettant d’inhiber HRI dans une perspective thérapeutique ont été développées. Une équipe a développé des aminopyrazolindanes, qui inhibent HRI in vitro en entrant en compétition avec l’ATP, mais les essais effectués chez les rats ont montré une faible biodisponibilité [ 43]. Des études de relations structure-activité ont permis d’améliorer les propriétés pharmacodynamiques de la molécule de départ. Par ailleurs, l’utilisation de ces nouveaux dérivés a permis l’étude du rôle de HRI dans la plasticité synaptique lors de tests d’apprentissage effectués chez le rat, suggérant que HRI peut être ciblée de façon pharmacologique [ 44]. Des études plus poussées devront cependant être réalisées afin de tester la spécificité de ces drogues et d’optimiser leurs propriétés thérapeutiques potentielles. De nouvelles générations d’inhibiteurs de HRI verront sûrement le jour dans un futur proche et pourront être utilisés in vivo afin de valider les résultats obtenus in vitro. L’inhibition de HRI serait donc une stratégie d’intérêt pour contourner la chimiorésistance de certains cancers. Développement de drogues activatrices de HRI Si les kinases phosphorylant eIF2α sont impliquées dans le développement tumoral, plusieurs études ont montré que l’absence de phosphorylation d’eIF2α intervient également dans plusieurs types de cancers où l’on constate une traduction générale dérégulée [
45,
46]. De plus, la phosphorylation d’eIF2α est connue, soit pour activer des signaux pro-apoptotiques (activation de la voie de mort cellulaire ATF4-CHOP [14,
47], induction de l’expression du récepteur Fas de mort cellulaire [
48]), soit pour empêcher la traduction de protéines de survie telles Bcl-x, inhibant ainsi les voies anti-apoptotiques et favorisant la mort cellulaire [16]. Ce rôle pro-apoptotique de la phosphorylation d’eIF2α suppose que son induction par les kinases eIF2α puisse contrer le développement tumoral en induisant la mort des cellules cancéreuses.Dans l’optique de définir le rôle de la voie HRI-phospho-eIF2α dans la croissance des tumeurs, une équipe a récemment développé des dérivés du N,N’diarylureas qui semblent induire la phosphorylation d’eIF2α en liant directement HRI [45]. Bien que cette interaction directe entre la molécule et la protéine HRI ait été prouvée par essai DARTS (drug affinity responsive target stability), aucune preuve de l’autophosphorylation ni de l’activation de HRI n’a été présentée dans cette étude. Néanmoins, le traitement de plusieurs lignées cancéreuses avec les dérivés du N,N’diarylureas induit la phosphorylation d’eIF2α, qui est significativement réduite lors de la déplétion de HRI par ARN interférence. Grâce à une étude de relation structure-activité, Chen et al. ont également identifié un dérivé, le BTdCPU, qui stabilise la croissance des xénogreffes de tumeurs mammaires chez la souris sans produire d’effets secondaires toxiques pour l’animal. Cette observation permet de suggérer que les dérivés du N,N’diarylureas ralentissent la progression tumorale en bloquant le cycle cellulaire par leur action directe sur HRI. Cet effet antiprolifératif des dérivés du N,N’diarylureas a aussi été observé in vitro ; il serait dû en partie à l’inhibition de la traduction des ARNm codant pour des activateurs du cycle cellulaire tels que la cycline D1 [45]. Le traitement avec les dérivés du N,N’diarylureas n’induit pas l’apoptose des cellules cancéreuses, excluant que HRI joue un rôle pro-apoptotique dans ces conditions. En se fondant sur ces études et sur celles, antérieures, montrant que HRI promeut la résistance des cellules cancéreuses au stress, nous proposons un double rôle pour HRI en fonction de son mode d’activation. D’une part, l’activation directe de HRI par des drogues spécifiques, par exemple les dérivés du N,N’diarylureas, peut réprimer la traduction des régulateurs du cycle cellulaire comme la cycline D1, inhibant ainsi la prolifération cellulaire. Ces activateurs de HRI constituent donc un espoir pour ralentir la progression tumorale en induisant l’arrêt du cycle cellulaire. D’autre part, l’activation indirecte de HRI par les drogues chimiothérapeutiques, telles que les inhibiteurs du protéasome, inhibe l’apoptose en partie en induisant la séquestration des molécules de mort cellulaire dans les granules de stress. Il est aussi possible que HRI atténue l’effet létal des inhibiteurs du protéasome en empêchant une surproduction des ROS. Dans ce contexte, il fut montré que l’induction de la voie HRI-granules de stress par un stress oxydant qui nécessite la production des ROS (comme un ajout d’arsénite), agit comme un régulateur négatif du stress en atténuant la surproduction des ROS via la séquestration des protéines pro-oxydantes (comme G3BP1) dans les granules de stress [ 49]. L’inhibition pharmacologique de HRI pourrait alors, en empêchant la formation des granules de stress suite aux traitements thérapeutiques, favoriser la surproduction des ROS létales, sensibilisant ainsi les tumeurs résistantes à la mort cellulaire. | ||||||
Si l’on envisage d’utiliser HRI comme cible thérapeutique, il est nécessaire de mieux en comprendre le mode d’activation. Il serait aussi intéressant d’étudier l’implication de cette kinase dans la résistance cellulaire induite par différentes drogues chimiothérapeutiques pour déterminer si HRI joue un rôle général dans la chimiorésistance. Ces études pourraient aboutir à l’utilisation d’une combinaison d’agents chimiothérapeutiques existants et de modulateurs de HRI pour contourner les processus de chimiorésistance. En conclusion, l’étude de la kinase HRI permettra peut-être de proposer de nouveaux traitements aux patients atteints de cancers résistants aux drogues actuelles. | ||||||
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. | ||||||
F.H. Joncas est étudiante au baccalauréat sciences biomédicales (faculté de médecine de l’Université Laval). P. Adjibade, étudiante au doctorat, est titulaire de la bourse d’étude Pierre Durand offerte par la faculté de médecine de l’Université Laval. Ce travail est supporté par la subvention de la Société canadienne de recherche sur le cancer (volet innovation ; numéro 702406) octroyée à R. Mazroui. R. Mazroui est titulaire de la bourse salariale nouveau chercheur des Instituts de recherche en santé du Canada. | ||||||
1.
Rebucci
M
,
Michiels
C
. Molecular aspects of cancer cell resistance to chemotherapy . Biochem Pharmacol.
2013; ; 85 : :1219.–1226. 2.
Dempke
WC
,
Heinemann
V
. Resistance to EGF-R (erbB-1) and VEGF-R modulating agents . Eur J Cancer.
2009; ; 45 : :1117.–1128. 3.
Gottesman
MM
,
Fojo
T
,
Bates
SE
. Multidrug resistance in cancer: role of ATP-dependent transporters . Nat Rev Cancer.
2002; ; 2 : :48.–58. 4.
Moeller
BJ
,
Cao
Y
,
Li
CY
,
Dewhirst
MW
. Radiation activates HIF-1 to regulate vascular radiosensitivity in tumors: role of reoxygenation, free radicals, and stress granules . Cancer Cell.
2004; ; 5 : :429.–441. 5.
Arimoto
K
,
Fukuda
H
,
Imajoh-Ohmi
S
, et al.
Formation of stress granules inhibits apoptosis by suppressing stress-responsive MAPK pathways . Nat Cell Biol.
2008; ; 10 : :1324.–1332. 6.
Fournier
MJ
,
Coudert
L
,
Mellaoui
S
, et al.
Inactivation of the mTORC1-eukaryotic translation initiation factor 4E pathway alters stress granule formation . Mol Cell Biol.
2013; ; 33 : :2285.–2301. 7.
Fournier
MJ
,
Gareau
C
,
Mazroui
R
. The chemotherapeutic agent bortezomib induces the formation of stress granules . Cancer Cell Int.
2010; ; 10 : :12.. 8.
Gareau
C
,
Fournier
MJ
,
Filion
C
, et al.
p21(WAF1/CIP1) upregulation through the stress granule-associated protein CUGBP1 confers resistance to bortezomib-mediated apoptosis . PLoS One.
2011; ; 6 : :e20254.. 9.
Eisinger-Mathason
TS
,
Andrade
J
,
Groehler
AL
, et al.
Codependent functions of RSK2 and the apoptosis-promoting factor TIA-1 in stress granule assembly and cell survival . Mol Cell.
2008; ; 31 : :722.–736. 10.
Kim
WJ
,
Back
SH
,
Kim
V
, et al.
Sequestration of TRAF2 into stress granules interrupts tumor necrosis factor signaling under stress conditions . Mol Cell Biol.
2005; ; 25 : :2450.–2462. 11.
Kedersha
NL
,
Gupta
M
,
Li
W
, et al.
RNA-binding proteins TIA-1 and TIAR link the phosphorylation of eIF-2 alpha to the assembly of mammalian stress granules . J Cell Biol.
1999; ; 147 : :1431.–1442. 12.
Kwon
S
,
Zhang
Y
,
Matthias
P
. The deacetylase HDAC6 is a novel critical component of stress granules involved in the stress response . Genes Dev.
2007; ; 21 : :3381.–3394. 13.
McInerney
GM
,
Kedersha
NL
,
Kaufman
RJ
, et al.
Importance of eIF2alpha phosphorylation and stress granule assembly in alphavirus translation regulation . Mol Biol Cell.
2005; ; 16 : :3753.–3763. 14.
Wek
RC
,
Jiang
HY
,
Anthony
TG
. Coping with stress: eIF2 kinases and translational control . Biochem Soc Trans.
2006; ; 34 : :7.–11. 15.
Kedersha
N
,
Chen
S
,
Gilks
N
, et al.
Evidence that ternary complex (eIF2-GTP-tRNA(i)(Met))-deficient preinitiation complexes are core constituents of mammalian stress granules . Mol Biol Cell.
2002; ; 13 : :195.–210. 16.
Donnelly
N
,
Gorman
AM
,
Gupta
S
,
Samali
A
. The eIF2alpha kinases: their structures and functions . Cell Mol Life Sci.
2013; ; 70 : :3493.–3511. 17.
Holcik
M
,
Sonenberg
N
. Translational control in stress and apoptosis . Nat Rev Mol Cell Biol.
2005; ; 6 : :318.–327. 18.
McEwen
E
,
Kedersha
N
,
Song
B
, et al.
Heme-regulated inhibitor kinase-mediated phosphorylation of eukaryotic translation initiation factor 2 inhibits translation, induces stress granule formation, and mediates survival upon arsenite exposure . J Biol Chem.
2005; ; 280 : :16925.–16933. 19.
Chefalo
PJ
,
Oh
J
,
Rafie-Kolpin
M
, et al.
Heme-regulated eIF-2alpha kinase purifies as a hemoprotein . Eur J Biochem.
1998; ; 258 : :820.–830. 20.
Han
AP
,
Yu
C
,
Lu
L
, et al.
Heme-regulated eIF2alpha kinase (HRI) is required for translational regulation and survival of erythroid precursors in iron deficiency . EMBO J.
2001; ; 20 : :6909.–6918. 21.
Rafie-Kolpin
M
,
Han
AP
,
Chen
JJ
. Autophosphorylation of threonine 485 in the activation loop is essential for attaining eIF2alpha kinase activity of HRI . Biochemistry.
2003; ; 42 : :6536.–6544. 22.
Chen
JJ
. Regulation of protein synthesis by the heme-regulated eIF2alpha kinase: relevance to anemias . Blood.
2007; ; 109 : :2693.–2699. 23.
Han
AP
,
Fleming
MD
,
Chen
JJ
. Heme-regulated eIF2alpha kinase modifies the phenotypic severity of murine models of erythropoietic protoporphyria and beta-thalassemia . J Clin Invest.
2005; ; 115 : :1562.–1570. 24.
Lu
L
,
Han
V
,
Chen
JJ
. Translation initiation control by heme-regulated eukaryotic initiation factor 2alpha kinase in erythroid cells under cytoplasmic stresses . Mol Cell Biol.
2001; ; 21 : :7971.–7980. 25.
Chen
YC
,
Lin-Shiau
SY
,
Lin
JK
. Involvement of reactive oxygen species and caspase 3 activation in arsenite-induced apoptosis . J Cell Physiol.
1998; ; 177 : :324.–333. 26.
Harding
HP
,
Novoa
I
,
Zhang
Y
, et al.
Regulated translation initiation controls stress-induced gene expression in mammalian cells . Mol Cell.
2000; ; 6 : :1099.–1108. 27.
Jiang
HY
,
Wek
SA
,
McGrath
BC
, et al.
Activating transcription factor 3 is integral to the eukaryotic initiation factor 2 kinase stress response . Mol Cell Biol.
2004; ; 24 : :1365.–1377. 28.
Baird
TD
,
Wek
RC
. Eukaryotic initiation factor 2 phosphorylation and translational control in metabolism . Adv Nutr.
2012; ; 3 : :307.–321. 29.
Chen
JJ
. Translational control by heme-regulated eIF2alpha kinase during erythropoiesis . Curr Opin Hematol.
2014; ; 21 : :172.–178. 30.
Harding
HP
,
Wek
SA
,
McGrath
BC
, et al.
An integrated stress response regulates amino acid metabolism and resistance to oxidative stress . Mol Cell.
2003; ; 11 : :619.–633. 31.
He
CH
,
Yan
X
,
Zhang
H
, et al.
Identification of activating transcription factor 4 (ATF4) as an Nrf2-interacting protein. Implication for heme oxygenase-1 gene regulation . J Biol Chem.
2001; ; 276 : :20858.–20865. 32.
Suragani
RN
,
Zachariah
RS
,
Velazquez
JG
, et al.
Heme-regulated eIF2alpha kinase activated Atf4 signaling pathway in oxidative stress and erythropoiesis . Blood.
2012; ; 119 : :5276.–5284. 33.
Igarashi
K
,
Sun
J
. The heme-Bach1 pathway in the regulation of oxidative stress response and erythroid differentiation . Antioxid Redox Signal.
2006; ; 8 : :107.–118. 34.
Ghisolfi
L
,
Dutt
S
,
McConkey
ME
, et al.
Stress granules contribute to alpha-globin homeostasis in differentiating erythroid cells . Biochem Biophys Res Commun.
2012; ; 420 : :768.–774. 35.
Uma
S
,
Hartson
SD
,
Chen
JJ
,
Matts
RL
. Hsp90 is obligatory for the heme-regulated eIF-2alpha kinase to acquire and maintain an activable conformation . J Biol Chem.
1997; ; 272 : :11648.–11656. 36.
Uma
S
,
Thulasiraman
V
,
Matts
RL
. Dual role for Hsc70 in the biogenesis and regulation of the heme-regulated kinase of the alpha subunit of eukaryotic translation initiation factor 2 . Mol Cell Biol.
1999; ; 19 : :5861.–5871. 37.
Kim
SH
,
Gunnery
S
,
Choe
JK
,
Mathews
MB
. Neoplastic progression in melanoma and colon cancer is associated with increased expression and activity of the interferon-inducible protein kinase, PKR . Oncogene.
2002; ; 21 : :8741.–8748. 38.
Pataer
A
,
Swisher
SG
,
Roth
JA
, et al.
Inhibition of RNA-dependent protein kinase (PKR) leads to cancer cell death and increases chemosensitivity . Cancer Biol Ther.
2009; ; 8 : :245.–252. 39.
Yang
YL
,
Reis
LF
,
Pavlovic
J
, et al.
Deficient signaling in mice devoid of double-stranded RNA-dependent protein kinase . EMBO J.
1995; ; 14 : :6095.–6106. 40.
Bobrovnikova-Marjon
E
,
Grigoriadou
C
,
Pytel
D
, et al.
PERK promotes cancer cell proliferation and tumor growth by limiting oxidative DNA damage . Oncogene.
2010; ; 29 : :3881.–3895. 41.
Atkins
C
,
Liu
Q
,
Minthorn
E
, et al.
Characterization of a novel PERK kinase inhibitor with antitumor and antiangiogenic activity . Cancer Res.
2013; ; 73 : :1993.–2002. 42.
Wang
Y
,
Ning
Y
,
Alam
GN
, et al.
Amino acid deprivation promotes tumor angiogenesis through the GCN2/ATF4 pathway . Neoplasia.
2013; ; 15 : :989.–997. 43.
Rosen
MD
,
Woods
CR
,
Goldberg
SD
, et al.
Discovery of the first known small-molecule inhibitors of heme-regulated eukaryotic initiation factor 2alpha (HRI) kinase . Bioorg Med Chem Lett.
2009; ; 19 : :6548.–6551. 44.
Ill-Raga
G
,
Köhler
C
,
Radiske
A
, et al.
Consolidation of object recognition memory requires HRI kinase-dependent phosphorylation of eIF2alpha in the hippocampus . Hippocampus.
2013; ; 23 : :431.–436. 45.
Chen
T
,
Ozel
D
,
Qiao
Y
, et al.
Chemical genetics identify eIF2alpha kinase heme-regulated inhibitor as an anticancer target . Nat Chem Biol.
2011; ; 7 : :610.–616. 46.
Rosenwald
IB
,
Koifman
L
,
Savas
L
, et al.
Expression of the translation initiation factors eIF-4E and eIF-2 is frequently increased in neoplastic cells of Hodgkin lymphoma . Hum Pathol.
2008; ; 39 : :910.–916. 47.
Jiang
HY
,
Wek
RC
. Phosphorylation of the alpha-subunit of the eukaryotic initiation factor-2 (eIF2alpha) reduces protein synthesis and enhances apoptosis in response to proteasome inhibition . J Biol Chem.
2005; ; 280 : :14189.–14202. 48.
Donze
O
,
Deng
J
,
Curran
J
, et al.
The protein kinase PKR: a molecular clock that sequentially activates survival and death programs . EMBO J.
2004; ; 23 : :564.–571. 49.
Takahashi
M
,
Higuchi
M
,
Matsuki
H
, et al.
Stress granules inhibit apoptosis by reducing reactive oxygen species production . Mol Cell Biol.
2013; ; 33 : :815.–829. | ||||||