| |
| Med Sci (Paris). 2014 June; 30(6-7): 705–708. Published online 2014 July 11. doi: 10.1051/medsci/20143006026.Division symétrique ou division asymétrique : Sonic Hedgehog contrôle le destin des cellules souches neurales adultes Julien Ferent,1 Martial Ruat,1 and Elisabeth Traiffort1* 1Laboratoire de neurobiologie et développement-CNRS, transduction du signal et neuropharmacologie développementale, Institut de neurobiologie Alfred Fessard, 91198Gif-sur-Yvette, France MeSH keywords: Adulte, Cellules souches adultes, physiologie, Animaux, Division cellulaire asymétrique, Division cellulaire, Prolifération cellulaire, Protéines Hedgehog, Humains, Cellules souches neurales, Récepteurs patched, Récepteurs de surface cellulaire |
La genèse de nouveaux neurones - ou neurogenèse - a longtemps été considérée comme un processus se limitant à la vie embryonnaire ou périnatale chez les mammifères. Cependant, au début des années 1990, le concept de neurogenèse adulte fut définitivement admis [
1]. Il repose sur l’existence de cellules souches neurales (CSN) localisées dans un microenvironnement spécialisé ou « niche » qui fournit les signaux nécessaires au maintien et à la régulation de la prolifération et de la différenciation de ces cellules. La zone sous-ventriculaire (ZSV) des ventricules latéraux est la niche neurogénique la plus active du cerveau adulte. Dans cette région naissent notamment de nouveaux précurseurs neuronaux ou neuroblastes qui, doués de propriétés migratoires uniques, deviennent matures et s’intègrent à distance de leur lieu de production dans une région située à l’extrémité rostrale du cerveau antérieur, les bulbes olfactifs (Figure 1A) [
2,
3].
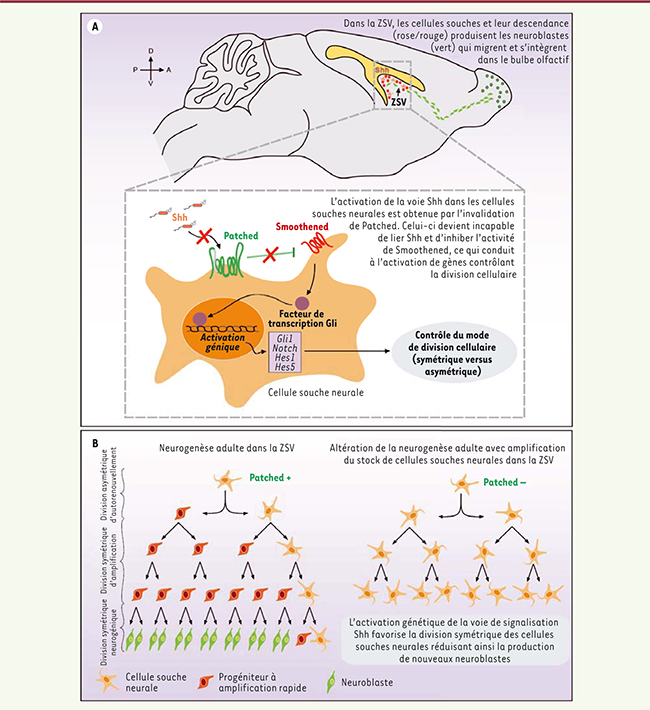
 | Figure 1.
La signalisation Shh contrôle l’autorenouvellement des cellules souches neurales adultes en augmentant leurs divisions symétriques. A. Schéma decrivant la principale aire neurogénique du cerveau adulte, la zone sous-ventriculaire (ZSV) des ventricules latéraux, où l’activationde la signalisation Shh a été induite via une approche génétique. B. Descendance des cellules souches neurales (CSN) adultes de la ZSV en présence (Patched+) et en l’absence (Patched-) du suppresseur de tumeurs Patched. |
|
Les cellules souches du cerveau adulte, des cellules capables de s’autorenouveler Les CSN, des cellules de type astrocytaire, participent à l’homéostasie cérébrale. Celle-ci nécessite une adaptation permanente du cerveau aux stimulus de l’environnement, en particulier ceux liés à l’apprentissage, à l’activité physique, au stress ou au vieillissement. Les CSN sont également essentielles au processus de régénération du tissu cérébral. Dans ce cas, elles accroissent leur capacité à produire de nouveaux précurseurs neuraux qui sont alors capables de migrer en direction de la lésion [
4]. Lorsqu’elle se divise, une CSN donne naissance soit à deux CSN (on parle de division symétrique), soit à une CSN et à un progéniteur dit « transitoire à amplification rapide » qui acquiert progressivement une capacité de différenciation (on parle de division asymétrique). Le processus par lequel une cellule souche se divise de manière symétrique ou asymétrique en donnant naissance à une ou deux cellules filles possédant une capacité de développement comparable à celle de la cellule mère porte le nom d’autorenouvellement [
5]. L’équilibre dynamique entre la production de CSN et de progéniteurs est donc essentiel pour maintenir constant le compartiment des cellules souches, assurer une neurogenèse active, mais aussi restaurer efficacement la réserve de cellules souches à l’issue d’un processus lésionnel. |
Sonic Hedgehog contrôle le devenir des CSN La voie de signalisation induite par la protéine sécrétée Sonic Hedgehog (Shh) est essentielle à la régulation de différents processus au cours du développement du système nerveux embryonnaire et postnatal [
6]. Les CSN sont capables de répondre aux signaux Shh in vivo [
7]. Les stratégies de perte de fonctions telles que l’invalidation de Shh, son blocage fonctionnel ou l’invalidation de son principal médiateur positif, le récepteur apparenté aux récepteurs couplés aux protéines G, Smoothened, conduisent toutes à un défaut de neurogenèse adulte (pour revue [
8]). À l’inverse, les conséquences de l’activation intrinsèque de la signalisation Shh n’avaient pas encore été explorées jusque là. C’est pourquoi nous venons d’invalider in vivo dans les CSN adultes la protéine membranaire Patched, suppresseur de tumeurs et récepteur de Shh [
9]. En l’absence de Shh, Patched réprime l’activité de Smoothened, l’élément clé de la transmission du signal Shh et une cible thérapeutique potentielle [
10,
11]. Si Patched n’est plus fonctionnel, la répression qu’il exerce normalement sur Smoothened est levée, ce qui conduit à l’activation endogène de la voie et à l’induction de la transcription du gène cible Gli1 dont le niveau d’expression reflète l’activité de la voie (Figure 1A). Pour invalider Patched, nous avons choisi une approche utilisant une lignée de souris génétiquement modifiées porteuses du système de recombinaison Cre-Lox. Chez ces animaux, deux modifications génétiques ont été introduites. D’une part, la recombinase Cre (construction couplée à ER, le récepteur muté des œstrogènes inductible par le tamoxifène) est placée sous le contrôle du promoteur du gène Glast codant pour un transporteur du glutamate spécifiquement exprimé dans une population d’astrocytes à laquelle appartiennent les CSN [
12]. D’autre part, deux courtes séquences nucléotidiques appelées séquences Lox ont été introduites de part et d’autre de deux exons du gène Patched [
13]. Lorsque ces souris sont traitées pendant quelques jours par le tamoxifène, une molécule capable d’activer la recombinase Cre, celle-ci va éliminer les exons encadrés par les séquences Lox, ce qui aboutit à la production d’un récepteur Patched inactif dans les CSN et leur descendance. L’analyse détaillée du phénotype des souris mutantes pour Patched indique qu’il existe chez ces animaux une augmentation du compartiment des CSN, associée à un épuisement des progéniteurs transitoires à prolifération rapide qui représentent leur descendance directe, et des neuroblastes migrants qui en dérivent. Ce phénotype peut être expliqué par le fait que l’activation endogène de la voie de signalisation Shh fait vraisemblablement basculer la division des CSN du mode asymétrique vers le mode symétrique (Figure 1B). L’invalidation de Patched s’accompagne également d’une augmentation de l’expression des composantes de la voie de signalisation Notch, notamment celle des facteurs de transcription Hes1 et Hes5, dont la capacité de blocage du processus de différenciation neuronale a précédemment été montrée [
14]. |
En quoi le rôle de Patched dans l’autorenouvellement des CSN est-il important ? Dès sa découverte, Patched a été caractérisé comme un gène suppresseur de tumeurs, puisque des souris chez lesquelles l’un des allèles de Patched est invalidé développent des tumeurs du cervelet ou médulloblastomes. Ces tumeurs sont aussi présentes chez des patients porteurs de mutations inactivatrices de Patched caractéristiques du syndrome de Gorlin, un désordre autosomique dominant associant une prédisposition à l’apparition d’anomalies du développement et de tumeurs [
15]. De façon inattendue, nos résultats montrent que la délétion de Patched dans les CSN adultes n’induit pas la formation de tumeurs chez les animaux étudiés, y compris un an après l’invalidation du gène. Nous mettons ainsi en évidence une différence majeure du mécanisme de réponse des CSN et de leur descendance à une anomalie génétique conduisant à l’inactivation d’un suppresseur de tumeurs. Dans le cervelet postnatal précoce, le médulloblastome se développe quel que soit le type cellulaire (la CSN ou sa descendance) dans lequel Patched est invalidé [6,
16]. Les CSN sont le lieu d’initiation de la tumeur, alors que ce sont les progéniteurs des neurones granulaires qui en dérivent qui sont à l’origine du processus tumorigénique, en proliférant de façon anormalement élevée en réponse à la signalisation Shh [
17]. Dans la ZSV adulte, ni les progéniteurs transitoires à prolifération rapide, ni les neuroblastes ne prolifèrent en réponse à la délétion de Patched. Bien au contraire, leur production est progressivement réduite par le changement du mode de division des CSN. Ces données améliorent notre compréhension des mécanismes par lesquels les aires neurogéniques sont capables de maintenir un contrôle étroit de la prolifération des CSN et/ou de leur descendance dans un contexte tumorigénique. Bien que l’expression ectopique du facteur de transcription Gli1 ait été associée à la prolifération et à la transformation de nombreux types cellulaires, nous montrons qu’elle peut être interprétée différemment dans le contexte de l’autorenouvellement des CSN adultes. Alors que la ZSV a été proposée comme l’origine potentielle des glioblastomes - des tumeurs cérébrales parmi les plus létales chez l’adulte - nos résultats révèlent la mise en place probable d’un mécanisme de défense du tissu cérébral dans un contexte favorable à la formation de tumeurs [
18]. Enfin, nous ne pouvons conclure sans évoquer l’importance de ces données dans des domaines autres que la cancérologie, en particulier celui des maladies neurodégénératives ou encore du vieillissement. Stimuler la capacité endogène du tissu cérébral à se réparer, et comprendre le mécanisme du déclin progressif de la capacité des CSN à s’autorenouveler avec l’âge restent des enjeux majeurs des neurosciences et de la médecine des années à venir. Si les antagonistes de synthèse du récepteur Smoothened sont déjà en clinique pour le traitement de carcinomes basocellulaires et de médulloblastomes liés à l’inactivation de Patched, il conviendra d’étudier l’intérêt de diverses classes d’agonistes de ce même récepteur vis-à-vis du renouvellement des CSN [10]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Lois
C
,
Alvarez-Buylla
A
. Long-distance neuronal migration in the adult mammalian brain . Science.
1994; ; 264 : :1145.–1148. 2.
Mouret
A
,
Lledo
PM
,
Coulombel
L
. La zone sous-ventriculaire du cerveau adulte. Une mosaïque de cellules souches pré-destinées . Med Sci (Paris).
2008; ; 24 : :9.–11. 3.
Spassky
N
.
Caillé
I
. La niche neurogénique adulte entre dans la troisième dimension.
Med Sci (Paris).
2009; ; 25 : :17.–18. 4.
Arvidsson
A
,
Collin
T
,
Kokaia
D
,
Kirik
Z
, et al.
Neuronal replacement from endogenous precursors in the adult brain after stroke . Nat Med.
2002; ; 8 : :963.–970. 5.
Costa
MR
,
Ortega
F
,
Brill
MS
,
Beckervordersandforth
R
, et al.
Continuous live imaging of adult neural stem cell division and lineage progression in vitro
. Development.
2011; ; 138 : :1057.–1068. 6.
Ruat
M
,
Angot
E
,
Taiffort
E
. Sonic Hedgehog, un morphogène en quête de fonction dans le cerveau adulte . Med Sci (Paris).
2011; ; 27 : :979.–985. 7.
Ahn
S
,
Joyner
AL
. In vivo analysis of quiescent adult neural stem cells responding to Sonic hedgehog . Nature.
2005; ; 437 : :894.–897. 8.
Ferent
J
,
Traiffort
E
. Hedgehog: multiple paths for multiple roles in shaping the brain and spinal cord . Neuroscientist.
2014 ; 8 mai (sous presse).
9.
Ferent
J
,
Cochard
L
,
Faure
H
, et al.
Genetic activation of Hedgehog signalling unbalances the rate of neural stem cell renewal by increasing symmetric divisions . Stem Cell Reports.
2014 (sous presse). 10.
Ruat
M
,
Hoch
L
,
Faure
H
,
Rognan
D
. Targeting of Smoothened for therapeutic gain . Trends Pharmacol Sci.
2014; ; 35: (5) : :237.–246. 11.
Ruat
M
,
Hoch
L
,
Faure
H
,
Rognan
D
. Structure du récepteur Smoothened . Med Sci (Paris).
2013; ; 29 : :855.–860. 12.
Mori
T
,
Tanaka
K
,
Buffo
A
,
Wurst
W
, et al.
Inducible gene deletion in astroglia and radial glia-a valuable tool for functional and lineage analysis . Glia.
2006; ; 54 : :21.–34. 13.
Uhmann
A
,
Dittmann
K
,
Nitzki
F
,
Dressel
R
, et al.
The Hedgehog receptor Patched controls lymphoid lineage commitment . Blood.
2007; ; 110 : :1814.–1823. 14.
Imayoshi
I
,
Shimojo
H
,
Sakamoto
M
,
Ohtsuka
T
, et al.
Genetic visualization of Notch signaling in mammalian neurogenesis . Cell Mol Life Sci.
2013; ; 70 : :2045.–2057. 15.
Goodrich
LV
,
Milenkovic
L
,
Higgins
KM
,
Scott
MP
. Altered neural cell fates and medulloblastoma in mouse patched mutants . Science.
1997; ; 277 : :1109.–1113. 16.
Bourdeaut
F
,
Pouponnot
C
. Ayrault O . Les médulloblastomes et leurs cellules d’origine Med Sci (Paris).
2012; ; 28 : :805.–809. 17.
Yang
ZJ
,
Ellis
T
,
Markant
SL
,
Read
TA
, et al.
Medulloblastoma can be initiated by deletion of Patched in lineage-restricted progenitors or stem cells . Cancer Cell.
2008; ; 14 : :135.–145. 18.
Goffart
N
,
Kroonen
J
,
Rogister
B
. Glioblastoma-initiating cells: relationship with neural stem cells and the micro-environment . Cancer.
2013; ; 5 ::1049.–1071. |