| |
| Med Sci (Paris). 2014 June; 30(6-7): 644–650. Published online 2014 July 11. doi: 10.1051/medsci/20143006014.L’implantation embryonnaire Importance de la famille de l’interleukine 1 Amélie Bourdiec1 and Ali Akoum1* 1Endocrinologie de la reproduction, centre de recherche hôpital Saint-François d’Assise, centre hospitalier universitaire de Québec, faculté de médecine, université Laval, Québec, Canada |
Au cours de chaque cycle menstruel, l’endomètre se prépare à offrir une réceptivité optimale à un embryon, indépendamment de la présence de celui-ci. Cette période, appelée « fenêtre d’implantation », est restreinte aux jours 20 à 24 d’un cycle menstruel normal [
1]. À cette période, sous l’effet de la progestérone et de l’AMP cyclique, les cellules stromales de l’endomètre se décidualisent1 progressivement et acquièrent des propriétés très spécifiques : réguler l’invasion trophoblastique, résister aux agressions du stress oxydatif et développer un environnement de tolérance immunitaire. En effet, concomitante à la décidualisation, l’arrivée massive des cellules de l’immunité participe à la création d’un environnement immunitaire favorable à l’accueil d’un embryon compétent [
2,
3]. La fenêtre d’implantation est également associée à une réaction vasculaire locale nécessaire à la croissance d’un futur embryon [
4]. En parallèle de la préparation endométriale, une transition immunologique de type Th1 vers un type Th2 dans la réponse immunitaire locale est nécessaire pour la réussite de l’implantation embryonnaire [
5]. Lors de la fécondation, le liquide séminal déclenche une réaction inflammatoire classique (de type Th1) afin d’éliminer les cellules mortes et les spermatozoïdes persistant 24 h après le coït. Cette réponse fait intervenir des cellules particulières de l’immunité innée (natural killer [NK] utérines (uNK) spécifiques de la décidue, cellules macrophagiques et dendritiques et cellules T régulatrices [Treg]), alors que les cellules de l’immunité à médiation humorale (lymphocytes B) semblent fuir l’endomètre [5,
6]. Une réaction anti-inflammatoire de type Th2 s’installe ensuite, qui permet de créer un équilibre Th1/Th2 à l’origine de la tolérance fœto-maternelle et de l’immunotrophisme2, favorisant l’invasion de l’endomètre par les cellules trophoblastiques de l’embryon. A contrario, un défaut de sécrétion de cytokines de type Th2, comme un excès de celles de type Th1, entraînent l’échec de l’implantation embryonnaire. Il a été rapporté que l’implantation embryonnaire dépend de l’expression coordonnée de nombreux facteurs, incluant des chimiokines, des métalloprotéases (MMP), des molécules d’adhésion, des facteurs de croissance et des cytokines pro-inflammatoires. L’ensemble de ces médiateurs cellulaires et moléculaires permettent et régulent les stades d’apposition, d’adhésion et d’invasion des cellules trophoblastiques dans l’endomètre [
7], prélude à un dialogue précoce et continu avec l’embryon. Parmi toutes ces molécules, une famille de cytokines, celle de l’interleukine (IL) 1, a retenu notre attention. |
La famille de l’interleukine 1 au cœur de l’interface embryo-maternelle Brève présentation de la famille de l’interleukine 1 La famille de l’IL1 ne cesse de s’agrandir. Aujourd’hui, elle se compose de sept ligands qui possèdent une activité agoniste (les deux isoformes IL1α 3 et IL1β, l’IL18, l’IL33, et les trois isoformes de l’IL36, α, β et γ), de trois molécules antagonistes naturelles (IL1Ra [ IL1 receptor antagonist], IL36Ra et IL38 [identifiée récemment, elle a une action proche de l’IL36Ra puisqu’elle se fixe sur le récepteur de l’IL36 et inhibe son action, en particulier la réponse Th17]), de quatre récepteurs fonctionnels (IL1R1, IL18R1, ST2 [ IL1 receptor-like 1] et IL36R), de deux protéines accessoires (IL1RAcP [ IL1R accessory protein] et IL18RAcP), de deux récepteurs leurres (IL1R2 et IL18BP [ IL18 binding protein]) et de deux régulateurs négatifs (SIGIRR [ single immunoglobulin IL1R-related molecule ou TIR8] et IL1RAcPb). Ces membres sont classés aujourd’hui en six groupes ligand/récepteur pour les cytokines IL1, IL18, IL33, IL36, IL37 et IL38 [
8–
10]. Seuls les systèmes IL1, IL18 et IL33 interviendraient dans le contexte de l’implantation embryonnaire. Dans chacun de ces systèmes, certains membres ont un rôle agoniste et d’autres un rôle antagoniste, et réalisant un système tampon finement régulé (Figure 1). Nous rappellerons brièvement les protagonistes des trois systèmes qui interviennent lors du dialogue précoce entre l’endomètre maternel et l’embryon.
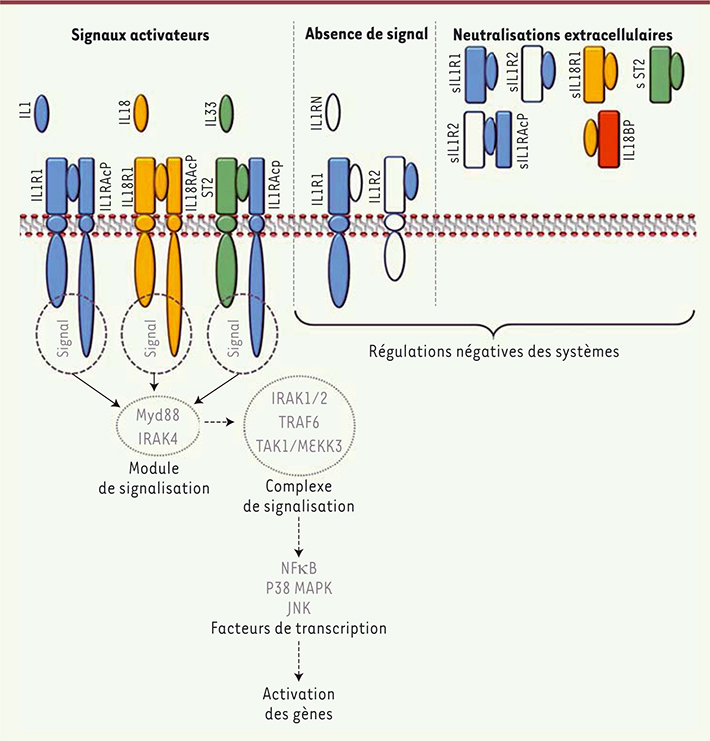
 | Figure 1.
Stratégies d’activation et d’inhibition des systèmes IL1, IL18 et IL33. Représentation schématique des mécanismes d’activation et de régulation négative des systèmes IL1, IL18, et IL33. La formation d’un complexe de corécepteur après liaison du ligand permet l’activation de voies de signalisation intracellulaire. Une fois assemblée à la membrane, la partie intracellulaire du complexe recrute rapidement deux protéines de signalisation, Myd88 (myeloid differentiation primary response gene 88) et IRAK4 (IL1 receptor-associated kinase 4). Ce premier module de signalisation phosphoryle ensuite IRAK1 et IRAK2. Ceci est suivi par le recrutement et l’oligomérisation de TRAF6 (tumor necrosis factor [TNF] receptor-associated factor 6) et la formation subséquente des complexes de signalisation TAK1 (transforming growth factor-β-activated kinase 1) et MEKK3 (mitogen-activated protein kinase kinase kinase 3) qui activent les facteurs de transcriptions NF-κB, JNK (c-Jun N-terminal kinase) et p38 MAPK. La translocation nucléaire de NF-κB permet sa liaison à un motif d’ADN conservé que l’on retrouve dans de nombreux gènes cibles de l’IL1. La formation des complexes de récepteurs à la membrane peut être neutralisée de différentes manières, soit par le blocage du signal (antagonisme ou récepteurs leurres), soit par la neutralisation extracellulaire des ligands. |
L’IL1 se présente sous deux formes : la forme α, qui est principalement intracellulaire, et la forme β, qui est sécrétée3. L’IL1 se fixe au récepteur membranaire IL1R1 : le recrutement d’un corécepteur appelé IL1R3 (ou interleukin 1 receptor accessory protein [IL1RAcP]) est nécessaire à la transmission du signal. Ce complexe de signalisation peut être neutralisé de différentes manières : soit par une compétition directe entre l’antagoniste IL1Ra et l’IL1 pour la liaison sur le récepteur IL1R1, soit par une diminution de la biodisponibilité de l’IL1 captée par un récepteur leurre (IL1R2) ou par des récepteurs solubles (sIL1R1, sIL1R2 et sIL1RAcP). Dans le cas de l’IL18, qui forme un complexe avec le récepteur IL18R1 et le corécepteur IL18RAcP pour transmettre un signal, la biodisponibilité de la cytokine est régulée par l’IL18BP et la forme soluble de l’IL18R1. Enfin, l’IL33, découverte en 2005, se lie au récepteur ST2, et la transmission du signal fait également intervenir le corécepteur IL1RAcP. Le seul inhibiteur connu de ce système est la forme soluble du récepteur ST2 (sST2). La famille de l’interleukine 1 et l’implantation embryonnaire Place de l’interleukine 1 Les différents membres de la famille IL1 sont présents à diverses étapes de l’implantation embryonnaire. L’IL1, ainsi que l’IL18 et l’IL18BP, sont exprimées par les cellules de l’endomètre au cours du cycle menstruel [
11]. Néanmoins, lors de la fenêtre d’implantation, l’expression de l’IL1 se renforce, tout comme celle de son récepteur IL1R1, alors que celle du récepteur leurre IL1R2 diminue [
12,
13]. Outre ses propriétés dans la réponse immune, l’IL1 est aussi impliquée dans de nombreux processus physiologiques, dont l’angiogenèse et le remodelage tissulaire [
14]. Cette cytokine induit l’expression de nombreuses molécules clés de la préparation de l’endomètre à l’implantation embryonnaire : l’IL6, l’IL8, LIF ( leukemia inhibitory factor), COX2 ( cyclooxygenase 2), l’intégrine α Vβ 3, et la chimiokine MCP1 ( monocyte chimoattractant protein 1)/CCL2 [
15,
16]. Il a été démontré que l’IL1 était à l’origine de la vasodilatation locale des artères spiralées via l’induction de la prolifération des cellules endothéliales, et la production de VEGF ( vascular endothelial growth factor), de NO ( nitric oxide) et de PGE2 ( prostaglandin E2) par les cellules de l’endomètre [
17]. Cette vasodilatation est primordiale pour l’invasion du compartiment vasculaire maternel par les cellules de l’embryon. En outre, la réaction inflammatoire secondaire à la présence de sperme augmente fortement le taux utérin d’IL1, ce qui a pour effet d’activer la sécrétion d’interféron γ (INFγ) par les cellules uNK [
18]. L’adhérence de l’embryon à l’endomètre requiert une réaction de type pro-inflammatoire. Cette réaction de type Th1 active une cascade moléculaire déclenchée par l’IL1, et favorise l’apposition et l’adhérence de l’embryon aux cellules épithéliales de l’endomètre, ainsi que la vasodilatation des artères spiralées 4 sous l’influence de l’INFγ. Parallèlement à cette réponse inflammatoire en réaction à la présence de sperme, les cellules de l’endomètre accroissent leur expression de récepteurs leurres et d’antagonistes des agonistes du système IL1. Cette réaction anti-inflammatoire est, en partie, contrôlée par l’action de faibles doses d’hormones chorioniques gonadotropes (hCG) synthétisées très précocement lors de la grossesse [
19]. Place de l’interleukine 18 L’IL18 occupe également une place majeure dans la préparation de l’endomètre à l’implantation de l’embryon. En effet, cette cytokine, dont l’action peut être soit de type Th2 (à dose physiologique), soit de type Th1 (concentration en excès), est principalement sécrétée par les uNK et localement proche des artères spiralées. Sa présence et son action sont étroitement liées à la régulation de la vasculature de l’endomètre péri-implantatoire. Ainsi, l’IL18 joue un rôle physiologique essentiel dans la déstabilisation des artères spiralées, mais elle est aussi un facteur pro-angiogénique direct et indirect via la stimulation de facteurs favorables à l’angiogenèse [
20]. L’IL18 favorise aussi la production d’IFNγ par les cellules uNK [
21]. Lors de la réaction anti-inflammatoire secondaire à la réaction inflammatoire postfécondation (évoquée ci-dessus), les cellules uNK vont exhiber des marqueurs de réponse immunitaire de type Th2, tels que le récepteur ST2 et devenir une source majeure de cytokines anti-inflammatoires (LIF, IL4, IL6 et IL18). L’immunotrophisme Lors d’une grossesse normale, ces cytokines vont permettre et contrôler l’invasion de l’endomètre décidualisé par l’embryon, c’est l’immunotrophisme (voir note 1) [
22]. La source majeure d’IL1B est l’embryon, ce qui permet de considérer localement cette cytokine comme un signal embryonnaire précoce. Au moment de l’implantation, l’IL1 d’origine embryonnaire interagit avec ses récepteurs localisés à la surface des différentes cellules maternelles de l’endomètre. Cette interaction aura pour effet, entre autres, d’augmenter l’expression d’intégrines spécifiques (nécessaires à l’adhérence de l’embryon), et de permettre l’invasion des cellules de l’embryon dans la décidue et les artères spiralées via la production de métalloprotéases [ 19,
23,
24]. De nombreux rapports font état du rôle primordial de l’IL1 et des autres molécules de cette famille dans la réceptivité maternelle et l’implantation embryonnaire. Dans le cadre d’une fécondation in vitro, une concentration importante d’IL1β embryonnaire est corrélée avec le succès de l’implantation de l’embryon après son transfert dans la cavité utérine [
25]. D’autres observations montrent une relation entre des avortements spontanés et une diminution de l’IL1β et de l’IL6 [
26]. En outre, l’IL18 produite en excès favorise un déséquilibre pro-Th1 susceptible d’entraîner une activation immunitaire délétère, notamment via les cellules uNK qui se transforment en LAK ( lymphokine-activated killer cell), mais également via les cellules dendritiques et les cellules Th17. Un déséquilibre en faveur d’une dominance Th1/Th17 est délétère pour la grossesse et peut s’accompagner de prééclampsie, d’accouchement prématuré ou d’avortement spontané [
27–
31]. Impact des polymorphismes des gènes codant pour des molécules de la famille de l’interleukine 1 Des études génotypiques suggèrent l’existence d’une certaine relation entre des polymorphismes du système IL1 et la qualité de la gestation. Ainsi, les deux polymorphismes maternels IL1B-511C>T et IL1B-31T>C semblent être associés à une augmentation du taux de fausses couches récurrentes [
32]. L’allèle 1 du gène codant pour l’IL1Ra, IL1RN (IL1RN*1), semble être lié à un taux accru d’avortements spontanés [
33], et l’allèle 2 (IL1RN*2) à une faible proportion de grossesses après fécondation in vitro [
34]. Toutefois, il existe une certaine controverse quant au rôle de l’allèle IL1RN*2 : si certaines études observent sa fréquence accrue (x 3) chez les femmes ayant des avortements spontanées à répétition [
35], pour d’autres, il ne représente pas un facteur de risque [
37] ; certains suggèrent qu’il augmente le risque de naissance prématurée [
36]. Les polymorphismes du promoteur du gène codant pour l’IL18 ne semblent pas être associés à des avortements spontanés récurrents [
38]. Quant à l’impact du polymorphisme du gène codant pour l’IL33 sur l’implantation embryonnaire, il demeure inconnu. L’apport des modèles animaux L’utilisation de modèles animaux a contribué à notre compréhension de l’implantation embryonnaire et de l’établissement de la grossesse. Ainsi, dans un modèle de primate non humain, l’infusion d’hCG et d’IL1β mime les changements caractéristiques qui interviennent lors d’une grossesse et conduit à l’immunotrophisme (voir note 2) [
39]. Dans un modèle murin, certaines expériences ont suggéré que l’injection du récepteur antagoniste de l’IL1, IL1Ra, réduisait considérablement le nombre d’embryons qui s’implantent en altérant la réceptivité de l’endomètre. Cependant, ces expériences n’ont jamais pu être reproduites [ 7, 23]. D’autre part, il n’y a pas d’altération majeure de la fertilité chez des souris dont les gènes codant pour les molécules IL1β, l’IL1α, l’IL18 ou IL1R1 ont été invalidés [
40,
41]. Cependant, nous savons aujourd’hui qu’un gène ne possède pas qu’une seule fonction et que les cytokines membres de la famille de l’IL-1 fonctionnent en réseau. On ne peut exclure également une certaine redondance entre celles-ci, ou des connexions compensatrices des voies de signalisation, ou encore un rôle de certaines formes intracellulaires d’IL1α et d’IL33 comme facteurs de transcription directement dans le noyau [ 10, 15, 16]. |
Ces dernières années, les analyses génomique et protéomique de l’endomètre de femmes fertiles, au moment des fenêtres d’implantation, ont révélé de grandes variations selon les études. L’expression de quelques gènes seulement est commune à ces études. Ces différences reflètent probablement les procédés expérimentaux variés ; de fait, aucun marqueur fiable de la réceptivité maternelle ne s’est imposé jusqu’à aujourd’hui [
42]. Cependant, le concept d’endomètre biosenseur de l’implantation embryonnaire émerge [
43]. De récentes publications démontrent l’existence d’une interaction étroite entre l’IL1β et l’hCG, deux signaux embryonnaires précoces qui sont capables de moduler le phénotype des cellules de l’endomètre. Lors de la fenêtre d’implantation, de faibles quantités d’hCG sont détectables, tant au niveau de l’épithélium utérin que dans le sang circulant de femmes en tout début de grossesse [
44–
46]. Des expériences in vitro ont montré que l’hCG et l’IL1 collaboraient pour augmenter la sensibilité des cellules de l’endomètre à l’IL1 et aux autres membres de la famille. En effet, l’hCG serait responsable d’un déséquilibre dans l’expression des membres de la famille IL1 : elle favoriserait l’augmentation des récepteurs fonctionnels tout en diminuant, de façon concomitante, l’expression des récepteurs leurres et antagonistes, et modèrerait l’expression de l’IL1, de l’IL18 et de l’IL33 [19,
47,
48]. Il en résulterait une amplification synergique de certaines cibles moléculaires pertinentes pour la poursuite de l’implantation, telles que MCP1, VEGFC, RANTES (regulated upon activation normal T cell expressed and presumably secreted), VCAM1 (vascular cell adhesion molecule 1) et IL6 [19, 47,
49]. Ces facteurs sont impliqués dans la régulation de la réponse immunitaire, l’induction d’une tolérance immunitaire, le contrôle de l’angiogenèse locale et de l’immunotrophisme (voir note 2). Il faut également préciser que la présence d’hCG à l’interface embryo-maternelle intervient directement dans l’équilibre Th1/Th2 et la sécrétion de cytokines Th2 [
50] qui contribuent à la tolérance immunitaire et à la création d’un environnement favorable à la croissance et au développement du fœtus [
51,
52]. Mais, au-delà de l’équilibre Th1/Th2 et de ses limites pour expliquer le succès ou l’échec de la grossesse, l’hCG joue également un rôle dans le recrutement des cellules Treg dont on sait maintenant qu’ils sont des acteurs clés de la tolérance immunitaire locale [
30, 52] et dont l’équilibre avec les cellules Th17 (effectrices pro-inflammatoires) semble être important pour l’établissement et le succès de la grossesse [
59] (→). Cependant, l’implication et l’impact de la synergie entre l’hCG et la famille de l’IL1 dans de tels équilibres demeurent inconnus. Il reste possible que de faibles quantités d’hCG puissent modifier les fonctions utérines de l’IL1 en agissant tant sur les récepteurs de la famille que sur la balance du réseau moléculaire endométrial contrôlé par l’IL1 (Figure 2). De ce fait, l’IL1 et son système de régulation représentent un intermédiaire moléculaire important, pouvant agir comme senseur de la réceptivité maternelle. L’IL18 endométriale pourrait peut-être exercer aussi cette fonction [
53].
(→) Voir m/s n° 10, octobre 2012, page 826
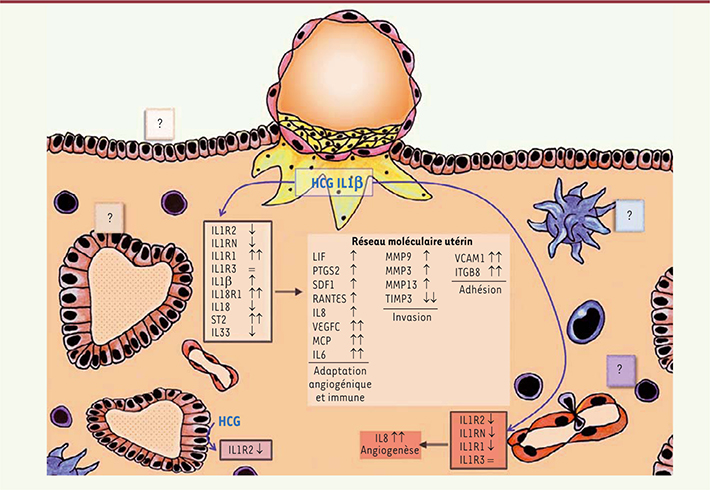
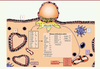 | Figure 2.
Remaniement de la sensibilité endométriale à l’IL1 et sa famille lors de l’implantation embryonnaire précoce. Représentation schématique de l’endomètre humain lors de l’implantation embryonnaire. Les cellules trophoblastiques (jaunes) envahissent le stroma (orange), et libèrent des concentrations croissantes d’hCG et d’IL1, deux signaux embryonnaires précoces. Ces signaux agissent sur les cellules résidentes de l’endomètre pendant la fenêtre d’implantation, telles que les cellules stromales et épithéliales (rouge). En réponse, l’équilibre du système IL1 des cellules stromales est rompu, ce qui permet la création d’un nouvel environnement moléculaire favorable à l’implantation embryonnaire. De plus, l’action de l’hCG et de l’IL1 s’étend à l’ensemble des membres de la famille IL1, pour augmenter l’expression des récepteurs fonctionnels de l’IL18 et de l’IL33. Les cellules endothéliales qui tapissent les vaisseaux sanguins de l’endomètre peuvent aussi réagir et augmenter leur sensibilité à l’IL1, ce qui se traduit par une augmentation de leurs propriétés angiogéniques, notamment via l’IL8. Il a été démontré que l’hCG diminuait également le récepteur IL1R2 des cellules épithéliales glandulaires, mais l’information complète sur la famille IL1 n’est pas encore définie. Symboles : ↓ diminution, ↓↓ diminution en synergie hCG/IL1, ↑ augmentation, ↑↑ augmentation en synergie hCG/IL1, = aucune variation. |
Des données cliniques récentes confirment l’importance de l’expression des membres de la famille de l’IL1 comme marqueur potentiel de la réceptivité maternelle lors de l’implantation embryonnaire. En effet, chez certaines patientes chez lesquelles des échecs d’implantation ont été observés, on a pu mettre en évidence un défaut dans la boucle IL18/IL15/uNK et une réaction inadéquate de l’endomètre, qui empêchent les phases d’apposition et d’adhérence de l’embryon [31]. À l’inverse, chez d’autres patientes ayant un historique de fausses couches à répétition, une activation et une cytotoxicité excessives des cellules uNK, ainsi qu’une augmentation d’IL18 aux conséquences abortives, ont été identifiées [
54]. D’autre part, une perturbation de l’équilibre du système IL33 est positivement corrélée à l’interruption de la grossesse et à un risque de prééclampsie [
55,
56]. Enfin, les études récentes de l’expression endométriale de l’IL33 et de son récepteur ont montré que l’interruption de l’équilibre sST2/IL33 lors de la décidualisation de l’endomètre prédispose au risque de fausse couche [
57,
58]. |
Cette revue met en évidence que la régulation des niveaux d’expression de certains membres de la famille de l’IL1, via des signaux majeurs et précoces tels que l’hCG, participe à la mise en place dans l’endomètre d’un phénotype réceptif à l’implantation et au développement de l’embryon. Cette régulation implique un équilibre précis des molécules de la famille de l’IL1, ainsi que l’intervention de plusieurs types cellulaires endométriaux (Figure 2). Ce nouvel environnement permet l’implantation embryonnaire. Puis, une régulation précise entre les effets agonistes et antagonistes de certains membres de la famille IL1, suggérée par des études in vitro, permet la bonne continuité de la grossesse. Un tel mécanisme s’avère crucial lors de l’implantation embryonnaire puisqu’un dérèglement semble être à l’origine d’un échec d’implantation lors des étapes d’apposition, d’adhésion ou d’invasion. Avec ces dernières avancées, l’importance de cette famille de cytokines est de mieux en mieux documentée. Les recherches futures devraient permettre de mieux comprendre les mécanismes sous-jacents à la réorganisation fine et évolutive du dialogue fœto-maternel, ainsi que son impact sur le développement embryonnaire dans un environnement utérin a priori hostile. De telles études devraient aussi permettre de mettre en lumière des marqueurs fiables de la réceptivité maternelle et des senseurs précoces de l’implantation embryonnaire. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nous remercions nos collaborateurs, le Pr C.V. Rao (Herbert Wertheim college of medicine, Florida international university, Miami, Florida, États-Unis), le Pr Rong Shao (Pioneer Valley life sciences institute, university of Massachusetts Amherst, Springfield, Massachusetts, États-Unis), le Dr E. Calvo (département de médecine moléculaire, centre de recherche du CHU de Québec, CHUL, Québec, Canada), les gynécologues du département d’obstétrique, gynécologie et reproduction du CHU de Québec, ainsi que les membres du laboratoire D. Bédard, V. Martel, N. Michaud, N. Bourcier et M. Al-Akoum. Nous remercions le CRSNG pour le financement accordé au Pr Ali Akoum, chercheur national du Fonds de la recherche du Québec-santé.
|
Footnotes |
1.
Achache
H
,
Revel
A
. Endometrial receptivity markers, the journey to successful embryo implantation . Hum Reprod Update.
2006; ; 12 : :731.–746. 2.
Gellersen
B
,
Brosens
IA
,
Brosens
JJ
. Decidualization of the human endometrium: mechanisms, functions, and clinical perspectives . Semin Reprod Med.
2007; ; 25 : :445.–453. 3.
Le Bouteiller
P
,
Tabiasco
J
. Immunologie de la grossesse : faits nouveaux . Med Sci (Paris).
2006; ; 22 : :745.–750. 4.
Ledee
N
,
Chaouat
G
,
Serazin
V
, et al.
Endometrial vascularity by three-dimensional power Doppler ultrasound and cytokines: a complementary approach to assess uterine receptivity . J Reprod Immunol.
2008; ; 77 : :57.–62. 5.
Chaouat
G
,
Ledee-Bataille
N
,
Dubanchet
S
, et al.
TH1/TH2 paradigm in pregnancy: paradigm lost? Cytokines in pregnancy/early abortion: reexamining the TH1/TH2 paradigm . Int Arch Allergy Immunol.
2004; ; 134 : :93.–119. 6.
Veenstra van Nieuwenhoven
AL
,
Heineman
MJ
,
Faas
MM
. The immunology of successful pregnancy . Hum Reprod Update.
2003; ; 9 : :347.–357. 7.
Guzeloglu-Kayisli
O
,
Kayisli
UA
,
Taylor
HS
. The role of growth factors and cytokines during implantation: endocrine and paracrine interactions . Semin Reprod Med.
2009; ; 27 : :62.–79. 8.
Garlanda
C
,
Dinarello
CA
,
Mantovani
A
. The interleukin-1 family: back to the future . Immunity.
2013; ; 39 : :1003.–1018. 9.
Dinarello
CA
,
Novick
D
,
Kim
S
,
Kaplanski
G.
,
Interleukin-18, IL-18 binding protein. Front Immunol
, ;
2013; ; 4 : :289.. 10.
Dinarello
CA
. Interleukin-1 in the pathogenesis and treatment of inflammatory diseases . Blood.
2011; ; 117 : :3720.–3732. 11.
Yoshino
O
,
Osuga
Y
,
Koga
K
, et al.
Evidence for the expression of interleukin (IL)-18, IL-18 receptor and IL-18 binding protein in the human endometrium . Mol Hum Reprod.
2001; ; 7 : :649.–654. 12.
Bigonnesse
F
,
Labelle
Y
,
Akoum
A
. Triphasic expression of interleukin-1 receptor type I in human endometrium throughout the menstrual cycle of fertile women and women with unexplained infertility . Fertil Steril.
2001; ; 75 : :79.–87. 13.
Boucher
A
,
Kharfi
A
,
Al-Akoum
M
, et al.
Cycle-dependent expression of interleukin-1 receptor type II in the human endometrium . Biol Reprod.
2001; ; 65 : :890.–898. 14.
Carmi
Y
,
Voronov
E
,
Dotan
S
, et al.
The role of macrophage-derived IL-1 in induction and maintenance of angiogenesis . J Immunol.
2009; ; 183 : :4705.–4714. 15.
Saccani
S
,
Pantano
S
,
Natoli
G
. p38-Dependent marking of inflammatory genes for increased NF-kappa B recruitment . Nat Immunol.
2002; ; 3 : :69.–75. 16.
Rossi
M
,
Sharkey
AM
,
Vigano
P
, et al.
Identification of genes regulated by interleukin-1beta in human endometrial stromal cells . Reproduction.
2005; ; 130 : :721.–729. 17.
Smith
SK
. Angiogenesis, vascular endothelial growth factor and the endometrium . Hum Reprod Update.
1998; ; 4 : :509.–519. 18.
Edwards
RG
. Physiological and molecular aspects of human implantation . Hum Reprod.
1995; ; 10
(Suppl 2) : :1.–13. 19.
Bourdiec
A
,
Shao
R
,
Rao
CV
,
Akoum
A.
, Human chorionic gonadotropin triggers angiogenesis via the modulation of endometrial stromal cell responsiveness to interleukin 1: a new possible mechanism underlying embryo implantation . Biol Reprod.
2012; ; 87 : :66.. 20.
Ledee-Bataille
N
,
Dubanchet
S
,
Coulomb-L’hermine
A
, et al.
A new role for natural killer cells, interleukin (IL)-12, and IL-18 in repeated implantation failure after in vitro fertilization . Fertil Steril.
2004; ; 81 : :59.–65. 21.
Croy
BA
,
Esadeg
S
,
Chantakru
S
, et al.
Update on pathways regulating the activation of uterine Natural Killer cells, their interactions with decidual spiral arteries and homing of their precursors to the uterus . J Reprod Immunol.
2003; ; 59 : :175.–191. 22.
Sargent
IL
,
Borzychowski
AM
,
Redman
CW
. NK cells and human pregnancy-an inflammatory view . Trends Immunol.
2006; ; 27 : :399.–404. 23.
Simon
C
,
Gimeno
MJ
,
Mercader
A
, et al.
Embryonic regulation of integrins beta 3, alpha 4, and alpha 1 in human endometrial epithelial cells in vitro
. J Clin Endocrinol Metab.
1997; ; 82 : :2607.–2616. 24.
Prutsch
N
,
Fock
V
,
Haslinger
P
, et al.
The role of interleukin-1beta in human trophoblast motility . Placenta.
2012; ; 33 : :696.–703. 25.
Sheth
KV
,
Roca
GL
,
al-Sedairy
ST
, et al.
Prediction of successful embryo implantation by measuring interleukin-1-alpha and immunosuppressive factor(s) in preimplantation embryo culture fluid . Fertil Steril.
1991; ; 55 : :952.–957. 26.
Von Wolff
M
,
Thaler
CJ
,
Strowitzki
T
, et al.
Regulated expression of cytokines in human endometrium throughout the menstrual cycle: dysregulation in habitual abortion . Mol Hum Reprod.
2000; ; 6 : :627.–634. 27.
Laresgoiti-Servitje
E
,
Gomez-Lopez
N
,
Olson
DM
. An immunological insight into the origins of pre-eclampsia . Hum Reprod Update.
2010; ; 16 : :510.–524. 28.
Lee
SK
,
Kim
JY
,
Lee
M
, et al.
Th17 and regulatory T cells in women with recurrent pregnancy loss . Am J Reprod Immunol.
2012; ; 67 : :311.–318. 29.
Zenclussen
AC
. Adaptive immune responses during pregnancy . Am J Reprod Immunol.
2013; ; 69 : :291.–303. 30.
Chaouat
G
. Inflammation, NK cells and implantation: friend and foe (the good, the bad and the ugly?): replacing placental viviparity in an evolutionary perspective . J Reprod Immunol.
2013; ; 97 : :2.–13. 31.
Ledee-Bataille
N
,
Bonnet-Chea
K
,
Hosny
G
, et al.
Role of the endometrial tripod interleukin-18, -15, and -12 in inadequate uterine receptivity in patients with a history of repeated in vitro fertilization-embryo transfer failure . Fertil Steril.
2005; ; 83 : :598.–605. 32.
Wang
ZC
,
Yunis
EJ
,
De los Santos
MJ
, et al.
T helper 1-type immunity to trophoblast antigens in women with a history of recurrent pregnancy loss is associated with polymorphism of the IL1B promoter region . Genes Immun.
2002; ; 3 : :38.–42. 33.
Perni
SC
,
Vardhana
S
,
Tuttle
SL
, et al.
Fetal interleukin-1 receptor antagonist gene polymorphism, intra-amniotic interleukin-1beta levels, and history of spontaneous abortion . Am J Obstet Gynecol.
2004; ; 191 : :1318.–1323. 34.
Gremlich
S
,
Fratta
S
,
Rebellato
E
, et al.
Interleukin-1 receptor antagonist gene (IL-1RN) polymorphism is a predictive factor of clinical pregnancy after IVF . Hum Reprod.
2008; ; 23 : :1200.–1206. 35.
Unfried
G
,
Tempfer
C
,
Schneeberger
C
, et al.
Interleukin 1 receptor antagonist polymorphism in women with idiopathic recurrent miscarriage . Fertil Steril.
2001; ; 75 : :683.–687. 36.
Chaves
JH
,
Babayan
A
,
Bezerra Cde
M
, et al.
Maternal and neonatal interleukin-1 receptor antagonist genotype and pregnancy outcome in a population with a high rate of pre-term birth . Am J Reprod Immunol.
2008; ; 60 : :312.–317. 37.
Levrant
S
,
Coulam
CB
,
Jeyendran
RS
. Interleukin 1 receptor antagonist gene polymorphisms are not risk factors for recurrent pregnancy loss: evaluation of couples . Am J Reprod Immunol.
2008; ; 60 : :224.–228. 38.
Ostojic
S
,
Volk
M
,
Medica
I
, et al.
Polymorphisms in the interleukin-12/18 genes and recurrent spontaneous abortion . Am J Reprod Immunol.
2007; ; 58 : :403.–408. 39.
Strakova
Z
,
Mavrogianis
P
,
Meng
X
, et al.
In vivo infusion of interleukin-1beta and chorionic gonadotropin induces endometrial changes that mimic early pregnancy events in the baboon . Endocrinology.
2005; ; 146 : :4097.–4104. 40.
Horai
R
,
Asano
M
,
Sudo
K
, et al.
Production of mice deficient in genes for interleukin (IL)-1alpha, IL-1beta, IL-1alpha/beta, and IL-1 receptor antagonist shows that IL-1beta is crucial in turpentine-induced fever development and glucocorticoid secretion . J Exp Med.
1998; ; 187 : :1463.–1475. 41.
Takeda
K
,
Tsutsui
H
,
Yoshimoto
T
, et al.
Defective NK cell activity and Th1 response in IL-18-deficient mice . Immunity.
1998; ; 8 : :383.–390. 42.
Wang
H
,
Dey
SK
. Roadmap to embryo implantation: clues from mouse models . Nat Rev Genet.
2006; ; 7 : :185.–199. 43.
Teklenburg
G
,
Salker
M
,
Heijnen
C
, et al.
The molecular basis of recurrent pregnancy loss: impaired natural embryo selection . Mol Hum Reprod.
2010; ; 16 : :886.–895. 44.
Zimmermann
G
,
Ackermann
W
,
Alexander
H.
, Expression production of human chorionic gonadotropin (hCG) in the normal secretory endometrium: evidence of CGB7 and/or CGB6 beta hCG subunit gene expression . Biol Reprod.
2012; ; 86 : :87.. 45.
Cole
LA.
, hCG, the wonder of today’s science . Reprod Biol Endocrinol.
2012; ; 10 : :24.. 46.
Perrier d’Hauterive
S
,
Charlet-Renard
C
,
Dubois
M
, et al.
Du nouveau à l’interface materno-fœtale : rôle du couple hCG/récepteur LH-hCG dans l’implantation embryonnaire . Rev Med Liege.
2006; ; 61 : :705.–712. 47.
Bourdiec
A
,
Bedard
D
,
Rao
CV
,
Akoum
A
. Human chorionic gonadotropin regulates endothelial cell responsiveness to interleukin 1 and amplifies the cytokine-mediated effect on cell proliferation, migration and the release of angiogenic factors . Am J Reprod Immunol.
2013; ; 70 : :127.–138. 48.
Herrmann-Lavoie
C
,
Rao
CV
,
Akoum
A
. Chorionic gonadotropin down-regulates the expression of the decoy inhibitory interleukin 1 receptor type II in human endometrial epithelial cells . Endocrinology.
2007; ; 148 : :5377.–5384. 49.
Bourdiec
A
,
Calvo
E
,
Rao
CV
,
Akoum
A.
, Transcriptome analysis reveals new insights into the modulation of endometrial stromal cell receptive phenotype by embryo-derived signals interleukin-1, human chorionic gonadotropin: possible involvement in early embryo implantation . PLoS One.
2013; ; 8 : :e64829.. 50.
Saito
S
,
Nakashima
A
,
Shima
T
,
Ito
M
. Th1/Th2/Th17 and regulatory T-cell paradigm in pregnancy . Am J Reprod Immunol.
2010; ; 63 : :601.–610. 51.
Lee
JY
,
Lee
M
,
Lee
SK
. Role of endometrial immune cells in implantation . Clin Exp Reprod Med.
2011; ; 38 : :119.–125. 52.
Tsampalas
M
,
Gridelet
V
,
Berndt
S
, et al.
Human chorionic gonadotropin: a hormone with immunological and angiogenic properties . J Reprod Immunol.
2010; ; 85 : :93.–98. 53.
Ledee
N
,
Petitbarat
M
,
Rahmati
M
, et al.
New pre-conception immune biomarkers for clinical practice: interleukin-18, interleukin-15 and TWEAK on the endometrial side, G-CSF on the follicular side . J Reprod Immunol.
2011; ; 88 : :118.–123. 54.
Petitbarat
M
,
Rahmati
M
,
Serazin
V
, et al.
TWEAK, appears as a modulator of endometrial IL-18 related cytotoxic activity of uterine natural killers . PLoS One.
2011; ; 6 : :e14497.. 55.
Stampalija
T
,
Chaiworapongsa
T
,
Romero
R
, et al.
Maternal plasma concentrations of sST2 and angiogenic/anti-angiogenic factors in preeclampsia . J Matern-Fetal Neonatal Med.
2013; ; 26 : :1359.–1370. 56.
Kaitu’u-Lino
TJ
,
Tuohey
L
,
Tong
S
. Maternal serum interleukin-33 and soluble ST2 across early pregnancy, and their association with miscarriage . J Reprod Immunol.
2012; ; 95 : :46.–49. 57.
Salker
MS
,
Nautiyal
J
,
Steel
JH
, et al.
Disordered IL-33/ST2 activation in decidualizing stromal cells prolongs uterine receptivity in women with recurrent pregnancy loss . PLoS One.
2012; ; 7 : :e52252.. 58.
Hu
WT
,
Li
MQ
,
Liu
W
, et al.
IL-33 enhances proliferation and invasiveness of decidual stromal cells by up-regulation of CCL2/CCR2 via NF-kappaB and ERK1/2 signaling . Mol Hum Reprod.
2014; ; 20 : :358.–372. 59.
Coulombel
L
. Tolérance maternelle du fœtus : le rôle d’un enhancer de Foxp3 lors de l’émergence des mammifères euthériens . Med Sci (Paris).
2012; ; 28 : :826.–828. |