| |
| Med Sci (Paris). 2014 June; 30(6-7): 631–633. Published online 2014 July 11. doi: 10.1051/medsci/20143006011.La V-ATPase : un senseur de pH contrôlant la fusion membranaire Nicolas Morel,1 Sandrine Poëa-Guyon,1 Mohamed-Raafet Ammar,2 and Nicolas Vitale2* 1Centre de neurosciences Paris-Sud, CNRS, UMR 8195 et Université Paris-Sud, F-91405 Orsay, France 2Institut des neurosciences cellulaires et intégratives ; CNRS - UPR 3212 et Université de Strasbourg, 5, rue Blaise Pascal, 67084Strasbourg, France MeSH keywords: Exocytose, génétique, Humains, Concentration en ions d'hydrogène, Fusion membranaire, Vésicules synaptiques, physiologie, Vacuolar Proton-Translocating ATPases, Vacuoles, métabolisme |
ATPases à protons vacuolaires et exocytose régulée des vésicules synaptiques Les ATPases à protons vacuolaires (V-ATPases) accumulent des protons dans de nombreux compartiments intracellulaires tels que le réseau trans-Golgi (trans-Golgi network), les endosomes, les lysosomes et les vésicules de sécrétion ou les vésicules synaptiques. L’acidification de ces organites est nécessaire à une multitude de processus biologiques (maturation, adressage ou recyclage de nombreuses protéines membranaires notamment) ainsi qu’au remplissage en médiateurs des vésicules de sécrétion et des vésicules synaptiques. La V-ATPase est constituée d’une quinzaine de sous-unités différentes organisées en un domaine membranaire V0 qui transporte les protons, et un domaine cytosolique V1 portant l’activité ATPasique. Ces deux domaines peuvent se dissocier de façon réversible, inactivant l’enzyme et démasquant V0. Le processus qui conduit à la libération des médiateurs contenus dans les vésicules de sécrétion ou les vésicules synaptiques, appelé exocytose régulée, se déroule en plusieurs étapes. Les vésicules sont d’abord amarrées à la membrane plasmique (tethering et docking), puis activées (priming). Après activation par un influx de calcium, l’ouverture et l’expansion d’un canal traversant les deux membranes accolées (pore de fusion) aboutissent enfin à la fusion des membranes vésiculaire et plasmique, libérant le contenu vésiculaire dans l’espace synaptique [
1]. Malgré l’identification depuis plus de deux décennies du rôle crucial des protéines SNARE (SNAP [soluble NSF attachment protein] receptor) dans les étapes de docking des vésicules synaptiques [1,
2], la compréhension du processus de fusion membranaire en lui-même reste très parcellaire. En particulier, la nature lipidique, protéique ou protéo-lipidique du pore de fusion reste sujette à débat. Des données anciennes, obtenues par des approches de reconstitution fonctionnelle [
3,
4], avaient suggéré que la sous-unité c de V0, ou V0 lui-même, pouvait participer à la constitution d’un tel pore de fusion membranaire. Un rôle de V0 dans la fusion membranaire et l’exocytose, indépendant du transport des protons, a aussi été suggéré par des approches génétiques chez la levure [
5], la drosophile [
6], et C. elegans [
7]. Cependant, comme de nombreuses fonctions cellulaires dépendent des gradients de protons générés par les V-ATPases, il est difficile de distinguer par des approches classiques un éventuel effet direct de l’inactivation de V0 sur l’exocytose d’effets indirects résultant de l’inactivation prolongée du transport des protons. Et cette double fonction potentielle de la V-ATPase reste encore largement ignorée. |
Double rôle des domaines V0 et V1 de la V-ATPase dans le cycle des vésicules synaptiques Pour évaluer plus spécifiquement l’importance du domaine V0 dans le processus de fusion membranaire, nous avons procédé à la photo-inactivation aiguë de V0 (via la sous-unité a1), ou de V1 (via la sous-unité A portant le site ATPasique) par la technique dite du CALI (chromophore-assisted light inactivation) [
8]. Cette approche permet de distinguer les effets rapides de l’inactivation de la sous-unité ciblée, d’effets à plus long terme sur l’acidification et le remplissage en neurotransmetteurs des vésicules. Ainsi la photo-inactivation de la sous-unité a1 de V0 conduit à une altération rapide (en 2 à 3 min) de la neurotransmission de neurones en culture et de la libération des catécholamines par les cellules chromaffines [
9]. Cette altération est associée à une modification des paramètres cinétiques des événements de fusion unitaire, sans changement du contenu vésiculaire en catécholamines. Au contraire, la photo-inactivation de la sous-unité catalytique A n’entraîne pas d’effets rapides sur la neurotransmission, mais uniquement des effets retardés (après 30 min) sur la quantité de catécholamines libérée, sans affecter les paramètres cinétiques des évènements d’exocytose [9]. Ces effets retardés sont probablement la conséquence d’une altération progressive du contenu granulaire en catécholamines, à la suite de l’inactivation de la sous-unité A et donc de la perte de l’activité de transport de proton. La technique du CALI nous a donc permis de distinguer très clairement les effets de la photo-inactivation aiguë de V0, qui surviennent bien avant l’apparition des effets de l’inactivation de la sous-unité catalytique A et du transport de protons [9]. Ces résultats montrent que V0 contrôle la fusion de manière indépendante de son action dans le transport de protons, et suggèrent que V0 pourrait stabiliser le pore de fusion et favoriser le mélange des lipides membranaires lors de l’étape ultime de l’exocytose [4]. |
La V-ATPase : un senseur du remplissage des vésicules Bien que le rôle de V0 dans la fusion membranaire soit indépendant de la fonction de transport de protons, le trafic de nombreux organites intracellulaires semble contrôlé par leur pH interne. En manipulant le pH intra-vésiculaire par différents ionophores, bases faibles ou inhibiteurs spécifiques de la V-ATPase, nous avons pu montrer que le pH intravésiculaire régule l’exocytose des granules chromaffines, probablement en changeant la conformation de V0 [9]. Ainsi, à pH intravésiculaire acide (voisin de 5,5), V0 adopte une conformation entraînant la dissociation du domaine V1, et permissive pour l’exocytose (Figure 1B). En revanche, à pH neutre, V0 et V1 sont associés, la V-ATPase pompe les protons, permettant de restaurer le gradient de protons, et V0 est incompétent pour l’exocytose (Figure 1A). Ainsi, il est tentant de proposer que, le remplissage des vésicules synaptiques en neurotransmetteurs consommant le gradient de protons, celui-ci ne devient optimum pour l’exocytose que lorsque les vésicules sont pleines de neurotransmetteurs et de protons. La V-ATPase serait alors un senseur du pH intravésiculaire qui, par la conformation permissive de V0 et la dissociation de V1, renseignerait le mécanisme d’exocytose sur le contenu en neurotransmetteurs de la vésicule, évitant l’exocytose de vésicules en cours de remplissage. V0 interagit avec les protéines SNARE [1] et pourrait donc jouer un rôle régulateur lors de l’étape de docking des vésicules synaptiques (Figure 1C), avant de réintervenir lors de la fusion membranaire (Figure 1D). De manière intéressante, la dissociation de V1 rend aussi V0 disponible pour une interaction avec d’autres régulateurs potentiels de l’exocytose. Parmi ces derniers, on peut citer la triade ARNO-ARF6 (ADP-ribosylation factor)-PLD (phospholipase D) qui module la production de lipides fusogéniques au niveau du site de fusion membranaire [
10], ce qui pourrait contribuer à réguler la formation et la vitesse d’expansion du pore de fusion.
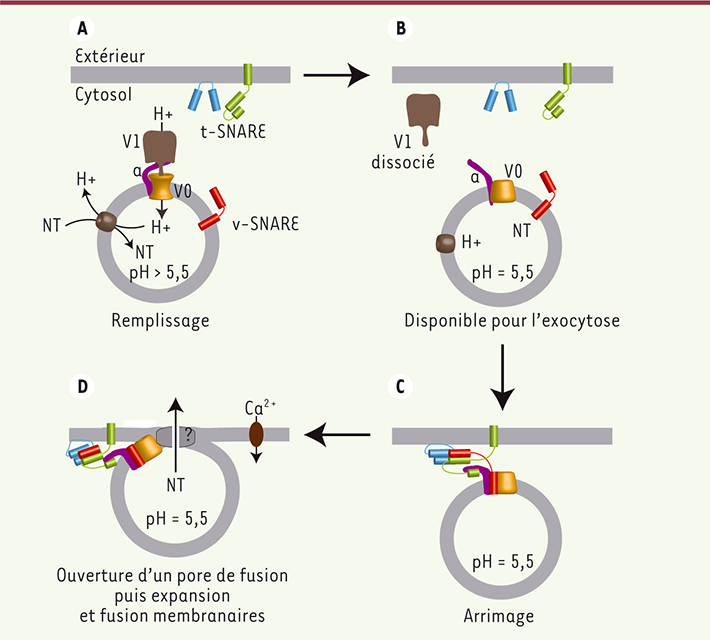
 | Figure 1.
Modèle du mécanisme permettant à la V-ATPase de réguler la neurosécrétion. À pH > 5,5, le complexe V1-V0 permet le remplissage en neurotransmetteurs (NT) de la vésicule en générant un gradient de protons (A). La dissociation du complexe V1-V0 à pH acide (B) rend disponible V0 pour une interaction avec la v-SNARE VAMP-2 (rouge) et la t-SNARE syntaxine-1 (vert), qui favorise ainsi la formation de complexes entre VAMP-2, la syntaxine-1 et la SNAP-25 (bleue), et permet l’arrimage de la vésicule synaptique à la membrane plasmique (C). Lors de la stimulation, V0 régule la formation et/ou l’ouverture d’un pore de fusion (D) dont l’expansion va conduire à la fusion membranaire. |
|
Nos travaux ont permis de révéler un lien entre le remplissage des vésicules synaptiques en neurotransmetteurs et leur disponibilité à l’exocytose. De manière remarquable, il n’existe qu’une ou deux copies de V-ATPase par vésicule synaptique ; ce qui les placent à une position stratégique pour recruter des éléments essentiels à la formation d’un site d’exocytose fonctionnel. L’approche de photo-inactivation rapide par CALI devrait maintenant permettre d’étudier plus en détail par quels mécanismes la V-ATPase joue successivement un rôle de senseur du contenu vésiculaire renseignant la machinerie d’exocytose, puis de régulateur de la stabilité du pore de fusion et du mélange des lipides membranaires lors de la phase terminale de l’exocytose. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
El Far
O
,
Seagar
M
. SNARE, V-ATPase and neurotransmission . Med Sci (Paris).
2011; ; 27 : :28.–31. 2.
Galli
T
,
Kuster
A
,
Tareste
D
. Nobel Prize in Physiology and Medicine 2013–an award for the discovery of the actors and fundamental molecular mechanisms of intracellular vesicle trafficking . Med Sci (Paris).
2013; ; 29 : :1055.–1058. 3.
Israel
M
,
Morel
N
,
Lesbats
B
,
Birman
S
,
Manaranche
R
. Purification of a presynaptic membrane protein that mediates a calcium-dependent translocation of acetylcholine . Proc Natl Acad Sci USA.
1986; ; 83 : :9226.–9230. 4.
Peters
C
,
Bayer
MJ
,
Buhler
S
, et al.
Trans-complex formation by proteolipid channels in the terminal phase of membrane fusion . Nature.
2001; ; 409 : :581.–588. 5.
Strasser
B
,
Iwaszkiewicz
J
,
Michielin
O
,
Mayer
A
. The V-ATPase proteolipid cylinder promotes the lipid-mixing stage of SNARE-dependent fusion of yeast vacuoles . EMBO J.
2011; ; 30 : :4126.–4141. 6.
Hiesinger
PR
,
Fayyazuddin
A
,
Mehta
SQ
, et al.
The v-ATPase V(0) subunit a1 is required for a late step in synaptic vesicle exocytosis in Drosophila . Cell.
2005; ; 121 : :607.–620. 7.
Liegeois
S
,
Benedetto
A
,
Garnier
JM
, et al.
The V0-ATPase mediates apical secretion of exosomes containing Hedgehog-related proteins in Caenorhabditis elegans . J Cell Biol.
2006; ; 173 : :949.–961. 8.
Tour
O
,
Meijer
RM
,
Zacharias
DA
,
Adams
SR
,
Tsien
RY
. Genetically targeted chromophore-assisted light inactivation . Nat Biotechnol.
2003; ; 21 : :1505.–1508. 9.
Poëa-Guyon
S
,
Ammar
MR
,
Erard
M
, et al.
The V-ATPase membrane domain is a sensor of granular pH that controls the exocytotic machinery . J Cell Biol.
2013; ; 203 : :283.–298. 10.
Ammar
MR
,
Kassas
N
,
Chasserot-Golaz
S
, et al.
Lipids in regulated exocytosis: what are they doing?
Front Endocrinol (Lausanne).
2013; ; 4 : :125.. |