| |
| Med Sci (Paris). 2014 June; 30(6-7): 619–621. Published online 2014 July 11. doi: 10.1051/medsci/20143006007.L’interaction TET-OGT facilite la transcription en régulant la méthylation de l’histone H3 Benjamin Delatte1* 1Laboratoire d’épigénétique du cancer, Erasme, route de Lennik 808, 1070Bruxelles, Belgique MeSH keywords: Protéines de liaison à l'ADN, métabolisme, Dioxygenases, Épigenèse génétique, Histone-lysine N-methyltransferase, Histone, Humains, Méthylation, Mixed function oxygenases, N-acetylglucosaminyltransferase, Liaison aux protéines, Protéines proto-oncogènes, Transcription génétique |
Le méthylcytosine n’est plus la seule modification épigénétique de l’ADN De nombreuses découvertes en matière de régulation épigénétique ont été mises en évidence depuis que Conrad Hal Waddington a imaginé ce terme en 1942 (voir Encadré). La modification de la chromatine qui est la plus étudiée est l’ajout d’un groupement méthyle sur le carbone 5 de la cytosine, principalement sur les dinucléotides CpG, pour produire de la 5-méthylcytosine (ou 5-mC). Cette modification, lorsqu’elle est située sur les promoteurs des gènes, participe à leur répression transcriptionnelle. Dans certaines situations, un phénomène de déméthylation permet de réactiver les gènes. Il faut distinguer ici deux phénomènes : la déméthylation « passive » de l’ADN et la déméthylation « active ». Dans le premier cas, la méthylcytosine est remplacée par une cytosine non modifiée au cours de la réplication de l’ADN et est donc diluée au fur et à mesure des divisions cellulaires. Dans le deuxième cas, plusieurs enzymes sont spécifiquement recrutées sur une région de l’ADN et excisent la cytosine méthylée pour la remplacer par une nouvelle cytosine non méthylée [
1]. Ce processus intervient dans différentes situations physiopathologiques et était connu depuis plusieurs décennies, cependant, les enzymes y participant n’étaient pas identifiées. En 2009, plusieurs laboratoires identifièrent trois nouvelles modifications de l’ADN : la 5-hydroxyméthylcytosine (5-hmC), la 5-formylcytosine (5-fC) et la 5-carboxylcytosine (5-caC), qui sont les produits d’oxydation itérative de la méthylcytosine par les enzymes de la famille TET (ten eleven translocation) [
2–
4]. Nous n’avons à l’heure actuelle que peu d’information sur ces enzymes, mais il semble déjà qu’elles soient impliquées dans des maladies neurodégénératives ou des cancers. D’un point de vue plus mécanistique, elles participent à la déméthylation active de l’ADN. En effet, la 5-fC et 5-caC peuvent être reconnues par la glycosylase TDG (thymine DNA glycosylase) qui est capable d’exciser la base [1]. L’hydroxyméthylcytosine, quant à elle, semble plutôt correspondre à une marque épigénétique stable qui, avec la méthylcytosine, enrichit considérablement le patrimoine des modifications de la chromatine. |
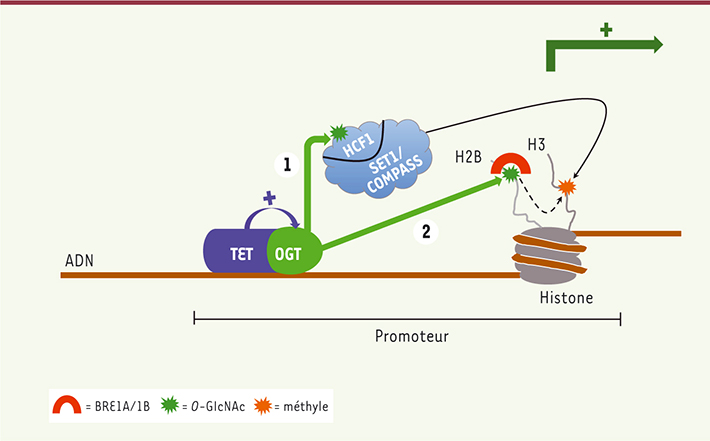
Découverte d’une interaction forte entre les TET et la glycosyltransférase OGT Une manière de découvrir les potentiels rôles des TET est d’en chercher des partenaires dont la fonction est connue. Notre laboratoire a donc entrepris des études protéomiques à large spectre afin de détecter de manière non biaisée toutes les protéines interagissant avec TET1, TET2 et TET3. De manière surprenante, nous avons pu observer que le principal partenaire de TET2 et TET3 est l’O-linked N-acetylglucosamine (O-GlcNAc) transferase (OGT) [
5]. Cette enzyme catalyse l’ajout dynamique de groupements glycosidiques sur les sérines ou thréonines de nombreuses protéines participant à la transduction cellulaire, la transcription, la traduction ou encore la dégradation dépendante du protéasome. Elle peut également directement glycosyler les histones dont l’histone H2B sur la sérine 112 (H2BS112GlcNAc). Cette modification épigénétique participe à l’activation transcriptionnelle en permettant le recrutement du complexe BRE1A/1B qui ubiquitinyle H2B sur la lysine 120 (H2BK120ub), elle-même un précurseur pour la déposition de la marque activatrice H3K4me3 (triméthylation de l’histone H3 sur la lysine 4) par le complexe SET1/COMPASS (complex of proteins associated with Set1) [
6] (Figure 1). Des expériences d’immunoprécipitation de chromatine suivies de séquençage à haut débit (ChIP-seq) suggèrent que TET2, TET3 et OGT colocalisent sur de nombreux promoteurs de gènes notamment impliqués dans la cancérogenèse. Nous avons également pu montrer que TET2 et TET3 potentialisent l’activité catalytique d’OGT par un mécanisme encore non identifié. Cette activité accrue permet à son tour de glycosyler la sous-unité HCF1 (host cell factor-1) du complexe SET1/COMPASS, ce qui stabilise le complexe sur la chromatine et promeut la triméthylation de l’histone H3 ainsi que l’activation transcriptionnelle [5]. Ce lien physique et fonctionnel a été confirmé par d’autres laboratoires qui ont également montré que TET1 était capable d’interagir avec OGT dans des cellules embryonnaires murines, et que TET2 participe à la glycosylation d’H2B dépendante d’OGT [
7,
8]. Plusieurs articles ont également décrit que les trois protéines TET peuvent être à leur tour glycosylées par OGT, ce qui affecte leur stabilité ou leur localisation cellulaire [8–
10]. Un consensus pourrait donc se dévoiler dans lequel les trois TET coopéreraient avec OGT sur la chromatine afin de stabiliser le complexe SET1/COMPASS, glycosyler l’histone H2B et promouvoir la triméthylation de l’histone H3 ainsi que l’activation de la transcription (voir
Figure 1
).
 | Figure 1.
Lien TET-OGT-SET1/COMPASS. TET2 et TET3 (et potentiellement TET1) interagissent avec l’enzyme OGT et renforcent son activité catalytique sur les promoteurs de nombreux gènes. Cette activité accrue permet (1) la glycosylation du complexe SET1/COMPASS sur sa sous-unité HCF1, et (2) la glycosylation de l’histone H2B. Il en résulte (1) une augmentation de la stabilité du complexe SET1/COMPASS ainsi (2) qu’un recrutement de BRE1A/1B, ayant tous deux pour effet la triméthylation de K4 sur l’histone H3, marquant ainsi le promoteur pour une activation de la transcription. |
|
Épigénétique « Conrad Hal Waddington, scientifique et philosophe britannique, est le premier à formuler de façon explicite la nécessité d’établir les liens de causalité entre génotype et phénotype pour appréhender les processus du développement. En d’autres termes, il importe à ses yeux de rapprocher la génétique – la science de l’hérédité des caractères, science créée à la redécouverte des travaux de Gregor Mendel à l’aube du XX
e siècle –, de l’épigénèse – la théorie du développement par élaboration progressive des formes. Cette théorie fut formulée initialement par Aristote, quatre siècles avant notre ère, en opposition à celle de la préformation. Mais elle ne fut validée expérimentalement que bien des siècles plus tard, aux XVIII
e et XIX
e siècles, notamment grâce aux progrès en microscopie qui permirent enfin d’observer l’intérieur de l’œuf et les divisions cellulaires. Dans un court article, Waddington propose donc de fusionner les termes épigénèse et génétique pour désigner de ce nouveau nom l’étude des mécanismes par lesquels les gènes déterminent les caractères ». (Edith Heard, Leçon inaugurale, Collège de France, 2013)
|
|
Potentiels rôles du lien TET-OGT dans la pathogenèse Ce lien entre les TET et OGT suggère que les TET peuvent être impliquées dans l’étiologie de nombreuses maladies impliquant des défauts métaboliques, en particulier le diabète de type 2 ainsi que les cancers. En effet, le diabète de type 2 est caractérisé par une augmentation du glucose sanguin, une résistance à l’insuline ainsi qu’une augmentation de l’UDP-GlcNAc, le cofacteur obligatoire d’OGT1. Malgré des résultats conflictuels sur l’implication d’OGT dans la résistance à l’insuline, il a été montré qu’HCF1 recrute OGT sur la protéine PGC-1α (peroxisome proliferator-activated receptor gamma coactivator 1-alpha), promeut sa glycosylation et augmente sa stabilité. Cela a pour conséquence une amplification de la néoglucogenèse (fabrication de glucose à partir de précurseurs non glucidiques) et une augmentation de glucose, notamment dans le foie. D’autre part, l’inhibition d’OGT et d’HCF1 rétablit l’homéostasie du glucose chez des souris diabétiques [
11]. Il serait intéressant de regarder, dans des îlots de Langerhans de patients ou de souris diabétiques, la stabilité du complexe SET1/COMPASS ainsi que le niveau de glycosylation de l’histone H2B sur les cibles liant les protéines TET, et ainsi déterminer si certains traits de la maladie peuvent s’expliquer par une altération de la structure chromatinienne des gènes liés par TET et OGT.
O-GlcNac a également été décrit comme un biomarqueur de cancers humains ; l’augmentation de son occurrence peut être observée dans les cancers du côlon, du poumon et dans les leucémies. OGT semble également jouer un rôle dans les cancers de la prostate et du sein [11]. Par ailleurs, une « marque de fabrique » de divers cancers est une altération globale et locale de l’hydroxyméthylation, rendant intéressante l’investigation d’un potentiel lien entre les protéines TET, OGT ainsi que le complexe SET1/COMPASS dans le processus de carcinogenèse [1]. |
Depuis leur découverte il y a près de cinq ans, les TET ainsi que les produits d’oxydation de la méthylcytosine ont suscité un intérêt jamais atteint dans la communauté épigénétique, qu’illustrent des articles scientifiques de très haut niveau. De nombreux chercheurs ont trouvé en ces enzymes les initiateurs de la déméthylation qu’ils cherchent depuis si longtemps. D’autres y voient de potentiels acteurs dans des maladies aussi importantes que les cancers. L’identification de partenaires comme la glycosyltransférase OGT permettra certainement de mieux comprendre l’influence des TET sur la structure chromatinienne, et un rôle du lien TET-OGT est envisageable dans certaines pathologies où le métabolisme est dérégulé. De nombreuses découvertes restent encore à faire, mais il est sûr que ces protéines s’attarderont dans les lumières des projecteurs pendant encore un long moment. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Delatte
B
,
Fuks
F
. TET proteins: on the frenetic hunt for new cytosine modifications . Brief Funct Genomics.
2013; ; 12 : :191.–204. 2.
Tahiliani
M
,
Koh
KP
,
Shen
Y
, et al.
Conversion of 5-methylcytosine to 5-hydroxymethylcytosine in mammalian DNA by MLL partner TET1 . Science.
2009; ; 324 : :930.–935. 3.
Kriaucionis
S
,
Heintz
N
. The nuclear DNA base 5-hydroxymethylcytosine is present in Purkinje neurons and the brain . Science.
2009; ; 324 : :929.–930. 4.
Ito
S
,
Shen
L
,
Dai
Q
, et al.
Tet proteins can convert 5-methylcytosine to 5-formylcytosine and 5-carboxylcytosine . Science.
2011; ; 333 : :1300.–1303. 5.
Deplus
R
,
Delatte
B
,
Schwinn
MK
, et al.
TET2 and TET3 regulate GlcNAcylation and H3K4 methylation through OGT and SET1/COMPASS . EMBO J.
2013; ; 32 : :645.–655. 6.
Fujiki
R
,
Hashiba
W
,
Sekine
H
, et al.
GlcNAcylation of histone H2B facilitates its monoubiquitination . Nature.
2011; ; 480 : :557.–560. 7.
Chen
Q
,
Chen
Y
,
Bian
C
, et al.
TET2 promotes histone O-GlcNAcylation during gene transcription . Nature.
2013; ; 493 : :561.–564. 8.
Vella
P
,
Scelfo
A
,
Jammula
S
, et al.
Tet proteins connect the O-linked N-acetylglucosamine transferase Ogt to chromatin in embryonic stem cells . Mol Cell.
2013; ; 49 : :645.–656. 9.
Shi
FT
,
Kim
H
,
Lu
W
, et al.
Ten-eleven translocation 1 (Tet1) is regulated by O-linked N-acetylglucosamine transferase (Ogt) for target gene repression in mouse embryonic stem cells . J Biol Chem.
2013; ; 288 : :20776.–20784. 10.
Ito
R
,
Katsura
S
,
Shimada
H
, et al.
TET3-OGT interaction increases the stability and the presence of OGT in chromatin . Genes Cells.
2014; ; 19 : :52.–65. 11.
Ruan
HB
,
Singh
JP
,
Li
MD
, et al.
Cracking the O-GlcNAc code in metabolism . Trends Endocrinol Metab.
2013; ; 24 : :301.–309. |