| |
| Med Sci (Paris). 2014 June; 30(6-7): 610–613. Published online 2014 July 11. doi: 10.1051/medsci/20143006004.Le VIH-2 révèle un mécanisme antiviral de détection par l’immunité innée Xavier Lahaye1 and Nicolas Manel1* 1Institut Curie, Inserm U932, 12, rue Lhomond, 75005Paris, France MeSH keywords: Capside, immunologie, ADN viral, métabolisme, Cellules dendritiques, Infections à VIH, VIH-1 (Virus de l'Immunodéficience Humaine de type 1), génétique, VIH-2 (Virus de l'Immunodéficience Humaine de type 2), Humains, Immunité innée, physiologie, Nucleotidyltransferases |
Le VIH-2, un virus naturellement contrôlé Lors d’une infection par le lentivirus VIH-1 (virus de l’immunodéficience humaine 1), une réponse immunitaire est induite, mais celle-ci n’est pas suffisamment protectrice chez la plupart des individus infectés [
11,
12]. La progression vers le stade Sida (syndrome d’immunodéficience acquise) est généralement inévitable en l’absence d’un traitement antirétroviral. En revanche, le lentivirus apparenté VIH-2 est moins pathogène que le VIH-1. Il est admis que les trois quarts des patients infectés par le VIH-2 ne progresseront pas vers le stade Sida au cours de leur vie. De plus, le foyer principal d’infection VIH-2 est restreint à l’Afrique de l’Ouest, alors que le VIH-1 est pandémique. La transmission du VIH-2 entre individus semble donc moins efficace que celle du VIH-1. Comment expliquer ces différences ? In vitro, le VIH-1 ne se multiplie pas plus efficacement que le VIH-2. Le VIH-2 est même capable d’utiliser davantage de récepteurs d’entrée cellulaire que le VIH-1. In vivo, le contrôle de la réplication du VIH-2 est associé à une réponse immunitaire adaptative accrue comparée à celle qu’induit le VIH-1 [
1]. De plus, chez les individus co-infectés par le VIH-1 et le VIH-2, la présence du VIH-2 procure un bénéfice qui retarde la progression vers le stade Sida en comparaison des patients infectés par le VIH-1 seul. Ceci suggère qu’il existerait une meilleure réponse immunitaire dirigée contre le VIH-2. Un objectif majeur du combat contre le VIH est donc de comprendre comment le VIH-1 et le VIH-2 diffèrent dans leur capacité à induire des réponses immunitaires. Au sein du système immunitaire, les cellules dendritiques (DC) jouent un rôle essentiel d’orchestrateur. En effet, elles associent la détection des pathogènes par les mécanismes de l’immunité innée à l’amorçage du système immunitaire adaptatif. Cette détection requiert la reconnaissance d’entités moléculaires associées aux pathogènes et conduit à l’activation des cellules dendritiques. Dans le cas du VIH-1 et du VIH-2, il était connu que les cellules dendritiques sont des cibles de l’infection par le virus, au même titre que les lymphocytes T CD4+ et les macrophages. Nous avons donc cherché à comprendre si les cellules dendritiques pouvaient détecter le VIH-1 et le VIH-2. |
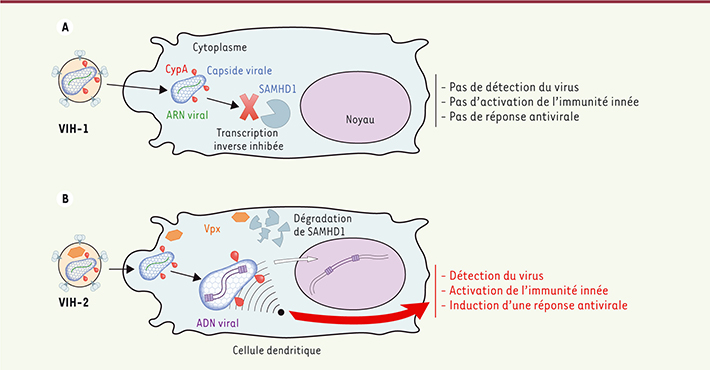
Détection du VIH-1 et du VIH-2 par les cellules dendritiques Nous savions que le VIH-1 et le VIH-2 diffèrent dans leur capacité à infecter les cellules dendritiques efficacement. En effet, l’infection VIH-1 des cellules dendritiques est peu efficace du fait de l’activité d’une protéine cellulaire, SAMHD1 (SAM [sterile alpha motif] domain and HD domain-containing protein 1), qui inhibe l’étape de transcription inverse du génome du VIH-1 [
2,
3,
13,
14] (Figure 1A). Le VIH-2 code pour la protéine accessoire Vpx, absente du VIH-1, qui possède la faculté d’induire la dégradation de SAMHD1. Ceci permet une transcription inverse efficace du VIH-2 dans les cellules dendritiques (Figure 1B). Comment l’infection efficace des cellules dendritiques par le VIH-2 peut-elle influencer la réponse immunitaire ? Nous avons montré que lors de l’infection des cellules dendritiques par le VIH-2, le virus est reconnu et une réponse immunitaire innée est induite, alors que l’infection par le VIH-1 n’est pas assez efficace pour induire cette réponse [
4,
5]. En complémentant le VIH-1 avec la protéine Vpx, la résistance à l’infection des cellules dendritiques est contournée. Dans ce contexte, le VIH-1 induit alors une réponse immunitaire innée. Ces résultats démontrent qu’il existe un mécanisme de reconnaissance cryptique du VIH-1 dans les cellules dendritiques, auquel le virus échappe parce qu’il infecte faiblement ces cellules. Bien que les cellules dendritiques soient infectées par le VIH-1 en présence de Vpx, ce mécanisme semble globalement bénéfique : nos résultats ont en effet montré qu’il permet d’activer les lymphocytes T CD4+ et CD8+ plus fortement. De plus, ce mécanisme de détection induit un effet antiviral dans des lymphocytes T CD4+ non infectés adjacents, via la production d’interféron (IFN) de type I qui protège ces cellules de l’infection par le virus.
 | Figure 1.
Le VIH-1 échappe à la détection par les cellules dendritiques alors que le VIH-2 est reconnu. A . Lorsque le VIH-1 infecte les cellules dendritiques, en l’absence de Vpx, la transcription inverse est limitée par SAMHD1, et le virus échappe à la détection innée. B. Le VIH-2 contient Vpx qui induit la dégradation de SAMHD1 et permet une transcription inverse efficace de l’ADN viral dans les cellules dendritiques. La capside virale et son interaction avec la CypA déterminent si cet ADN va être reconnu ou s’il va échapper à la détection. Si l’ADN est reconnu, l’immunité innée est activée et une réponse antivirale est induite. |
|
La capside régule la reconnaissance de l’ADN viral Par quels mécanismes les cellules dendritiques peuvent-elles reconnaître le VIH-1 et le VIH-2 lorsque la restriction par SAMHD1 est levée ? Nos résultats sur le VIH-1 ont établi que, en présence de Vpx, l’infection productive par le virus, et notamment l’expression de la protéine de capside virale dans les cellules dendritiques, est nécessaire. De plus, nous avons démontré que l’interaction de la capside avec la protéine cellulaire prolyl-isomérase cyclophiline A (CypA) joue un rôle essentiel [4,
15]. Toutefois, l’expression de la capside virale est nécessaire, mais non suffisante, pour induire une réponse des cellules dendritiques. Le mécanisme de détection et d’activation restait à déterminer. Nous nous sommes focalisés sur le mécanisme de reconnaissance du VIH-2 [
6]. Nous avons analysé le rôle de la capside du VIH-2 en modifiant son affinité pour la CypA. Nous avons identifié un mutant du VIH-2 présentant un phénotype inattendu : le mutant VIHac-2 (dont l’affinité entre la capside et la CypA est augmentée) est capable d’induire une réponse immunitaire innée dans les cellules dendritiques, sans que celles-ci ne soient infectées de façon productive. Ce virus nous a permis de démontrer que c’est l’ADN viral du VIH-2, après transcription inverse, alors qu’il est présent dans le cytosol avant son import nucléaire et son intégration dans le génome cellulaire, qui est reconnu par les cellules dendritiques (Figure 1B) [15]. Nous avons ensuite modifié la capside du VIH-1 de manière analogue (virus VIHac-1) de telle sorte que le virus active les cellules dendritiques, mais sans infection productive. Ainsi, l’expression de la capside virale du VIH-1 dans les cellules dendritiques n’est plus nécessaire pour la reconnaissance innée. Dans l’ensemble, nos résultats montrent que la capside virale joue un rôle régulateur, puisque c’est elle qui détermine si l’ADN viral va être reconnu par les cellules dendritiques, ou s’il va échapper à cette reconnaissance [15]. Des observations analogues ont été rapportées par une autre équipe dans le cas de l’infection de macrophages [
7]. Cependant, le mécanisme moléculaire mis en jeu par la capside est encore mal compris. |
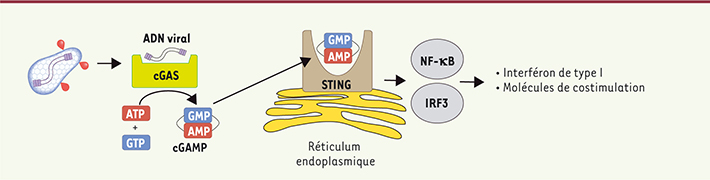
L’ADN viral est reconnu par cGAS Comment l’ADN viral est-il reconnu par les cellules dendritiques ? La capacité de l’ADN cytosolique à stimuler l’immunité innée a été décrite en 1993 par Stacey, Ross et Hume [
8], mais ce n’est que récemment que les mécanismes de reconnaissance de cet ADN ont été décryptés. De nombreux récepteurs cytosoliques de l’ADN ont été identifiés [
9]. Dans le cas de la reconnaissance du VIH dans les cellules dendritiques, nous avons montré que l’AMP-GMP cyclique synthase (cGAS, ou cyclic GMP-AMP synthase) est essentielle (Figure 2). Ces résultats sont conformes à ceux récemment obtenus dans une lignée monocytaire humaine transformée (THP-1) [
10]. La reconnaissance de l’ADN cytosolique par cGAS déclenche la production de cGAMP (2’-3’-GMP-AMP cyclique). Le cGAMP joue le rôle de second messager et lie son récepteur STING (stimulator of interferon genes), résidant dans le réticulum endoplasmique. En présence de cGAMP, STING se dimérise, ce qui conduit à l’activation des facteurs de transcription IRF3 (interferon regulatory factor 3) et NF-κB, à la production d’IFN de type I et, dans les cellules dendritiques, à l’expression de molécule de costimulation (Figure 2).
 | Figure 2.
Modèle de détection de l’ADN viral du VIH par les cellules dendritiques. La protéine cGAS détecte l’ADN viral et synthétise le second messager cGAMP. cGAMP se lie à STING et active les facteurs de transcription IRF3 et NF-ĸB, conduisant à l’activation d’une réponse innée antivirale caractérisée par la production d’interféron de type I et à l’expression de molécule de costimulation. |
|
Il pourrait être bénéfique de manipuler cette réponse immunitaire innée chez les patients infectés afin d’améliorer l’immunité anti-VIH-1. Nous avons montré, à partir d’échantillons sanguins de patients infectés par le VIH-1, que le traitement de cellules dendritiques avec le VIHac-1 non réplicatif induit, par comparaison avec le VIH-1, une meilleure activation des lymphocytes T CD8+. Il serait intéressant de déterminer le comportement de tels virus non réplicatifs activateurs dans des modèles in vivo. Enfin, en raison de la découverte du rôle de cGAS, il est envisageable de manipuler directement cette protéine et son produit, le cGAMP, afin d’induire une réponse immunitaire antivirale. En conclusion, nos travaux ont permis d’identifier un nouveau mécanisme de reconnaissance innée du VIH-1 et du VIH-2 par les cellules dendritiques. Le VIH-1 échappe normalement à cette réponse, alors que le VIH-2 l’active. Ceci offre un parallèle captivant avec la différence de pathogénicité de ces deux virus chez les patients infectés. L’étude des interactions entre le VIH-2 et le système immunitaire offre donc un modèle unique pour comprendre la plus faible pathogénicité de ce virus. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nous remercions Philippe Benaroch pour la relecture de cette Nouvelle.
|
1.
Rowland-Jones
SL
,
Whittle
HC
. Out of Africa: what can we learn from HIV-2 about protective immunity to HIV-1 ?
Nat Immunol.
2007; ; 8 : :329.–331. 2.
Hrecka
K
,
Hao
C
,
Gierszewska
M
, et al.
Vpx relieves inhibition of HIV-1 infection of macrophages mediated by the SAMHD1 protein . Nature.
2011; ; 474 : :658.–661. 3.
Laguette
N
,
Sobhian
B
,
Casartelli
N
, et al.
SAMHD1 is the dendritic- and myeloid-cell-specific HIV-1 restriction factor counteracted by Vpx . Nature.
2011; ; 474 : :654.–657. 4.
Manel
N
,
Hogstad
B
,
Wang
Y
, et al.
A cryptic sensor for HIV-1 activates antiviral innate immunity in dendritic cells . Nature.
2010; ; 467 : :214.–217. 5.
Manel
N
,
Littman
DR
. Hiding in plain sight: how HIV evades innate immune responses . Cell.
2011; ; 147 : :271.–274. 6.
Lahaye
X
,
Satoh
T
,
Gentili
M
, et al.
The capsids of HIV-1 and HIV-2 determine immune detection of the viral cDNA by the innate sensor cGAS in dendritic cells . Immunity.
2013; ; 39 : :1.–11. 7.
Rasaiyaah
J
,
Tan
CP
,
Fletcher
AJ
, et al.
HIV-1 evades innate immune recognition through specific cofactor recruitment . Nature.
2013; ; 503 : :402.–405. 8.
Stacey
KJ
,
Ross
IL
,
Hume
DA
. Electroporation and DNA-dependent cell death in murine macrophages . Immunol Cell Biol.
1993; ; 71 : :75.–85. 9.
Cerboni
S
,
Gentili
M
,
Manel
N
. Diversity of pathogen sensors in dendritic cells . Adv Immunol.
2013; ; 120 : :211.–237. 10.
Gao
D
,
Wu
J
,
Wu
YT
, et al.
Cyclic GMP-AMP synthase is an innate immune sensor of HIV and other retroviruses . Science.
2013; ; 341 : :903.–906. 11.
Malbec
M
,
Mouquet
H
,
Schwartz
O
. Les anticorps anti-VIH-1 et la transmission virale de cellule à cellule . Med Sci (Paris).
2014; ; 30 : :508.–510. 12.
Peressin
M
,
Holl
V
,
Moog
C
. Les anticorps anti-VIH. De multiples activités antivirales . Med Sci (Paris).
2014; ; 30 : :69.–75. 13.
Lahouassa
H
,
Dragin
L
,
Transy
C
,
Margottin-Goguet
F
. SAMHD1 prive le VIH des nucléotides essentiels à la synthèse d’ADN viral . Med Sci (Paris).
2012; ; 28 : :909.–910. 14.
Marquet
R
,
Guerrero
S
,
Bernacchi
S
, et al.
Un facteur de transcription se fait complice du VIH-1 pour détruire les défenses cellulaires . Med Sci (Paris).
2012; ; 28 : :356.–358. 15.
Lahaye
X
,
Manel
N
. La capside du VIH détermine la détection immunitaire innée de l’ADN viral dans les cellules dendritiques . Virologie.
2014; ; 18 : :50.–51. |