 |
| |||
Med Sci (Paris). 2014 May; 30(5): 544–549. Published online 2014 June 13. doi: 10.1051/medsci/20143005018.La pêche miraculeuse des filets du neutrophile 1Inserm UMR996, faculté de pharmacie, université Paris-Sud 11, 92290Châtenay-Malabry, France 2Département d’hématologie et immunologie, UF auto-immunité et hypersensibilité, hôpital Bichat-Claude Bernard, 75018Paris, France Corresponding author. | ||||||
| ||||||
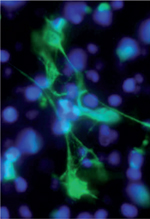
Un temps passé de mode au profit du système immunitaire adaptatif, le polynucléaire neutrophile (PN) fait son grand retour grâce, en particulier, à la découverte du mécanisme de la « nétose » [ 36]. Le PN occupe ainsi une place croissante au centre de la physiopathologie d’un nombre important de maladies humaines. Décrite pour la première fois en 2004, la nétose constitue un nouveau mécanisme effecteur du neutrophile permettant la libération des neutrophil extracellular traps (NET) dans le milieu extracellulaire. Ces NET correspondent à des filaments extracellulaires de chromatine (association d’ADN et d’histones) décondensée recouverts par de nombreuses protéines d’origine principalement granulaire [ 1] (Figure 1).
Les stimulus induisant la nétose du PN sont très variés, incluant de nombreux micro-organismes et leurs composants (LPS, lipopolysaccharide), des cytokines pro-inflammatoires (IL-8 [interleukine-8], TNFα [tumor necrosis factor α]), les plaquettes activées ou les complexes immuns [ 2]. Les mécanismes moléculaires conduisant à la nétose ne sont pas encore entièrement établis. Il se dégage cependant des différentes études un modèle « classique » impliquant la mort cellulaire du PN, ainsi que des modèles « alternatifs ». Ainsi, il n’y aurait pas un seul mécanisme de nétose, mais plusieurs, en fonction notamment du stimulus déclencheur. La formation des NET a été décrite initialement comme un nouveau programme de mort cellulaire différent de l’apoptose et de la nécrose. Cette nétose « classique » est dépendante de l’explosion oxydative et conduit à la libération de NET par 20 à 60 % des neutrophiles humains, après 2 à 4 h de stimulation avec des micro-organismes ou des activateurs de la protéine kinase C (PKC), comme l’acétate de phorbol myristate (PMA) [ 3]. Au cours de ce processus, les histones sont clivées par l’élastase issue des granulations et citrullinées par la peptidyl arginine déiminase 4 (PAD4), ce qui entraîne la décondensation et le relâchement de la chromatine [2]. La rupture conjointe des membranes nucléaire et granulaire conduit au mélange des composants cytoplasmiques, granulaires et nucléaires, puis la rupture de la membrane plasmique permet la libération des NET dans l’espace extracellulaire (Figure 2). Afin de maintenir l’homéostasie, les NET sont ensuite dégradés par l’action conjointe de la DNase 1 et d’un mécanisme d’endocytose impliquant les macrophages [ 4].
En parallèle de ce modèle « classique », plusieurs études ont rapporté un phénomène de nétose rapide (5-60 min) dans différents modèles expérimentaux [ 5– 7]. Le mécanisme cellulaire est variable, mais toutes ces nétoses rapides ont en commun de ne pas entraîner la rupture de la membrane plasmique, ni la mort du PN [ 8]. Certaines impliquent une libération d’ADN mitochondrial (stimulation par l’association de C5a [complement protein 5a] et de GM-CSF [granulocyte-macrophage colony-stimulating factor] [ 6]), d’autres une libération de vésicules de sécrétion d’ADN nucléaire (stimulation par S. aureus [5]). Une étude récente a même démontré que les PN conservaient leur capacité de migration et de phagocytose après la nétose [ 9]. Ce mécanisme rapide permettrait d’expliquer le rôle de la nétose dans certains phénomènes aigus. | ||||||
Le rôle anti-infectieux des NET, en tant que nouveau mécanisme effecteur de l’immunité innée, a été largement documenté depuis leur découverte [ 10]. La structure originale des NET leur permet de capturer une large variété de micro-organismes ; ainsi, de nombreux exemples de bactéries cibles de la nétose figurent dans la littérature, comme S. aureus ou M. tuberculosis. Il a également été démontré que les champignons (C. albicans, Aspergillus sp.), les protozoaires (Toxoplasma gondii) et, plus récemment, les virus (VIH, virus de l’immunodéficience humaine), sont sensibles à l’action antimicrobienne des NET [2]. Ces derniers, d’une part, limitent la dissémination infectieuse en capturant les micro-organismes et, d’autre part, sont capables d’en tuer un grand nombre par l’action conjointe de protéines antimicrobiennes fixées à leur surface, comme le lysozyme, des protéases, les défensines ou encore les histones. L’intervention des NET est essentielle pour lutter contre les micro-organismes trop grands pour être phagocytés, comme les hyphes fongiques ou les helminthes. Ainsi, l’absence de nétose chez les patients atteints de granulomatose septique chronique (mutation dans le gène codant pour l’oxydase NOX2) les rend particulièrement vulnérables aux aspergilloses disséminées, ces infections étant souvent mortelles. Des essais de thérapie génique rétablissant à la fois la fonctionnalité de NOX2 et la formation des NET ont montré une réduction de la charge infectieuse et une guérison en quelques semaines, ce qui démontre l’importance de ce phénomène dans la défense antifongique [ 11]. De même, le développement de mécanismes de résistance par de nombreuses bactéries pathogènes (S. pyogenes, S. pneumoniae, V. cholerae), notamment via la production de DNases, souligne le rôle majeur des NET au cours de la défense anti-infectieuse [1]. | ||||||
En parallèle de ce rôle anti-infectieux bénéfique, les NET exercent également des effets délétères sur l’organisme, parfois qualifiés de « côté obscur » de la nétose [ 12]. Ils participent ainsi aux mécanismes physiopathologiques de plusieurs maladies humaines. Maladies auto-immunes Le rôle délétère des NET a été particulièrement étudié dans le cadre des maladies auto-immunes et, notamment, du lupus [
37]. Les NET exposent dans l’espace extracellulaire de nombreux auto-antigènes potentiels, comme l’ADN double brin ou la myéloperoxydase (MPO). Ainsi, 74 % des protéines présentes sur les NET ont été identifiées comme des autoantigènes caractéristiques de différentes maladies auto-immunes systémiques, comme le lupus, la polyarthrite rhumatoïde (PR) et les vascularites [
13]. Une dérégulation de la nétose (par excès de production ou défaut de dégradation) pourrait augmenter le risque d’auto-réactivité vis-à-vis des composants des NET. Il est également possible que les modifications protéiques (oxydation, protéolyse, citrullination) induites par le processus de nétose conduisent à la génération de néoantigènes, participant ainsi à la rupture de la tolérance immunitaire [1].En plus de leur immunogénicité probable, il a été montré que les NET, via les protéases ou les histones fixées à leur surface, participent à l’inflammation et aux dommages tissulaires caractérisant la phase effectrice des manifestations auto-immunes [ 14]. Lupus érythémateux systémique De nombreuses études ont démontré l’existence d’une dérégulation des NET au cours du lupus, associant une augmentation de leur production et une altération de leur dégradation [
15,
16, 37]. L’augmentation de production des NET est déclenchée par la présence de concentrations élevées de cytokines pro-inflammatoires (IL-18, IFNα [interféron α]). Parallèlement, l’altération de la dégradation des NET identifiée chez certains patients est due à une protection des NET vis-à-vis de la DNase1 par la liaison d’auto-anticorps et/ou du complément à leur surface. Cette protection par encombrement stérique conduit à une accumulation de NET, responsable d’une stimulation chronique des cellules dendritiques plasmacytoïdes (pDC) via le TLR9 (Toll-like receptor 9). Il en résulte une libération continue d’IFNα, cytokine clé dans la physiopathologie du lupus. Cette cytokine étant également responsable de la sensibilisation des PN à la nétose, il s’établit ainsi une boucle amplificatrice qui pourrait participer à la pérennisation de la réaction auto-immune et à la progression de la maladie [16] (Figure 3).
Les NET constituent également une source d’auto-antigènes potentiels, et des anticorps dirigés contre leurs composants ont été détectés dans le sérum de patients lupiques. Ces anticorps forment avec les NET des complexes immuns capables de stimuler la nétose des PN de donneurs sains, ainsi que la sécrétion d’IFNα par les pDC [16]. Enfin, les NET ont été observés dans les lésions rénales et cutanées de patients lupiques, ce qui renforce l’hypothèse de leur participation aux dommages tissulaires et vasculaires caractérisant cette pathologie. Ils constituent également un composant essentiel des dépôts immuns responsables de la pathogenèse de la glomérulonéphrite lupique [16]. Cette complication est, par ailleurs, fortement corrélée à un défaut de dégradation des NET. Vascularites à ANCA Les vascularites auto-immunes sont des affections rares touchant les vaisseaux sanguins de faible calibre, en particulier ceux des poumons, de la peau et des reins. Elles sont associées à la présence d’auto-anticorps anticytoplasme des PN (ANCA, anti-neutrophil cytoplasmic antibody), anti-MPO et anti-protéinase 3 (PR3), majoritairement. Chez l’homme, plusieurs observations suggèrent l’implication des NET dans la physiopathologie des vascularites auto-immunes. D’une part, la concentration sérique de complexes MPO-ADN dérivés des NET est corrélée à l’activité de la maladie [ 17]. D’autre part, des dépôts de NET peuvent être identifiés dans les biopsies rénales de la majorité des patients. Enfin, il a été montré que les NET sont libérés par les PN stimulés par les ANCA et, comme ceux-ci, contiennent les auto-antigènes cibles des ANCA (MPO et PR3), il s’établit une boucle amplificatrice de production de NET se déposant au niveau des capillaires glomérulaires, pulmonaires, cutanés et perpétuant la stimulation du système immunitaire. Autres maladies auto-immunes Certaines études récentes suggèrent une participation des NET à la physiopathologie d’autres maladies auto-immunes, comme la polyarthrite rhumatoïde (PR), le syndrome de Felty [10,
18], le psoriasis [
19] ou le diabète de type 1 [
20]. En effet, les NET sont présents dans les foyers inflammatoires caractérisant ces pathologies (liquides synoviaux de PR, lésions cutanées de psoriasis, îlots de Langerhans dans le diabète) et les protéines identifiées à leur surface exerceraient, soit un rôle antigénique (PR), soit un rôle d’activation des pDC (psoriasis et diabète de type 1), soit un rôle directement pro-inflammatoire (psoriasis). Cependant, l’implication réelle des NET dans ces pathologies reste encore peu documentée et nécessite des travaux complémentaires. Pathologies thrombotiques La place occupée par les NET au cours du processus de coagulation intéresse de plus en plus la communauté scientifique et médicale, et un nombre croissant d’études démontrent le rôle essentiel des NET au cours des pathologies thrombotiques, aussi bien veineuses qu’artérielles.L’implication des NET dans la physiopathologie de la thrombose a été clairement démontrée dans différents modèles animaux de thrombose veineuse profonde. Dans ces modèles, les NET constituent un composant abondant des thrombus ayant un caractère thrombogène majeur souligné par l’effet protecteur de l’administration de DNase [ 21]. L’effet procoagulant des NET est sous-tendu par leur structure en réseau filamentaire, qui constitue un support facilitant l’adhésion et l’activation plaquettaire. Cette structure leur permet de capturer également les globules rouges, ainsi que différents facteurs de la coagulation, facilitant la formation du thrombus et le déclenchement de la coagulation (Figure 4). De plus, les NET activent les voies intrinsèque et extrinsèque de la coagulation de manière indirecte, par l’action des sérines protéases (élastase et cathepsine G) sur les inhibiteurs de la coagulation, mais également de manière directe, puisque les acides nucléiques des NET activent le FXII (facteur XII) [21] et que, dans certaines pathologies (sepsis, vascularites), les NET expriment le facteur tissulaire à leur surface, permettant ainsi l’activation de la voie extrinsèque de la coagulation [ 22]. Chez l’homme, une étude récente montre que les NET représentent 10 à 30 % de la masse du thrombus dans l’infarctus du myocarde [ 23]. De plus, la quantification des marqueurs de « nétose » circulants présente un intérêt pronostique, puisque le taux de nucléosomes circulants (issus de la dégradation des NET) est corrélé à la sévérité des microangiopathies thrombotiques [ 24] et des crises vaso-occlusives drépanocytaires [ 25]. Enfin, un taux élevé de nucléosomes circulants expose à un risque trois fois plus élevé de thrombose veineuse profonde, indépendamment de la présence d’autres facteurs de risque thrombotique [ 26].
Maladies inflammatoires aiguës et chroniques La formation de NET au cours des maladies inflammatoires aiguës et chroniques est probablement favorisée par les cytokines pro-inflammatoires tissulaires et systémiques. Au cours du sepsis, les lésions endothéliales, l’ischémie tissulaire et les complications thrombotiques induites par les NET participent aux défaillances multiviscérales et à l’augmentation de la mortalité. Plus précisément, dans les modèles expérimentaux de sepsis, les NET s’accumulent au niveau des microcirculations pulmonaire et hépatique, conduisant à une insuffisance hépatocellulaire aiguë et à un syndrome de détresse respiratoire aiguë par hypoperfusion [
27]. Par ailleurs, chez l’homme, la présence de NET a été rapportée dans les prélèvements sanguins d’environ la moitié des patients atteints de sepsis sévère [
28].Au cours des pathologies pulmonaires inflammatoires aiguës comme le syndrome de détresse respiratoire aiguë ou le syndrome respiratoire aigu post-transfusionnel, les plaquettes activées induisent la formation de NET qui s’accumulent au niveau alvéolaire et participent aux lésions épithéliales et endothéliales. En effet, il a été montré que les histones sont capables d’induire une apoptose cellulaire dépendante de la dose [14], et que l’élastase augmente la perméabilité de la barrière alvéolo-capillaire par altération du cytosquelette endothélial. Au cours du sepsis et du syndrome respiratoire aigu post-transfusionnel, des marqueurs circulants de nétose sont présents [ 29]. Durant la pré-éclampsie, certains facteurs d’origine placentaire (IL-8 et microparticules de syncytiotrophoblaste) sont capables d’induire la formation de NET in vitro. Ex vivo, les NET sont abondamment retrouvés au niveau de l’espace intervilleux des placentas et pourraient contribuer aux lésions hypoxiques caractérisant cette pathologie [10]. Dans la goutte, il a été démontré que les cristaux d’urate de sodium étaient capables d’induire la formation de NET, et que ceux-ci étaient protégés de la dégradation par fixation de molécules de CRP (C-reactive protein) et du complément. Les NET pourraient ainsi persister assez longtemps au niveau de l’articulation pour contribuer à l’établissement d’une inflammation chronique [10]. Dans la mucoviscidose, plusieurs études ont démontré la présence abondante de NET dans les expectorations des patients. Les bactéries couramment retrouvées chez ces patients (P. aeruginosa, S. aureus et H. influenzae) sont de bons inducteurs de la nétose, mais sont également capables d’acquérir des mécanismes de résistance aux NET, favorisant ainsi la colonisation bactérienne et participant aux lésions de l’épithélium pulmonaire via l’élastase [10]. Récemment, des NET ont été mis en évidence au sein de coupes histologiques de tumeurs ; ils pourraient exercer un effet protumoral ou antitumoral, selon le type et le stade du cancer ou encore le microenvironnement tumoral [ 30]. L’impact des NET sur l’organisme se complexifie à mesure que les connaissances sur ces structures se développent. Ainsi, en marge de leur rôle anti-infectieux et de leurs différents aspects délétères, il est probable que les NET exercent également une fonction régulatrice. En utilisant un protocole d’isolement et de purification des NET, récemment développé par notre équipe [ 31], nous avons pu montrer un rôle immunomodulateur des NET sur les cellules dendritiques activées (Barrientos et al., manuscrit en révision). | ||||||
Une nétose excessive ou inappropriée engendre des dommages tissulaires importants dans de nombreuses pathologies ; aussi, son inhibition représente une piste thérapeutique prometteuse. Une des stratégies consisterait à moduler la formation des NET en inhibant la PAD4 ou en interagissant avec le métabolisme des formes réactives de l’oxygène (FRO). Par exemple, un composé chimique mimant la superoxyde dismutase (SOD), le tempol, est capable d’inhiber in vitro la « nétose » des PN humains en piégeant les FRO [ 32]. De plus, dans un modèle murin de lupus, il a été montré que l’emploi de chloro-amidine, un inhibiteur des PAD, bloque la libération de NET et améliore les fonctions endothéliales. Ces propriétés en feraient un candidat intéressant pour prévenir le risque cardiovasculaire chez les patients lupiques [ 33]. Une autre stratégie consisterait à interférer avec la structure ou les propriétés des composants des NET. De nombreuses études ont montré, dans les modèles animaux, que le démantèlement des fibres d’ADN des NET par des DNases exogènes exerçait un effet protecteur au cours de diverses situations pathologiques associées à un excès de NET [29, 34, 35]. La DNase est la seule molécule ciblant les NET qui fasse déjà l’objet d’une utilisation en clinique, puisque l’inhalation de DNase recombinante fait partie de l’arsenal thérapeutique de la mucoviscidose, permettant d’améliorer les fonctions pulmonaires et de réduire les exacerbations infectieuses [13]. L’administration de DNase couplée à la neutralisation des histones (par l’emploi d’anticorps spécifiques ou d’acide polysialique, par exemple) ou à celle des protéases constitue donc une piste intéressante contre les effets délétères des NET [12]. Cependant, l’intérêt de ces stratégies en pathologie humaine reste à démontrer par la mise en place d’essais cliniques appropriés. Les effets ambivalents des différentes fonctions du neutrophile sont connus depuis longtemps, et les NET, qualifiés par certains auteurs « d’arme à double tranchant », ne font pas exception à cette règle. Découvert il y a presque 10 ans, le phénomène de nétose reste incomplètement compris. Les voies de signalisation impliquées, notamment celles des formes rapides de « nétose », doivent encore être établies avec certitude. Si les NET ont été décrits initialement comme porteurs d’un effet anti-infectieux, ils ont vite été impliqués dans la physiopathologie de maladies très diverses. Cependant, leur importance in vivo en pathologie humaine n’est pas encore élucidée et la balance entre leurs effets délétères et bénéfiques reste mal appréhendée. Leurs contributions potentielles à un nombre important de pathologies humaines en font une cible diagnostique et thérapeutique prometteuse qui est en cours d’exploration dans de nombreux contextes. | ||||||
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. | ||||||
1.
Brinkmann
V
,
Zychlinsky
A
. Neutrophil extracellular traps: is immunity the second function of chromatin ?
J Cell Biol.
2012; ; 198 : :773.–783. 2.
Kaplan
M J
,
Radic
M
. Neutrophil extracellular traps: double-edged swords of innate immunity . J Immunol.
2012; ; 189 : :2689.–2695. 3.
Gougerot-Pocidalo
MA
,
El Benna
J
,
My-Chan Dang
P
,
Elbim
C
. Quand les polynucléaires neutrophiles attrapent les agents pathogènes dans leurs filets . Med Sci (Paris).
2007; ; 23 : :464.–465. 4.
Farrera
C
,
Fadeel
B
. Macrophage clearance of neutrophil extracellular traps is a silent process . J Immunol.
2013; ; 191 : :2647.–2656. 5.
Pilsczek
FH
,
Salina
D
,
K H Poon
K
, et al.
A novel mechanism of rapid nuclear neutrophil extracellular trap formation in response to Staphylococcus aureus
. J Immunol.
2010; ; 185 : :7413.–7425. 6.
Yousefi, S
,
C
Mihalache
,
E
Kozlowski
, et al.
Viable neutrophils release mitochondrial DNA to form neutrophil extracellular traps . Cell Death Differ.
2009; ; 16 : :1438.–1444. 7.
Byrd
AS
,
O’Brien
XM
,
Johnson
CM
, et al.
An extracellular matrix-based mechanism of rapid neutrophil extracellular trap formation in response to Candida albicans
. J Immunol.
2013; ; 190 : :4136.–4148. 9.
Yipp
BG
,
Petri
B
,
Salina
D
, et al.
Infection-induced NETosis is a dynamic process involving neutrophil multitasking in vivo
. Nat Med.
2012; ; 18 : :1386.–1393. 10.
Branzk
N
,
Papayannopoulos
V
. Molecular mechanisms regulating NETosis in infection and disease . Semin Immunopathol.
2013; ; 35 : :513.–530. 11.
Bianchi
M
,
Hakkim
A
,
Brinkmann
V
, et al.
Restoration of NET formation by gene therapy in CGD controls aspergillosis . Blood.
2009; ; 114 : :2619.–2622. 12.
Saffarzadeh
M
,
Preissner
KT
. Fighting against the dark side of neutrophil extracellular traps in disease: maneuvers for host protection . Curr Opin Hematol.
2013; ; 20 : :3.–9. 13.
Darrah
E
,
Andrade
F.
NETs: The missing link between cell death and systemic autoimmune diseases ?
Front Immunol.
2013; ; 3 : :428.. 14.
Marin-Esteban
V
,
Turbica
I
,
Dufour
G
, et al.
Afa/Dr diffusely adhering Escherichia coli strain C1845 induces neutrophil extracellular traps that kill bacteria and damage human enterocyte-like cells . Infect Immun.
2012; ; 80 : :1891.–1899. 15.
Villanueva
E
,
Yalavarthi
S
,
Berthier
CC
, et al.
Netting neutrophils induce endothelial damage, infiltrate tissues, and expose immunostimulatory molecules in systemic lupus erythematosus . J Immunol.
2011; ; 187 : :538.–552. 16.
Knight
JS
,
Kaplan
MJ
. Lupus neutrophils: ‘NET’ gain in understanding lupus pathogenesis . Curr Opin Rheumatol.
2012; ; 24 : :441.–450. 17.
Kessenbrock
K
,
Krumbholz
M
,
Schönermarck
U
, et al.
Netting neutrophils in autoimmune small-vessel vasculitis . Nat Med.
2009; ; 15 : :623.–625. 18.
Dwivedi
N
,
Upadhyay
J
,
Neeli
I
, et al.
Felty’s syndrome autoantibodies bind to deiminated histones and neutrophil extracellular chromatin traps . Arthritis Rheum.
2012; ; 64 : :982.–992. 19.
Skrzeczynska-Moncznik
J
,
Wlodarczyk
A
,
Banas
M
, et al.
DNA structures decorated with cathepsin G/secretory leukocyte proteinase inhibitor stimulate IFNI production by plasmacytoid dendritic cells . Am J Clin Exp Immunol.
2013; ; 2 : :186.–194. 20.
Diana
J
,
Simoni
Y
,
Furio
L
, et al.
Crosstalk between neutrophils, B-1a cells and plasmacytoid dendritic cells initiates autoimmune diabetes . Nat Med.
2012; ; 19 : :65.–73. 21.
Fuchs
TA
,
Brill
A
,
Wagner
DD
. Neutrophil extracellular trap (NET) impact on deep vein thrombosis . Arterioscler Thromb Vasc Biol.
2012; ; 32 : :1777.–1783. 22.
Kambas
K
,
Mitroulis
I
,
Apostolidou
E
, et al.
Autophagy mediates the delivery of thrombogenic tissue factor to neutrophil extracellular traps in human sepsis . PloS One.
2012; ; 7 : :e45427.. 23.
De Boer
OJ
,
Li
X
,
Teeling
P
, et al.
Neutrophils, neutrophil extracellular traps and interleukin-17 associate with the organisation of thrombi in acute myocardial infarction . Thromb Haemost.
2013; ; 109 : :290.–297. 24.
Fuchs
TA
,
Kremer Hovinga
JA
,
Schatzberg
D
, et al.
Circulating DNA and myeloperoxidase indicate disease activity in patients with thrombotic microangiopathies . Blood.
2012; ; 120 : :1157.–1164. 25.
Schimmel
M
,
Nur
E
,
Biemond
BJ
, et al.
Nucleosomes and neutrophil activation in sickle cell disease painful crisis . Haematologica.
2013; ; 98 : :1797.–1803. 26.
Van Montfoort
ML
,
Stephan
F
,
Lauw
MN
, et al.
Circulating nucleosomes and neutrophil activation as risk factors for deep vein thrombosis . Arterioscler Thromb Vasc Biol.
2013; ; 33 : :147.–151. 27.
Clark
SR
,
Ma
AC
,
Tavener
SA
, et al.
Platelet TLR4 activates neutrophil extracellular traps to ensnare Bacteria in septic blood . Nat Med.
2007; ; 13 : :463.–469. 28.
Hamaguchi
S
,
Hirose
T
,
Akeda
Y
, et al.
Identification of neutrophil extracellular traps in the blood of patients with systemic inflammatory response syndrome . J Int Med Res.
2013; ; 41 : :162.–168. 29.
Caudrillier
A
,
Kessenbrock
K
,
Gilliss
BM
, et al.
Platelets induce neutrophil extracellular traps in transfusion-related acute lung injury . J Clin Invest.
2012; ; 122 : :2661.–2671. 30.
Berger-Achituv
S
,
Brinkmann
V
,
Abed
UA
, et al.
A proposed role for neutrophil extracellular traps in cancer immunoediting . Front Immunol.
2013; ; 4 : :48.. 31.
Barrientos
L
,
Marin-Esteban
V
,
De Chaisemartin
L
, et al.
An improved strategy to recover large fragments of functional human neutrophil extracellular traps . Front Immunol.
2013; ; 4 : :166.. 32.
Hosseinzadeh
A
,
Messer
PK
,
Urban
CF.
Stable redox-cycling nitroxide tempol inhibits NET formation . Front Immunol.
2012; ; 3 : :391.. 33.
Knight
JS
,
Zhao
W
,
Luo
W
, et al.
Peptidylarginine deiminase inhibition is immunomodulatory and vasculoprotective in murine Lupus . J Clin Invest.
2013; ; 123 : :2981.–2993. 34.
Papayannopoulos
V
,
Staab
D
,
Zychlinsky
A.
Neutrophil elastase enhances sputum solubilization in cystic fibrosis patients receiving DNase therapy . PloS One.
2011; ; 6 : :e28526.. 35.
Brill
A
,
Fuchs
TA
,
Savchenko
AS
, et al.
Neutrophil extracellular traps promote deep vein thrombosis in mice . J Thromb Haemost.
2012; ; 10 : :136.–144. | ||||||