| |
| Med Sci (Paris). 2014 May; 30(5): 526–531. Published online 2014 June 13. doi: 10.1051/medsci/20143005015.Lp-PLA2 et sPLA2 Biomarqueurs cardiovasculaires Hafid Ait-Oufella,1,2* Ziad Mallat,1,3 and Alain Tedgui1 1Inserm U970, Paris-centre de recherche cardiovasculaire (PARCC), université Paris Descartes, 56, rue Leblanc, 75015Paris, France 2Service de réanimation médicale, hôpital Saint-Antoine, Assistance publique-hôpitaux de Paris, Paris, France 3Université de Cambridge, département de médecine, Addenbrooke’s hospital, CambridgeCB2 2QQ, Royaume-Uni |
Les maladies cardiovasculaires représentent la première cause de mortalité dans le monde. Elles garderont cette place pour les 30 prochaines années en raison, entre autres, du vieillissement de la population et du mode de vie des pays développés. Parallèlement, la mortalité et la morbidité dues aux maladies cardiovasculaires ont considérablement diminué durant les deux dernières décennies. Une analyse épidémiologique américaine a estimé que 79 % des progrès étaient liés à la prévention primaire et 21 % à la prévention secondaire [
1]. Les patients à risque ont été identifiés grâce à des paramètres cliniques et biologiques, bien caractérisés par le groupe d’étude de Framingham1 [
2]. Cependant, le score élaboré dans cette étude est pris en défaut chez les patients dont le risque est intermédiaire. C’est la raison pour laquelle l’identification de nouveaux biomarqueurs est importante pour mieux stratifier les patients et développer des stratégies thérapeutiques ciblées. Dans cette revue, nous nous sommes intéressés essentiellement à la valeur pronostique de deux phospholipases, la Lp-PLA2 (lipoprotein-associated-PLA2) et la sPLA2 (secretory PLA2), dans le cadre des maladies cardiovasculaires. Nous n’aborderons pas les approches thérapeutiques basées sur la modulation de l’activité des phospholipases endogènes. |
Physiopathologie de l’athérosclérose et phospolipases A2 Les travaux chez l’animal et chez l’homme ont clairement montré que l’athérosclérose est une maladie inflammatoire chronique de la paroi des artères de gros et moyen calibre [
3,
4,
37]. Les différentes étapes de l’athérogenèse comprennent la rétention et la modification oxydative des lipoprotéines dans l’espace sous-endothélial, l’activation et le dysfonctionnement des cellules endothéliales, puis l’adhésion, la migration et l’activation des leucocytes dans la paroi vasculaire. Les monocytes recrutés deviennent des macrophages qui captent des lipoprotéines modifiées via des récepteurs scavengers et se transforment en cellules spumeuses. À la suite de l’accumulation de cellules inflammatoires et de lipides extracellulaires, les plaques d’athérosclérose s’organisent avec la formation d’un noyau nécrotique au contact de cellules inflammatoires, entourées d’une chape fibreuse. Ces plaques peuvent s’éroder ou se rompre et provoquer une thrombose artérielle bruyante qui s’exprime par un infarctus du myocarde à l’étage coronaire ou un accident vasculaire cérébral au niveau carotidien. L’athérosclérose est une pathologie complexe où sont intriqués des facteurs métaboliques et inflammatoires, à la fois dans le développement de la maladie et dans ses complications. Les phospholipases A2 (PLA2) forment une famille d’enzymes qui hydrolysent les acides gras estérifiés des glycérophospholipides en position sn-2, produisant ainsi des acides gras (comme l’acide arachidonique) et des lysophospholipides (comme la lysophosphatidylcholine) [
5]. Les PLA2 sont, soit cytoplasmiques, soit sécrétées sous formes libres (sPLA2) ou liées aux lipoprotéines (Lp-PLA2). La Lp-PLA2 circule sous forme active dans le plasma [
6]. Elle est produite essentiellement par les monocytes/macrophages et les lymphocytes T. La majorité de la Lp-PLA2 est liée dans le plasma aux petites particules denses de LDL (low density lipoprotein). Elle hydrolyse le PAF (platelet activating factor), mais également un large éventail de phospholipides [
7]. L’hydrolyse par la Lp-PLA2 produit essentiellement de la lysophosphatidylcholine, qui induit le recrutement monocytaire et la dégranulation des polynucléaires neutrophiles [
8]. Les sPLA2 sont également produites par les cellules de l’immunité naturelle (monocytes/macrophages) et adaptative (lymphocytes T) [
9], et par les cellules de la paroi vasculaire [
38] (→). Les sPLA2 des groupes IIA (GIIA), III (GIII) et V (GV) ont été identifiées dans les plaques d’athérosclérose chez la souris et chez l’homme [
10]. Les souris génétiquement modifiées (inhibition et surexpression) ont permis de montrer que les sPLA2 GIIA, GIII et GV sont pro-athérogènes. L’inhibition de ces enzymes ralentit le développement de l’athérosclérose et leur surexpression s’accompagne d’une augmentation de la taille des lésions [
11–
13]. Bien que la plupart des isoformes de sPLA2 soient pro-athérogènes, les mécanismes par lesquels elles participent au développement de la maladie vasculaire sont multiples (Tableau I). Les sPLA2 génèrent des médiateurs lipidiques pro-inflammatoires, augmentent le potentiel pro-athérogène des particules de LDL, favorisent la formation des cellules spumeuses et activent la réponse inflammatoire, indépendamment de leurs propriétés catalytiques [5]. Plus récemment, il a été montré a contrario que la phospholipase A2 du groupe X inhibe le développement de l’athérosclérose expérimentale (Figure 1) en bloquant la réponse lymphocytaire T CD4+ de type Th1 [
14]. Le fait que certaines phospholipases soient pro-athérogènes et d’autres plutôt anti-inflammatoires et anti-athérogènes, explique, au moins en partie, l’échec des approches thérapeutiques utilisant des inhibiteurs non spécifiques des sPLA2 dans les pathologies cardiovasculaires.
(→) Voir la Synthèse de C.A. Girard et al., page 519 de ce numéro
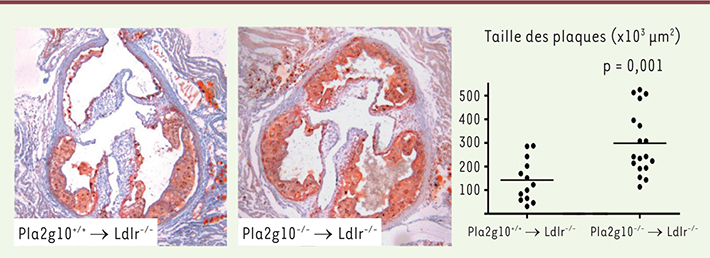
 | Figure 1.
La déficience leucocytaire en phospholipase A2 du groupe X (Pla2g10) induit une accélération de l’athérosclérose. Des souris Ldlr-/-
, sensibles à l’athérosclérose, ont été irradiées et transplantées avec de la moelle osseuse de souris contrôles ( Pla2g10+/+
) ou déficientes en Pla2g10 ( Pla2g10-/-
). Les plaques d’athérosclérose au niveau du sinus aortique ont été mesurées après huit semaines de régime riche en matières grasses. Adapté de [ 14]. |
Tableau I.
| Cibles des PLA2 dans l’athérosclérose |
Action |
| Lipides |
Hydrolysent les phospholipides et induisent la libération de prostaglandines et de leucotriènes |
|
Augmentent le potentiel pro-athérogène des LDL (plus petites et plus denses)
Favorisent l’oxydation des LDL |
|
| Cellules vasculaires |
Activent les cellules endothéliales |
|
| Cellules de l’immunité innée |
Favorisent la formation des cellules spumeuses |
|
Activent les monocytes/macrophages |
|
| Cellules de l’immunité adaptative |
Activent les lymphocytes T CD4+
|
Principaux mécanismes d’action des phospholipases A2 dans le développement de l’athérosclérose.
|
Ces éléments physiopathologiques font des phospholipases des marqueurs potentiellement intéressants des maladies cardiovasculaires, participant à la fois au métabolisme lipidique et à la réponse immuno-inflammatoire [
15]. |
Lp-PLA2 et risque cardiovasculaire Chez les personnes indemnes de maladies cardiovasculaires L’intérêt de la Lp-PLA2 comme biomarqueur cardiovasculaire est apparu après la publication de l’étude WOSCOPS ( west of Scotland coronary prevention study) qui a montré une association positive entre le taux de Lp-PLA2 et les évènements coronariens chez les hommes ayant une hypercholestérolémie [
16]. Cette association persistait après ajustement sur les facteurs de risque cardiovasculaires classiques, contrairement à d’autres biomarqueurs, comme le taux de leucocytes sanguins, la CRP (C- reactive protein) et le fibrinogène. Les résultats d’autres études menées dans différents pays sont variables, tantôt confirmant ces données, tantôt les infirmant (pour revue voir [ 15]). Une méta-analyse a été publiée récemment [
17]. Elle regroupe 32 études prospectives ayant inclus 79 000 participants (35 945 sujets sans antécédent de maladie vasculaire au départ, 32 453 patients ayant des antécédents de coronaropathie stable, et 10 638 patients chez lesquels un diagnostic de syndrome coronarien aigu a été porté (Tableau II). Les analyses ont été ajustées en fonction de l’âge, du sexe, des antécédents cardiovasculaires, ainsi que des facteurs de risque lipidiques et non lipidiques. Chez les sujets sains, aucune association n’a été trouvée entre l’activité de la Lp-PLA2 et la maladie coronarienne ou les accidents cérébraux ischémiques. En revanche, le risque relatif de maladie coronaire associé à la masse Lp-PLA2 était de 1,09 (intervalle de confiance 95 % [1,02-1,16]). Par conséquent, la valeur de la Lp-PLA2 pour prédire la survenue de coronaropathie chez les sujets indemnes de maladie cardiovasculaire est probablement modeste.
Tableau II.
| Marqueurs |
Études |
Populations |
Critères d’évaluation |
Risques (IC 95 %) |
Réf. |
| Lp-PLA2 |
Méta-analyse de 32 études, 79 000 sujets |
Indemnes de maladies cardiovasculaires |
Maladie coronaire |
Activité RR 1,17 (1,09-1,27) |
[17] |
| PEACE
3 766 patients |
Coronariens stables |
Critère composite (mortalité CV, SCA, AVC, revascularisation) |
Masse HR 1,41 (1,17-1,70) 4e quartile vs 1e quartile |
[
19] |
| FRISCII 1362 patients
GUSTO IV 904 patients |
Syndrome coronarien aigu |
Mortalité |
Masse HR 1,4 (0,77-2,50)
3e tertile vs 1er tertile |
[
20] |
| NOMAS
467 patients |
1er épisode d’AVC |
Critère composite (mortalité CV, SCA, récidive d’AVC) |
Masse HR 1,86 (1,01-3,42)
Activité 1,69 (0,76-3,76) |
[
25,
26] |
|
| sPLA2 |
EPIC-Norfolk :
masse, 1105 sujets
activité, 991 sujets |
Indemnes de maladies cardiovasculaires |
Maladie coronaire, mortelle ou non |
Masse OR 1,34 (1,02-1,71)
4e quartile vs 1er quartile
Activité OR 1,65 (1,27-2,12) |
[
28,
[
29] |
| 3 738 patients |
Coronariens stables |
Critère composite (mortalité CV, SCA, AVC) |
Activité HR 1,49 (1,08-2,06)
4e quartile vs 1er quartile |
[
21] |
| 446 patients |
Syndrome coronarien aigu |
Mortalité ou infarctus |
Activité HR 3,08 (1,37-6,91)
3e tertile vs 1er 2e tertile
Masse IIA HR 1,9
(0,96-3,6) (univariée) |
[
34] |
| Méta-analyse
de 36 études (109 179 patients
dont 18 355 SCA) |
Syndrome coronarien aigu |
Mortalité (A)
Infarctus (B) |
A : OR 0,93 (0,84-1,04)
B : OR 0,82 (0,69-0,98) |
[
36] |
Principales études évaluant la valeur pronostique de la Lp-PLA2 et sPLA2 dans les pathologies cardiovasculaires. SCA : syndrome coronarien aigu ; CV : cardiovasculaire ; AVC : accident vasculaire cérébral ; RR, risque relatif ; HR : hazard ratio ; OR : odds ratio. Réf. : références ; vs : versus. Adapté de [ 15]. |
Chez les patients ayant une maladie coronaire stable Les données concernant la valeur pronostique de Lp-PLA2 sont plus convaincantes chez les patients atteints de coronaropathie stable. Les premières publications sur ce sujet comprenaient un nombre peu important de patients. Dans l’étude de la Mayo Clinic, qui incluait des patients bénéficiant d’une coronarographie, un taux élevé de Lp-PLA2 (masse) était associé à un risque plus élevé d’événements cardiovasculaires dans les quatre années suivantes [
18]. L’étude la plus importante a été rapportée par Sabatine et al. [ 19] avec des données provenant de l’étude PEACE ( prevention of events with angiotensin-converting enzyme inhibition) (Tableau II). La Lp-PLA2 (masse) a été mesurée chez 3 766 patients ayant une coronaropathie stable avec un suivi médian d’environ cinq ans. Après ajustement sur des facteurs de risque traditionnels multiples et sur la CRP ultrasensible (hs-CRP), les patients dont la Lp-PLA2 se situait dans les quartiles supérieurs avaient un risque significativement plus élevé pour le critère composite regroupant décès cardiovasculaire, infarctus du myocarde, revascularisation coronaire, angor instable, ou accident vasculaire cérébral. L’association était plus prononcée pour la prédiction des accidents cardiovasculaires non mortels, l’angine de poitrine instable et, particulièrement, la revascularisation coronaire. Dans sa méta-analyse, le groupe international de recherche sur la Lp-PLA2 confirmait que le risque de maladie coronarienne chez les patients atteints de maladie vasculaire stable augmentait progressivement pour chaque élévation d’une déviation standard de la Lp-PLA2 (masse et activité) [ 17]. Chez les patients ayant un syndrome coronarien aigu Contrairement aux données obtenues chez les patients ayant une coronaropathie stable, les données actuelles suggèrent que la Lp-PLA2 n’améliore pas la prédiction d’évènements chez les patients ayant une maladie instable. Deux études de petite taille retrouvaient une association, mais uniquement dans un sous-groupe. Malheureusement, les études de grande envergure, comme FRISC II ( fast revascularisation during instability in coronary artery disease) et GUSTO IV ( global use of strategy to open occluded coronary arteries) ne retrouvaient aucune association entre les taux de Lp-PLA2 et la récidive d’évènements cardiovasculaires majeurs [ 20] (Tableau II). La plus grande étude sur le sujet a été menée par O’Donoghue et al., qui ont mesuré les concentrations de Lp-PLA2 chez 3 648 patients hospitalisés pour un syndrome coronarien aigu [ 21]. De nouveau, les niveaux de Lp-PLA2 mesurés au moment de l’admission n’ont montré aucune association avec le critère de jugement principal (mort, infarctus du myocarde, angor instable, revascularisation ou accident vasculaire cérébral). Une association modérée a été constatée lorsque la Lp-PLA2 était dosée à J30. La méta-analyse de Thompson et al. confirme l’absence d’association entre Lp-PLA2 et risque cardiovasculaire chez les patients présentant une maladie coronaire instable [ 17]. Lp-PLA2 et accidents vasculaires cérébraux Persson et al. ont suivi 5 393 sujets, a priori sains, pendant trois ans. Cent cinquante-deux accidents vasculaires cérébraux ont été enregistrés. Dans cette étude, la masse de Lp-PLA2 et son activité étaient associées à la survenue d’accidents ischémiques [
22]. Dans un autre travail mené chez des individus sains, cette association a été confirmée et permettait également d’affiner le risque cardiovasculaire des sujets définis comme à risque intermédiaire à partir des facteurs de risques classiques [
23]. Cet enthousiasme a été freiné par les résultats négatifs de l’étude WHIO ( women’s health initiative observationnal), qui ne retrouvait pas cette association. Cependant, l’utilisation d’hormonothérapie substitutive dans cette dernière étude peut constituer un facteur de confusion et doit rendre prudente l’analyse des données [
24]. Chez les patients indemnes de maladie vasculaire cérébrale, des études prospectives sont encore nécessaires pour clarifier la relation entre la Lp-PLA2 et le risque d’accident vasculaire cérébral. Deux études ont évalué la valeur pronostique de la Lp-PLA2 en prévention secondaire. En utilisant les données de NOMAS (the northern Manhattan study), qui incluait des patients ayant eu un premier accident vasculaire cérébral ischémique, Elkind et al. ont rapporté un risque accru de récidive d’accident vasculaire cérébral d’autant plus important que le taux de Lp-PLA2 (masse [25] ou activité [26]) était élevé. Ces résultats sont en accord avec une étude réalisée chez des patients avec un accident ischémique transitoire : des taux élevés de Lp-PLA2 (activité) étaient associés à un mauvais pronostic, le critère de jugement étant composite (accident vasculaire cérébral constitué, décès à J90) [
27]. |
sPLA2 et risque cardiovasculaire Chez les personnes indemnes de maladie cardiovasculaire Contrairement à la Lp-PLA2, seules quelques études ont évalué le dosage de la sPLA2 pour prédire le risque cardiovasculaire. Deux publications sur la même population, EPIC-Norfolk, ont examiné la mesure de la masse sPLA2 de type IIA (qui représente la majorité des sPLA2) ou de l’activité totale sPLA2, comme facteur prédictif de la survenue d’une maladie coronaire (cas-témoin) [ 28, 29]. L’activité sPLA2 était significativement associée aux facteurs de risque traditionnels, y compris la hs-CRP. La masse sPLA2-IIA et l’activité totale sPLA2 étaient significativement associées à la survenue d’un premier évènement coronaire au cours du suivi. Il y avait une corrélation significative, mais faible, entre la masse sPLA2-IIA et l’activité sPLA2 ( r = 0,20), avec une meilleure valeur prédictive pour l’activité sPLA2. Ces résultats doivent être confirmés sur une autre cohorte. sPLA2 chez les patients atteints de coronaropathie stable Peu d’études se sont intéressées à la valeur pronostique de la sPLA2 chez les patients atteints de coronaropathie stable. La première étude comprenait des patients avec des lésions coronaires stables prouvées par angiographie [
30]. Les taux de la masse sPLA2-IIA étaient plus élevés chez ces patients que chez les individus contrôles indemnes de lésions. De plus, les niveaux élevés de sPLA2 étaient indépendamment associés à une évolution défavorable (décès d’origine coronarienne, infarctus du myocarde, revascularisation coronarienne). Dans l’étude KAROLA, les chercheurs ont mesuré la masse et l’activité sPLA2-IIA chez les patients ayant une coronaropathie stable. La corrélation entre la masse et l’activité était relativement bonne ( r = 0,63), et les deux mesures étaient significativement associées à une issue défavorable [
31]. La plus grande étude ayant évalué la valeur pronostique de la sPLA2 dans un cadre de coronaropathie stable est PEACE [
32]. Dans une analyse multivariée qui incluait la Lp-PLA2 et la CRP, les niveaux élevés d’activité sPLA2 restaient indépendamment associés à un risque cardiovasculaire accru. L’ensemble de ces éléments confirment le rôle de l’activité sPLA2 dans la prédiction du risque cardiovasculaire chez les patients atteints de coronaropathie stable. Cependant, d’autres études sont nécessaires pour établir son utilité clinique dans la prise en charge des patients coronariens. sPLA2 chez les patients présentant un syndrome coronarien aigu Dans une première étude de patients souffrant d’angor instable, Kugiyama et al. ont montré que des niveaux élevés de masse sPLA2-IIA mesurés lors de l’admission du patient étaient associés à une récidive accrue d’événements coronaires [
33]. Cependant, l’analyse plus précise montre que la majorité de ces événements étaient des ré-admissions, une revascularisation coronarienne ou un angor instable. En revanche, on notait un seul infarctus du myocarde et quatre décès d’origine coronaire. Dans une sous-étude du registre GRACE ( global registry of acute coronary events) qui incluait des patients présentant un syndrome coronarien aigu, Mallat et al. ont rapporté qu’un taux élevé de sPLA2 à l’admission était associé à un risque accru de décès ou d’infarctus du myocarde [ 34]. Plus récemment, ces résultats ont été confirmés dans une cohorte de patients admis pour infarctus aigu du myocarde (FAST-MI, french registry of acute ST elevation or non-ST-elevation myocardial infarction). Les niveaux de l’activité sPLA2 étaient associés à un risque composite de décès toutes causes confondues, récidive d’infarctus et survenue d’accident vasculaire cérébral. Cette association persistait après ajustement pour des facteurs connus, la CRP, et le traitement qui comprenait les statines [
35].Collectivement, ces résultats confirment un rôle de l’activité sPLA2 dans la prédiction d’un résultat défavorable chez les patients présentant un syndrome coronarien aigu. Cependant, les espoirs portant sur la sPLA2 comme une cible dans les maladies cardiovasculaires ont été atténués par la publication récente d’une étude de grande envergure qui a regroupé plus de 30 cohortes totalisant environ 100 000 sujets. Les auteurs ont montré qu’un polymorphisme du gène codant pour la PLA2 du groupe IIA (rs11573156) était certes associé à une diminution de la sPLA2 plasmatique (taux et l’activité) mais, malheureusement, n’était pas associé à une augmentation du risque cardiovasculaire [36]. |
Les phospholipases A2 participent au métabolisme lipidique et à la réponse immuno-inflammatoire, étapes clés de la physiopathologie du développement de l’athérosclérose et de ses complications. À partir des modèles expérimentaux, elles sont apparues comme des candidats séduisants pour prédire le risque cardiovasculaire chez l’homme. Plusieurs études épidémiologiques ont confirmé leur valeur pronostique du risque cardiovasculaire, aussi bien en prévention primaire que secondaire, au niveau coronaire ou carotidien. La Lp-PLA2 est utile essentiellement chez les patients ayant une coronaropathie stable. En revanche, la sPLA2 apporte des informations pronostiques, à la fois chez les patients indemnes de lésions coronaires et chez ceux ayant une maladie vasculaire connue stable ou instable. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Young
F
,
Capewell
S
,
Ford
ES
,
Critchley
JA
. Coronary mortality declines in the US between 1980 and 2000 quantifying the contributions from primary and secondary prevention . Am J Prev Med.
2010; ; 39 : :228.–234. 2.
Wilson
PW
,
Evans
JC
. Coronary artery disease prediction . Am J Hypertens.
1993; ; 6 : :309S.–313S. 3.
Tedgui
A
,
Mallat
Z
. Cytokines in atherosclerosis: pathogenic and regulatory pathways . Physiol Rev.
2006; ; 86 : :515.–581. 4.
Ait-Oufella
H
,
Taleb
S
,
Mallat
Z
,
Tedgui
A
. Recent advances on the role of cytokines in atherosclerosis . Arterioscler Thromb Vasc Biol.
2011; ; 31 : :969.–979. 5.
Lambeau
G
,
Gelb
MH
. Biochemistry and physiology of mammalian secreted phospholipases A2 . Annu Rev Biochem.
2008; ; 77 : :495.–520. 6.
Stafforini
DM
. Biology of platelet-activating factor acetylhydrolase (PAF-AH, lipoprotein associated phospholipase A2) . Cardiovasc Drugs Ther.
2009; ; 23 : :73.–83. 7.
McIntyre
TM
,
Prescott
SM
,
Stafforini
DM
. The emerging roles of PAF acetylhydrolase . J Lipid Res.
2009; ; 50
(Suppl) : :S255.–S259. 8.
Silva
IT
,
Mello
AP
,
Damasceno
NR.
Antioxidant and inflammatory aspects of lipoprotein-associated phospholipase A(2) (Lp-PLA(2)): a review . Lipids Health Dis.
2011; ; 10 : :170.. 9.
Triggiani
M
,
Granata
F
,
Frattini
A
,
Marone
G
. Activation of human inflammatory cells by secreted phospholipases A2 . Biochim Biophys Acta.
2006; ; 1761 : :1289.–1300. 10.
Kimura-Matsumoto
M
,
Ishikawa
Y
,
Komiyama
K
, et al.
Expression of secretory phospholipase A2s in human atherosclerosis development . Atherosclerosis.
2008; ; 196 : :81.–91. 11.
Bostrom
MA
,
Boyanovsky
BB
,
Jordan
CT
, et al.
Group v secretory phospholipase A2 promotes atherosclerosis: evidence from genetically altered mice . Arterioscler Thromb Vasc Biol.
2007; ; 27 : :600.–606. 12.
Webb
NR
,
Bostrom
MA
,
Szilvassy
SJ
, et al.
Macrophage-expressed group IIA secretory phospholipase A2 increases atherosclerotic lesion formation in LDL receptor-deficient mice . Arterioscler Thromb Vasc Biol.
2003; ; 23 : :263.–268. 13.
Sato
H
,
Kato
R
,
Isogai
Y
, et al.
Analyses of group III secreted phospholipase A2 transgenic mice reveal potential participation of this enzyme in plasma lipoprotein modification, macrophage foam cell formation, and atherosclerosis . J Biol Chem.
2008; ; 283 : :33483.–33497. 14.
Ait-Oufella
H
,
Herbin
O
,
Lahoute
C
, et al.
Group X secreted phospholipase A2 limits the development of atherosclerosis in LDL receptor-null mice . Arterioscler Thromb Vasc Biol.
2013; ; 33 : :466.–473. 15.
Mallat
Z
,
Lambeau
G
,
Tedgui
A
. Lipoprotein-associated and secreted phospholipases A in cardiovascular disease: roles as biological effectors and biomarkers . Circulation.
2010; ; 122 : :2183.–2200. 16.
Packard
CJ
,
O’Reilly
DS
,
Caslake
MJ
, et al.
Lipoprotein-associated phospholipase A2 as an independent predictor of coronary heart disease. West of Scotland Coronary Prevention Study Group . N Engl J Med.
2000; ; 343 : :1148.–1155. 17.
Thompson
A
,
Gao
P
,
Orfei
L
, et al.
Lipoprotein-associated phospholipase A(2) and risk of coronary disease, stroke, and mortality: collaborative analysis of 32 prospective studies . Lancet.
2010; ; 375 : :1536.–1544. 18.
Brilakis
ES
,
McConnell
JP
,
Lennon
RJ
, et al.
Association of lipoprotein-associated phospholipase A2 levels with coronary artery disease risk factors, angiographic coronary artery disease, and major adverse events at follow-up . Eur Heart J.
2005; ; 26 : :137.–144. 19.
Sabatine
MS
,
Morrow
DA
,
O’Donoghue
M
, et al.
Prognostic utility of lipoprotein-associated phospholipase A2 for cardiovascular outcomes in patients with stable coronary artery disease . Arterioscler Thromb Vasc Biol.
2007; ; 27 : :2463.–2469. 20.
Oldgren
J
,
James
SK
,
Siegbahn
A
,
Wallentin
L
. Lipoprotein-associated phospholipase A2 does not predict mortality or new ischaemic events in acute coronary syndrome patients . Eur Heart J.
2007; ; 28 : :699.–704. 21.
O’Donoghue
M
,
Morrow
DA
,
Sabatine
MS
, et al.
Lipoprotein-associated phospholipase A2 and its association with cardiovascular outcomes in patients with acute coronary syndromes in the PROVE IT-TIMI 22 (PRavastatin Or atorVastatin Evaluation and Infection Therapy-Thrombolysis In Myocardial Infarction) trial . Circulation.
2006; ; 113 : :1745.–1752. 22.
Persson
M
,
Berglund
G
,
Nelson
JJ
,
Hedblad
B
. Lp-PLA2 activity and mass are associated with increased incidence of ischemic stroke: a population-based cohort study from Malmo, Sweden . Atherosclerosis.
2008; ; 200 : :191.–198. 23.
Ballantyne
CM
,
Hoogeveen
RC
,
Bang
H
, et al.
Lipoprotein-associated phospholipase A2, high-sensitivity C-reactive protein, and risk for incident ischemic stroke in middle-aged men and women in the atherosclerosis risk in communities (ARIC) study . Arch Intern Med.
2005; ; 165 : :2479.–2484. 24.
Wassertheil-Smoller
S
,
Kooperberg
C
,
McGinn
AP
, et al.
Lipoprotein-associated phospholipase A2, hormone use, and the risk of ischemic stroke in postmenopausal women . Hypertension.
2008; ; 51 : :1115.–1122. 25.
Elkind
MS
,
Tai
W
,
Coates
K
, et al.
High-sensitivity C-reactive protein, lipoprotein-associated phospholipase A2, and outcome after ischemic stroke . Arch Intern Med.
2006; ; 166 : :2073.–2080. 26.
Elkind
MS
,
Tai
W
,
Coates
K
, et al.
Lipoprotein-associated phospholipase A2 activity and risk of recurrent stroke . Cerebrovasc Dis.
2009; ; 27 : :42.–50. 27.
Cucchiara
BL
,
Messe
SR
,
Sansing
L
, et al.
Lipoprotein-associated phospholipase A2 and C-reactive protein for risk-stratification of patients with TIA . Stroke.
2009; ; 40 : :2332.–2336. 28.
Mallat
Z
,
Benessiano
J
,
Simon
T
, et al.
Circulating secretory phospholipase A2 activity and risk of incident coronary events in healthy men and women: the EPIC-Norfolk study . Arterioscler Thromb Vasc Biol.
2007; ; 27 : :1177.–1183. 29.
Boekholdt
SM
,
Keller
TT
,
Wareham
NJ
, et al.
Serum levels of type II secretory phospholipase A2 and the risk of future coronary artery disease in apparently healthy men and women: the EPIC-Norfolk prospective population study . Arterioscler Thromb Vasc Biol.
2005; ; 25 : :839.–846. 30.
Kugiyama
K
,
Ota
Y
,
Takazoe
K
, et al.
Circulating levels of secretory type II phospholipase A(2) predict coronary events in patients with coronary artery disease . Circulation.
1999; ; 100 : :1280.–1284. 31.
Koenig
W
,
Vossen
CY
,
Mallat
Z
, et al.
Association between type II secretory phospholipase A2 plasma concentrations and activity and cardiovascular events in patients with coronary heart disease . Eur Heart J.
2009; ; 30 : :2742.–2748. 32.
MZ
O’Donoghue ML
,
Morrow
DA
,
Benessiano
J
, et al.
The prognostic utility of secretory phospholipase A2 in patients with stable coronary artery disease . Circulation. , 2009; ; 120 : :S452.. 33.
Kugiyama
K
,
Ota
Y
,
Sugiyama
S
, et al.
Prognostic value of plasma levels of secretory type II phospholipase A2 in patients with unstable angina pectoris . Am J Cardiol.
2000; ; 86 : :718.–722. 34.
Mallat
Z
,
Steg
PG
,
Benessiano
J
, et al.
Circulating secretory phospholipase A2 activity predicts recurrent events in patients with severe acute coronary syndromes . J Am Coll Cardiol.
2005; ; 46 : :1249.–1257. 35.
Simon
MZT
,
Kotti-Tounsi
S
,
Benessiano
J
, et al.
Impact of secretory PLA2-IIA gene polymorphisms on sPLA2 activity, cardiovascular events following an AMI: results from the French register of acute ST elevation or non-ST elevation myocardial infarction . Circulation.
2009; ; 120 : :S1174.. 36.
Holmes
MV
,
Simon
T
,
Exeter
HJ
, et al.
Secretory phospholipase A(2)-IIA and cardiovascular disease: a mendelian randomization study . J Am Coll Cardiol.
2013; ; 62 : :1966.–1976. 37.
Varthaman
A
,
Khallou-Laschet
J
,
Thaunat
O
, et al.
L’athérogenèse : une maladie dysimmunitaire . Med Sci (Paris).
2008; ; 24 : :169.–176. 38.
Girard
CA
,
Seitz-Polski
B
,
Dolla
G
, et al.
Nouveaux rôles physiopathologiques pour le récepteur PLA2R1 dans le cancer et la glomérulonéphrite extramembraneuse . Med Sci (Paris).
2014; ; 30 : :519.–525. |