| |
| Med Sci (Paris). 2014 April; 30(4): 355–357. Published online 2014 May 5. doi: 10.1051/medsci/20143004006.Les tumeurs dormantes prises au piège de la récidive Nicolas Boisgerault1* and Richard G. Vile1** 1Mayo Clinic, Department of Molecular Medicine, 200 First Street SW, Guggenheim 18, Rochester, MN, 55905, États-Unis MeSH keywords: Humains, Récidive tumorale locale, diagnostic, étiologie |
Le suivi des tumeurs dormantes et la détection précoce des récidives tumorales constituent des défis majeurs en cancérologie. La phase de dormance est la période durant laquelle certaines cellules malignes ayant échappé au traitement de la tumeur primaire demeurent au site tumoral à l’état latent [
1]. Chez les patients, cette période peut s’étendre de plusieurs mois à plusieurs années et précède souvent l’émergence de récidives agressives, conséquences de profondes modifications phénotypiques acquises sous la pression de sélection du microenvironnement, des cellules immunitaires et des traitements antitumoraux. Les mécanismes qui président à la réactivation des tumeurs dormantes sont largement méconnus et il demeure extrêmement difficile de prédire l’émergence de récidives ou leur sensibilité aux traitements disponibles. Afin d’étudier les mécanismes tumoraux impliqués dans ces différents stades de la progression tumorale, nous avons récemment développé différents modèles murins de mélanome et d’adénocarcinome de la prostate. Dans ces modèles, les cellules tumorales sont traitées de façon sous-optimale par immunothérapie, virothérapie ou chimiothérapie afin de provoquer une régression significative de la tumeur primaire tout en permettant la survie de quelques cellules à l’état latent, puis l’émergence de récidives. Dans un travail précédent, nous avions ainsi identifié une sous-population de cellules tumorales, responsables de l’initiation du processus de récidive, qui présentent des propriétés plastiques leur permettant d’ajuster leur phénotype en fonction des pressions de l’environnement [
2]. Ces cellules se caractérisent notamment par une surexpression transitoire de la topoisomérase-IIα qui peut être ciblée de façon spécifique par l’utilisation de doxorubicine afin de prévenir l’émergence de récidives. |
Détection précoce des récidives tumorales Notre dernière étude visait à caractériser plus précisément les tumeurs dormantes et à déterminer si les récidives pouvaient être détectées à un stade précoce et avant tout autre signe clinique [
3]. Des travaux précédents [
4], en particulier sur la transition angiogénique [
5,
6] (→), suggéraient notamment que certaines cytokines intervenaient dans ces mécanismes. Nous avons effectivement découvert que l’apparition de récidives chez l’animal était précédée de la sécrétion transitoire de vascular endothelial growth factor (Vegf) et d’interleukine-6 (IL-6), qui pouvaient être détectés de façon systémique dans le sérum. En combinant l’utilisation d’un plasmide contenant le gène de la luciférase sous le contrôle du promoteur du gène Vegf et l’imagerie de bioluminescence in vivo, l’apparition de récidives pouvait ainsi être anticipée jusqu’à douze jours avant que la tumeur ne devienne décelable par les techniques classiques.
(→) Voir m/s n° 12, décembre 2012, page 1069
Les sécrétions de Vegf et d’IL-6 sont liées à l’activation d’une réponse immunitaire innée qui reconnaît la reprise soudaine de la prolifération tumorale. Afin d’échapper à cette réponse immune puis d’évoluer vers une récidive de taille plus importante, les cellules malignes doivent alors modifier leur phénotype en profondeur. Nous avons ainsi montré qu’au cours du processus de récidive, ces cellules acquièrent une forte insensibilité aux effecteurs innés, tout en étant reconnues plus efficacement par les cellules de l’immunité adaptative. La caractérisation de ces différents phénotypes a ensuite permis de développer des thérapies dirigées contre différents stades de l’évolution tumorale : alors que les récidives précoces restent sensibles à des traitements en relation avec l’immunité innée (interféron α), les récidives plus avancées sont, elles, ciblées plus efficacement par transfert adoptif de lymphocytes T ou par l’utilisation de virus oncolytiques du fait de leur insensibilité aux mécanismes antiviraux innés [
7] (→).
(→) Voir m/s n° 2, février 2013, page 165
|
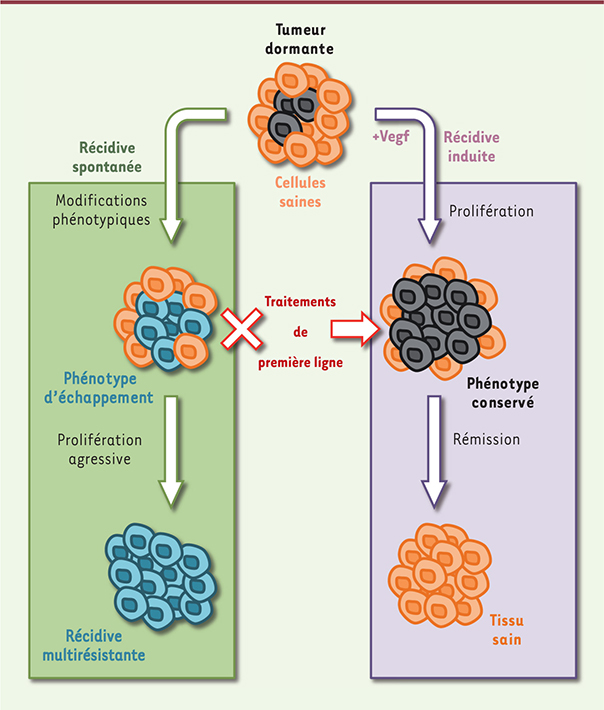
Réactivation préventive des tumeurs dormantes La suite de notre travail montre qu’il est possible d’agir dès la phase de dormance, en adoptant une stratégie thérapeutique active plutôt qu’attentiste. Le suivi à long terme des patients en rémission comporte de nombreux défis et la possibilité d’agir de façon préventive sur l’émergence de récidives revêt donc un intérêt particulier. L’idée est ici de forcer les cellules tumorales à sortir de leur phase de dormance avant qu’elles n’aient pu évoluer complètement, sous la pression des cellules immunitaires, vers un phénotype agressif et résistant notamment à l’immunité innée (Figure 1). Nous avons ainsi découvert que l’injection de Vegf pendant la phase de dormance permettait d’induire la réactivation de la prolifération des cellules tumorales, mais que ces récidives artificiellement induites étaient ensuite traitées efficacement par les thérapies préalablement utilisées contre la tumeur primaire. Bien que surprenants, ces résultats trouvent pourtant un écho dans certaines pratiques cliniques actuelles, dont celle qui consiste à injecter de la thyrotropine aux patients en rémission de cancers de la thyroïde dans le but de débusquer d’éventuelles tumeurs dormantes résiduelles [
8]. Le diagnostic et la décision de traiter de nouveau les patients en sont alors améliorés.
 | Figure 1.
Induction préventive des récidives tumorales. Après le traitement de la tumeur primaire, certaines cellules peuvent survivre au site tumoral dans un état latent. Suite à leur réactivation, ces cellules subissent une évolution phénotypique qui permet notamment d’échapper à l’immunité innée que la reprise de leur prolifération a induite. Cette évolution produit des récidives extrêmement agressives résistantes aux traitements de première ligne. L’injection de Vegf (vascular endothelial growth factor) pendant la phase de dormance permet de réactiver prématurément les cellules malignes afin d’induire leur prolifération. Dans cette situation, les récidives ne présentent pas de phénotype d’échappement et peuvent être retraitées efficacement par les thérapies utilisées précédemment contre la tumeur primaire. |
Ces résultats obtenus dans des modèles animaux restent évidemment à confirmer au niveau clinique pour des tumeurs ayant évolué à long terme chez des patients. Cependant, on sait que les pratiques cliniques actuelles qui consistent à attendre la réactivation spontanée des cellules malignes dormantes ne répondent qu’imparfaitement aux problèmes posés par les récidives tumorales. Piéger les cellules dormantes en créant de façon temporaire un environnement favorable à leur réactivation permet ainsi de favoriser leur détection, mais aussi de prévenir leur évolution vers un phénotype multirésistant afin de les traiter plus efficacement. Le développement d’approches proactives de ce type, en offrant aux cliniciens plusieurs coups d’avance sur l’évolution naturelle des tumeurs, pourrait donc ouvrir de nouvelles perspectives thérapeutiques contre les récidives tumorales. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Aguirre-Ghiso
JA
. Models, mechanisms and clinical evidence for cancer dormancy . Nat Rev Cancer.
2007; ; 7 : :834.–846. 2.
Boisgerault
N
,
Kottke
T
,
Pulido
J
, et al.
Functional cloning of recurrence-specific antigens identifies molecular targets to treat tumor relapse . Mol Ther.
2013; ; 21 : :1507.–1516. 3.
Kottke
T
,
Boisgerault
N
,
Diaz
RM
, et al.
Detecting and targeting tumor relapse by its resistance to innate effectors at early recurrence . Nat Med.
2013; ; 19 : :1625.–1631. 4.
Kottke
T
,
Hall
G
,
Pulido
J
, et al.
Antiangiogenic cancer therapy combined with oncolytic virotherapy leads to regression of established tumors in mice . J Clin Invest.
2010; ; 120 : :1551.–1560. 5.
Almog
N
,
Ma
L
,
Raychowdhury
R
, et al.
Transcriptional switch of dormant tumors to fast-growing angiogenic phenotype . Cancer Res.
2009; ; 69 : :836.–844. 6.
Bensimon
J
. Le switch angiogénique ou comment réveiller les cellules tumorales dormantes . Med Sci (Paris).
2012; ; 28 : :1069.–1071. 7.
Pol
J
,
Le Bœuf
F
,
Diallo
JS
. Stratégies génétiques, immunologiques et pharmacologiques au service d’une nouvelle génération de virus anticancéreux . Med Sci (Paris).
2013; ; 29 : :165.–173. 8.
Kloos
RT
,
Mazzaferri
EL
. A single recombinant human thyrotropin-stimulated serum thyroglobulin measurement predicts differentiated thyroid carcinoma metastases three to five years later . J Clin Endocrinol Metab.
2005; ; 90 : :5047.–5057. |