| |
| Med Sci (Paris). 2014 April; 30(4): 350–352. Published online 2014 May 5. doi: 10.1051/medsci/20143004004.Une ubiquitine ligase polyvalente : garante de la qualité mitochondriale et de l’immunité antibactérienne ? Olga Corti1,2,3* 1Inserm, U1127, Institut du cerveau et de la moelle épinière, hôpital Pitié-Salpêtrière, 47, boulevard de l’Hôpital, F-75013, Paris, France 2UPMC Université Paris 06, UMR S975, F-75013, Paris, France 3CNRS, UMR7225, F-75013Paris, France MeSH keywords: Animaux, Bactéries, Humains, Immunité innée, Mitochondries, physiologie, Ubiquitin-protein ligases |
PARK2 : cause de maladie de Parkinson et facteur de risque vis-à-vis de maladies infectieuses ? Plusieurs gènes sont aujourd’hui reconnus ou soupçonnés engendrer de rares formes familiales de maladie de Parkinson [
1]. En général sporadique et de début tardif, la maladie touche les neurones dopaminergiques d’une région cérébrale nommée locus niger, qui dégénèrent progressivement. Le gène PARK2 est responsable de près de la moitié des cas de maladie de Parkinson de transmission autosomique récessive avec début précoce. Une grande variété de mutations couvrant l’ensemble du gène causent la maladie par un mécanisme de perte de fonction. De façon surprenante, des variants particuliers de la région 5’ régulatrice de PARK2 ont été associés à une susceptibilité accrue à des pathogènes bactériens intracellulaires, tels que Mycobacterium leprae, agent causal de la lèpre [
2]. Comment expliquer ces observations ? En 2008, l’équipe de Richard Youle apportait un souffle nouveau à la recherche des mécanismes pathogéniques en cours dans la maladie de Parkinson : elle démontrait un rôle de la protéine codée par PARK2, la parkine, dans la destruction de mitochondries endommagées, un processus nommé mitophagie [
3]. Jeffery Cox et son équipe montrent aujourd’hui que la parkine joue aussi un rôle dans un processus apparenté, la xénophagie, conduisant à l’élimination de bactéries intracellulaires (Figure 1) [
4].
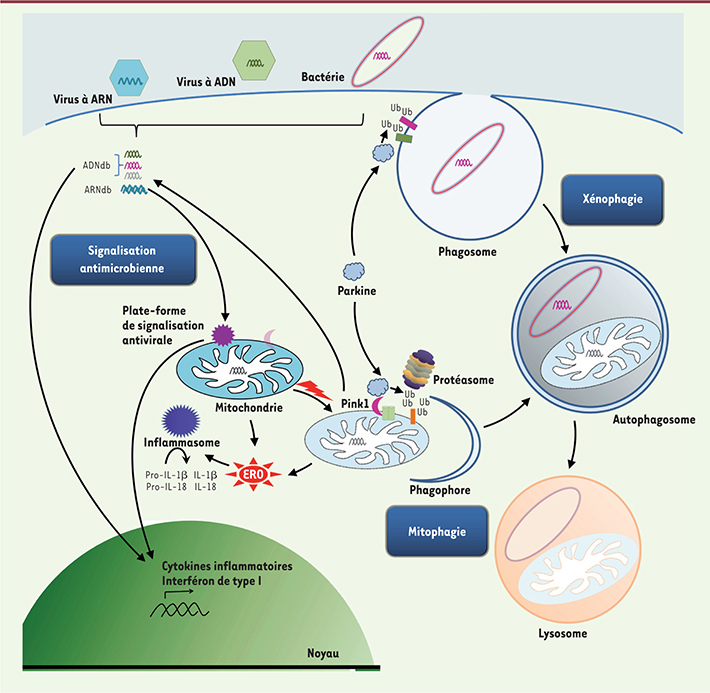
 | Figure 1.
Liens entre parkine, mitochondrie et immunité innée. La parkine joue un rôle clé dans le maintien de la qualité du réseau mitochondrial de la cellule, en promouvant la dégradation de mitochondries dysfonctionnelles par autophagie (mitophagie) ; ce processus est déclenché par l’accumulation de la sérine/thréonine kinase mitochondriale PINK1 à la surface de l’organite endommagé, d’où elle recrute la parkine. L’équipe de J. Cox montre que la parkine joue également un rôle dans la destruction de mycobactéries pathogènes (xénophagie). La mitochondrie intervient à plusieurs niveaux dans l’immunité innée, la première ligne de défense vis-à-vis des agents infectieux et pathogènes : (1) son ADN et ses protéines, libérés lors de processus pathologiques, mobilisent la réponse immunitaire innée au même titre que leurs contreparties microbiennes ; (2) elle sert de plate-forme pour l’assemblage d’un complexe protéique au service de la signalisation antivirale (virus à ARN) ; (3) elle produit des espèces réactives de l’oxygène (ERO) qui activent l’inflammasome, un complexe protéique responsable, à son tour, de l’activation de cytokines inflammatoires (IL-1β/18). Ainsi, par son rôle dans l’homéostasie mitochondriale, la parkine pourrait avoir un impact plus général sur la réponse immunitaire innée. ADNdb/ARNdb : ADN/ARN double brin ; Ub : ubiquitine. |
|
La dégradation mitochondriale est au cœur des dysfonctionnements observés lors de la perte de fonction de la parkine La parkine est une protéine cytosolique ubiquitaire, produite dans les cellules du système nerveux et d’organes et tissus périphériques, y compris ceux du système immunitaire [1, 2]. Elle appartient à la famille des ubiquitine ligases à domaine RING (really interesting new gene)-IBR (in between RING fingers)-RING, capables de modifier des protéines par ubiquitination, une modification post-traductionnelle dont l’une des fonctions est le ciblage des protéines vers la dégradation par la machinerie protéolytique du protéasome. Les études de Richard Youle, confirmées et étendues par différentes équipes à travers le monde, ont montré que lorsque la mitochondrie dysfonctionne, la parkine est recrutée à sa surface par le produit d’un autre gène responsable de formes autosomiques récessives de maladie de Parkinson, la sérine/thréonine kinase mitochondriale PINK1 [
5] ; il en résulte l’ubiquitination d’un ensemble de protéines de la membrane mitochondriale externe et le début de leur dégradation par le protéasome ; rapidement, la mitochondrie, partiellement digérée, sera séquestrée au sein d’une vésicule à double membrane, l’autophagosome, qui fusionnera avec le lysosome où elle sera détruite (Figure 1) [3,
6]. Cette découverte place la mitochondrie au cœur du processus pathologique dans les formes autosomiques récessives de maladie de Parkinson. Au carrefour de voies de signalisation de survie et de mort cellulaires, cet organite est la source principale d’énergie, produite au cours de la phosphorylation oxydative. C’est une fonction cruciale, particulièrement pour les neurones, qui sont incapables de favoriser le métabolisme glycolytique en cas de besoin. La dégradation de mitochondries dysfonctionnelles fait partie d’un ensemble de mécanismes de contrôle qualité qui préservent la fonction du réseau mitochondrial de la cellule ; elle serait donc compromise suite à la perte de fonction de PARK2 et de PINK1 [6]. |
Une fonction conservée dans l’immunité innée L’ubiquitination et l’autophagie jouent aussi un rôle clé dans la réponse aux infections bactériennes [
7]. Dans un processus similaire à celui qui conduit à la destruction des mitochondries, les bactéries pathogènes internalisées par le macrophage – cellule phagocytique du système immunitaire – sont ubiquitinées, emprisonnées dans des autophagosomes et digérées dans le lysosome. L’équipe de Jeffery Cox montre que dans des cellules infectées par M. tuberculosis, la parkine est recrutée directement au niveau de la vésicule de phagocytose, le phagosome, pour ubiquitiner des cibles protéiques, bactériennes ou de la cellule hôte, qui restent à découvrir ; le phagosome est adressé ensuite à l’autophagosome, puis son contenu bactérien est détruit dans le lysosome (Figure 1) [4]. Les auteurs montrent que ces processus sont altérés dans des macrophages murins ou humains dépourvus de parkine. Lors de l’infection par M. tuberculosis, la charge bactérienne était ainsi multipliée par trois dans des cellules en culture déplétées en parkine, et par dix dans différents organes de souris déficientes en parkine. L’issue de l’infection était fatale chez ces souris, alors que dans les mêmes conditions expérimentales, la survie de souris sauvages n’était pas compromise. La vulnérabilité des souris déficientes en parkine était de plus accrue vis-à-vis d’une autre bactérie, l’agent de la listériose, mais les effets de l’infection par M. leprae n’ont pas été étudiés. Enfin, en réalisant des expériences similaires dans un modèle de drosophile invalidé pour PARK2, les chercheurs de l’équipe montrent que le rôle de la Parkine dans cette réponse immunitaire est conservé au cours de l’évolution. Il reste à évaluer l’influence de polymorphismes de PARK2 associés à une susceptibilité accrue aux bactéries pathogènes, et l’éventuel rôle de PINK1 dans les mécanismes décrits. |
Parkine, mitochondrie et immunité innée : un lien paradoxal ? Un lien en apparence paradoxal est donc établi entre la fonction de PARK2 et les processus cellulaires qui régissent la destruction par autophagie de mitochondries dysfonctionnelles et de bactéries pathogènes. Existe-t-il des signaux communs qui régulent ces réponses, dont l’une est dévolue à l’élimination d’un organite appartenant à la cellule tandis que l’autre a pour vocation la destruction de microorganismes pathogènes étrangers ? Le système immunitaire inné réagit, par l’intermédiaire d’une variété de récepteurs, non seulement à des structures moléculaires caractéristiques des organismes pathogènes, mais aussi à des molécules endogènes libérées au cours de processus pathologiques dits « stériles » (Figure 1) [7]. La mitochondrie a évolué à partir d’une alpha-protéobactérie endosymbiotique infiltrée dans le cytoplasme d’une cellule eucaryote ancestrale. Son ADN et ses protéines ont des caractéristiques en commun avec leurs contreparties bactériennes [
8]. Lorsqu’elles sont libérées par des cellules mourantes au sein d’un tissu endommagé, elles mobilisent une réponse immunitaire innée qui, dans sa phase initiale, pourrait contribuer à éliminer la source de l’inflammation. La mitochondrie se trouve plus généralement au centre de la signalisation de l’immunité innée, qui pourrait donc être altérée par son dysfonctionnement : elle facilite la réponse immunitaire antibactérienne par la génération d’espèces réactives de l’oxygène qui l’activent ; elle sert aussi de plate-forme pour l’assemblage de la réponse antivirale (Figure 1) [8]. En préservant l’homéostasie mitochondriale dans les cellules du système immunitaire, la parkine pourrait ainsi réguler, directement ou indirectement, plusieurs aspects relatifs à l’immunité innée. D’autres études dans des cellules humaines et des modèles de drosophile ont précédemment montré que l’absence de parkine dérégule l’expression d’un ensemble de gènes impliqués dans la réponse immunitaire innée [
9,
10]. |
Des perspectives communes pour la maladie de Parkinson et les infections à mycobactéries : d’une pierre deux coups ? Il y a plus de 25 ans, la présence de cellules microgliales activées – les macrophages du système nerveux, habituellement quiescents – était mise en évidence dans le cerveau de sujets atteints de maladie de Parkinson [
11]. De nombreuses études ont depuis étayé l’hypothèse d’une contribution de processus immunitaires dans la progression de la maladie [
12]. Jeffery Cox et son équipe suggèrent qu’un dysfonctionnement de la réponse immunitaire innée pourrait jouer un rôle clé dans les formes familiales liées à PARK2. L’absence de parkine chez la souris ne provoque pas en soi une mort des neurones dopaminergiques, mais elle rend ces neurones plus vulnérables lorsque les souris sont intoxiquées par le lipopolysaccharide, une endotoxine bactérienne à l’origine d’une forte réponse immuno-inflammatoire [
13]. L’infection de souris déficientes en parkine par M. tuberculosis ou leprae fragilise-t-elle ces neurones ? Les sujets atteints de maladie de Parkinson liée à PARK2 sont-ils plus vulnérables aux infections à mycobactéries ? Les sujets porteurs de variants à risque pour le développement de maladies liées à une infection bactérienne sont-ils plus fréquemment atteints de maladie de Parkinson ? L’étude de Jeffery Cox ne répond pas à ces questions. Elle révèle cependant un lien inattendu entre ces maladies et suggère que des stratégies de traitement visant à mimer la fonction protectrice exercée par la parkine pourraient se révéler efficaces dans les deux cas. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Corti
O
,
Lesage
S
,
Brice
A
. What genetics tells us about the causes and mechanisms of Parkinson’s disease . Physiol Rev.
2011; ; 91 : :1161.–1218. 2.
Mira
MT
,
Alcaïs
A
,
Nguyen
VT
, et al.
Susceptibility to leprosy is associated with PARK2 and PACRG . Nature.
2004; ; 427 : :636.–640. 3.
Narendra
D
,
Tanaka
A
,
Suen
DF
,
Youle
RJ
. Parkin is recruited selectively to impaired mitochondria and promotes their autophagy . J Cell Biol.
2008; ; 183 : :795.–803. 4.
Manzanillo
PS
,
Ayres
JS
,
Watson
RO
, et al.
The ubiquitin ligase parkin mediates resistance to intracellular pathogens . Nature.
2013; ; 501 : :512.–516. 5.
Berthier
A
. Un peu de Rose dans la maladie de Parkinson . Med Sci (Paris).
2008; ; 24 : :118.–119. 6.
Corti
O
,
Brice
A
. Mitochondrial quality control turns out to be the principal suspect in parkin and PINK1-related autosomal recessive Parkinson’s disease . Curr Opin Neurobiol.
2013; ; 23 : :100.–108. 7.
Tang
D
,
Kang
R
,
Coyne
CB
, et al.
PAMPs and DAMPs: signal 0s that spur autophagy and immunity . Immunol Rev.
2012; ; 249 : :158.–175. 8.
Tait
SW
,
Green
DR
. Mitochondria and cell signalling . J Cell Sci.
2012; ; 125 : :807.–815. 9.
De Léséleuc
L
,
Orlova
M
,
Cobat
A
, et al.
PARK2 mediates interleukin 6 and monocyte chemoattractant protein 1 production by human macrophages . PLoS Negl Trop Dis.
2013; ; 7 : :e2015.. e2017. 10.
Greene
JC
,
Whitworth
AJ
,
Andrews
LA
, et al.
Genetic and genomic studies of Drosophila parkin mutants implicate oxidative stress and innate immune responses in pathogenesis . Hum Mol Genet.
2005; ; 14 : :799.–811. 11.
McGeer
PL
,
Itagaki
S
,
Boyes
BE
,
McGeer
EG
. Reactive microglia are positive for HLA-DR in the substantia nigra of Parkinson’s and Alzheimer’s disease brains . Neurology.
1988; ; 38 : :1285.–1291. 12.
Hirsch
EC
,
Hunot
S
. Neuroinflammation in Parkinson’s disease: a target for neuroprotection . Lancet Neurol.
2009; ; 8 : :382.–397. 13.
Frank-Cannon
TC
,
Tran
T
,
Ruhn
KA
, et al.
Parkin deficiency increases vulnerability to inflammation-related nigral degeneration . J Neurosci.
2008; ; 28 : :10825.–10834. |