| |
| Med Sci (Paris). 2014 March; 30(3): 297–302. Published online 2014 March 31. doi: 10.1051/medsci/20143003018.Les petits ARN nucléolaires nous surprennent encore ! Yoann Abel,1 Guillaume Clerget,1 Valérie Bourguignon-Igel,1 Véronique Salone,1 and Mathieu Rederstorff1* 1Université de Lorraine, CNRS, UMR 7365 IMoPA, Biopôle, 9, avenue de la forêt de Haye, 54506Vandœuvre-lès-Nancy, France |

Les cellules de tous les organismes vivants contiennent deux catégories distinctes d’acides ribonucléiques (ARN) : les ARN messagers (ARNm), qui sont traduits en protéines après leur maturation, et les ARN non codants (ARNnc). Longtemps sous-estimés, les ARNnc ont connu un regain d’intérêt considérable au cours des dernières années, en raison de leur très grand nombre et des fonctions importantes qui leur sont associées. En effet, les ARNnc participent à la plupart des processus biologiques, depuis la réplication du matériel génétique et son expression dans la cellule, jusqu’au développement de l’organisme [
1]. La taille des ARNnc est très variable. Certains peuvent être constitués de milliers de bases, comme l’ARN Xist (17 kb) qui participe à l’inactivation d’un des deux chromosomes X chez les femelles des mammifères. D’autres ARNnc, dits microARN, sont d’extrême petite taille (21-23 bases) et interviennent dans la régulation post-transcriptionnelle de l’expression des gènes chez les vertébrés [
2]. |
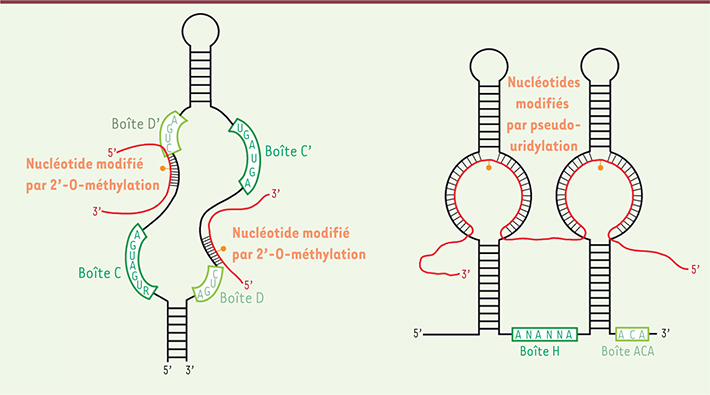
Les snoARN : des molécules guides pour des enzymes de modification « aveugles » Les petits ARN nucléolaires (snoARN) constituent une famille de plus de 300 ARN non codants, dont on pensait tout connaître ou presque. En effet, la première fonction décrite pour les snoARN consiste en la modification post-transcriptionnelle d’autres ARNnc, comme les ARN ribosomiques (ARNr) ou les petits ARN nucléaires (snARN). Ces modifications correspondent principalement à des clivages du pré-ARNr, des méthylations de nucléotides au niveau des riboses ou encore à l’isomérisation des uridines (pseudo-uridylations). La présence de motifs conservés ou boîtes, leur structure tridimensionnelle et la nature des modifications qu’ils guident, permettent de distinguer deux familles majeures de snoARN : les snoARN à boîtes C/D et les snoARN à boîtes H/ACA, guidant respectivement les réactions de méthylation ou de pseudo-uridylation (Figure 1). Une autre famille, les petits ARN spécifiques des corps de Cajal (scaARN, pour small Cajal ARN), qui ne sont pas à proprement parler des snoARN puisqu’ils ne sont pas localisés dans le nucléole, présentent néanmoins des boîtes C/D et/ou H/ACA et peuvent donc guider l’une ou l’autre, ou les deux types de modifications correspondantes. Localisés dans les corps de Cajal, des compartiments nucléaires non délimités par une membrane, à l’instar des nucléoles, les scaARN interviennent dans la maturation de certains petits ARN nucléaires (snARN), tels que U1 ou U2, impliqués dans la machinerie d’épissage.
 | Figure 1.
Représentation schématique des structures secondaires des snoARN. Les snoARN à boîtes C/D (à gauche) présentent, en amont de leurs boîtes D et D’, une région antisens s’appariant à l’ARN cible (en rouge) et permettant de guider la 2’-O-méthylation du ribose du nucléotide situé cinq nucléotides en amont de la boîte (cette position est indiquée en orange) par la fibrillarine. Les snoARN à boîtes H/ACA (à droite) présentent deux régions antisens appelées poches de pseudo-uridylation, complémentaires de l’ARN cible (en rouge). Le premier résidu non apparié dans chaque boucle (représenté en orange), une uridine, est isomérisé en pseudo-uridine par la dyskérine [
42]. |
Les snoARN, comme la grande majorité des ARN non codants, ne portent pas d’activité catalytique intrinsèque et s’associent à des protéines catalytiques « aveugles », incapables de reconnaître leur cible, formant ainsi des particules ribonucléoprotéiques (RNP). Au sein de ces particules, les snoARN assurent une fonction de guide. En effet, la position à modifier dans l’ARN cible est spécifiée par la complémentarité des bases entre de courtes séquences antisens localisées dans les snoARN et les séquences de leurs ARN cibles (Figure 1). Parmi les snoARN, plusieurs font toutefois exception à ces règles. En effet, l’ARN U3, le snoARN à boîtes C/D le plus abondant dans la cellule, présente une particularité fonctionnelle remarquable, puisqu’il ne guide pas la méthylation d’un ARN cible, mais les clivages nucléolytiques précoces au cours de la maturation du précurseur 35S de l’ARN ribosomique, toujours par le biais d’appariements spécifiques. D’autres snoARN ne présentent, quant à eux, aucune complémentarité de séquence avec des ARN cibles potentiels classiques (ARNr, snARN) et ont ainsi été désignés snoARN orphelins. L’identification de leur fonction reste un enjeu scientifique majeur. |
Les snoARN peuvent être les précurseurs d’autres ARN non codants plus petits Les progrès en matière de séquençage à haut débit au cours de ces dernières années ont permis de lancer des analyses à grande échelle sur les petits ARNnc humains. En 2008, une étude a montré l’existence de petits ARNnc stables, produits de maturation de snoARN précurseurs [
3]. La même année, deux autres groupes ont identifié des petits ARNnc dérivés de snoARN en association avec des protéines Argonautes (Ago1 et Ago2), protéines qui s’associent aux microARN au sein des particules RISC (RNA induced silencing complex) impliquées dans le silencing des gènes [
4,
5,
45]. Ainsi, une nouvelle classe de petits ARN dérivés de snoARN a été mise en évidence : les sdARN (snoRNA-derived small RNA, petits ARN dérivés de snoARN). Ces nouveaux petits ARN (environ 20 nucléotides pour les plus petits) peuvent être générés à partir de snoARN précurseurs à boîtes C/D ou à boîtes H/ACA [
6] (Figure 2). La production et la fonction du sdARN ACA45, produit à partir du scaARN ACA45, un sous-type de snoARN à boîtes H/ACA, ont été les premières documentées dans la littérature scientifique. En effet, le scaARN ACA45, dont la structure en tige-boucle rappelle celle des précurseurs de microARN, subit une maturation en sdARN (sdARN ACA45) de 22-23 bases, comparable à celle d’un microARN. Certains auteurs emploient même le terme de sno-miR. Ender et al. [4] ont montré que cette maturation était, dans ce cas, indépendante de la RNase de type III Drosha, mais nécessitait l’action de la RNase de type III Dicer, toutes deux impliquées dans la maturation classique des microARN [45]. Enfin, les auteurs ont montré, par un test rapporteur, que le sdARN ACA45 pouvait cibler l’ARNm codant pour une sous-unité protéique du médiateur CDC2L6. Depuis, d’autres sdARN ont été identifiés par des immunoprécipitations de complexes argonaute-ARN, ou prédits à l’aide de modélisations bio-informatiques. Ainsi, les protéines Ago7 (chez Arabidopsis) et Ago1 (chez S. pombe) ont également été trouvées en complexe avec de petits ARN dérivés de snoARN [6]. Plus récemment, chez l’homme, plusieurs fragments dérivés de snoARN ont aussi été observés au sein de particules RISC [
7]. Une autre étude montre que les sdARN semblent ne pas être incorporés dans les complexes Ago2 de manière très efficace [
8]. Il n’en demeure pas moins que certaines espèces de snoARN présentent donc à la fois les caractéristiques et les fonctions des snoARN classiques, et peuvent générer des sno-miR fonctionnels [
9]. Une hypothèse qui permet d’expliquer ces observations est que les précurseurs de certains microARN dériveraient de snoARN ayant perdu leur fonction initiale de guide de modification post-transcriptionnelle d’ARN, et acquis une nouvelle fonctionnalité au cours de l’évolution. Cette hypothèse est étayée par le fait que de nombreux snoARN orphelins ont été décrits comme étant les précurseurs de sdARN [6].
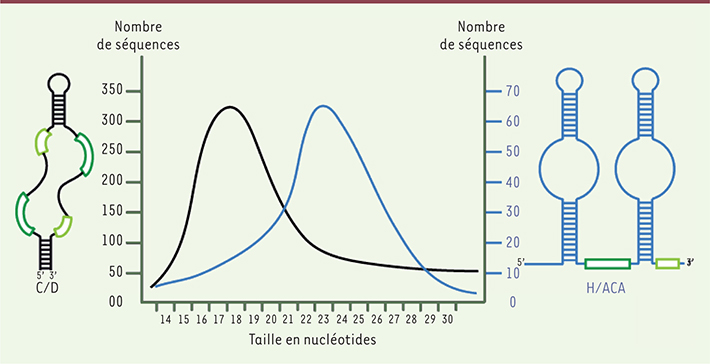
 | Figure 2.
Caractéristiques des miARN issus de snoARN à boîtes C/D ou H/ACA chez l’homme. Les miARN dérivés de snoARN à boîtes C/D sont plus abondants que ceux dérivés de snoARN à boîtes H/ACA. Ces derniers ont toutefois une taille moyenne légèrement supérieure (21-24 contre 17-19 nucléotides, abscisse). En ordonnée : nombre de séquences correspondant à des sno-miR pour un million de séquences localisées sur le génome (d’après [ 6]). |
Ce lien surprenant entre snoARN et microARN est conforté par l’existence de plusieurs similitudes entre les processus de maturation des microARN et des snoARN. En effet, ils nécessitent tous deux l’action de nucléases (endo- et exonucléases), notamment de type RNase III (Rnt1 chez la levure et les plantes pour la maturation des snoARN polycistroniques, Drosha et Dicer pour la maturation des microARN). De plus, il a été montré que Dicer pouvait accepter certains snoARN comme substrats [4]. En outre, des interactions ont été observées entre des protéines participant à l’une ou l’autre voie de maturation. Ainsi, la fibrillarine et la protéine NOP56 (56-kDa nucleolar protein) ont été retrouvées associées aux protéines Argonaute Ago2 et Ago1, respectivement. Enfin, chez les plantes, on a montré que la protéine chaperonne Hsp90 (90-kDa heat shock protein) intervenait à la fois dans la biogenèse des snoARN et celle des microARN [
10]. |
Les pré-ARN messagers : de nouvelles cibles pour les snoARN Les snoARN à boîtes C/D SNORD115 et SNORD116 murins ont été identifiés en 2000 par le groupe d’Hüttenhofer [
11]. Ils sont tous deux exprimés préférentiellement dans le cerveau et possèdent plusieurs caractéristiques originales. En effet, les gènes SNORD115 et SNORD116 sont localisés dans le locus 7C chez la souris, et 15q11-13 chez l’homme. Ces régions chromosomiques sont soumises à l’empreinte génomique parentale, et ces gènes ne sont exprimés qu’à partir de l’allèle paternel [
12,
13]. De plus, de multiples copies de ces gènes sont présentes (respectivement 47 et 27 répétitions des gènes humains SNORD115 et SNORD116). Chez l’homme, la délétion de l’allèle paternel de ce locus conduit au développement du syndrome de Prader-Willi (locus PW/AS), une maladie génétique rare (prévalence de 1 sur 25 000) entraînant des troubles du développement (taille réduite, hypogonadisme) et du comportement (hypotonie, retard mental, hyperphagie due à l’absence de sensation de la satiété conduisant à une obésité morbide) [
14–
16]. Des études génétiques ont montré que la seule délétion de la région correspondant aux copies de SNORD116 était suffisante pour induire un phénotype pathologique ; toutefois, la sévérité des troubles augmente avec l’étendue de la région absente. Aucune cible canonique du snoARN SNORD116 n’a pu être identifiée à ce jour. On peut donc proposer que ce dernier, tout comme d’autres snoARN orphelins, participe à des processus biologiques encore non identifiés. Par ailleurs, le snoARN SNORD115 ne semble pas jouer un rôle essentiel dans l’apparition du syndrome de Prader-Willi, puisque la seule délétion du cluster SNORD115 n’entraîne aucun symptôme chez les individus qui en sont porteurs. Il n’est cependant pas exclu que la perte de sa fonction, associée à celle de SNORD116, contribue à la variabilité du phénotype. Néanmoins, la compréhension de la responsabilité des snoARN dans l’apparition de la pathologie demeure partielle, et l’implication possible d’un nouveau gène, toujours au même locus, a été rapportée [
17]. De manière remarquable, le snoARN orphelin SNORD115 possède une longue complémentarité de 18 nucléotides avec un pré-ARNm spécifique du cerveau codant pour le récepteur de la sérotonine 5-HT2c [11]. Ce récepteur transmembranaire couplé à la protéine G est impliqué dans le contrôle de l’appétit et de l’humeur. Le pré-ARNm codant pour ce récepteur peut subir, dans le cytoplasme, différents événements d’édition (conversion d’adénosine en inosine via les enzymes ADAR [adenosine deaminase acting on RNA] -1 et -2) au niveau de cinq sites spécifiques (A à E) de l’exon V [13]. Cet exon V correspond à la boucle II intracellulaire du récepteur à laquelle s’associe la protéine G indispensable à la transduction du signal par la sérotonine. Au cours de la traduction en protéines, les inosines de l’ARNm sont reconnues comme des guanosines. Aussi, en fonction du taux d’édition des différents sites, plusieurs isoformes du récepteur peuvent être produites, chacune présentant une affinité différente pour la protéine G. Le snoARN SNORD115 pourrait ainsi guider la méthylation d’un nucléotide correspondant au site d’édition C. Les expérimentations in vitro de Hüttenhofer et son équipe vont dans ce sens, qui montrent que l’expression du snoARN SNORD115 inhibait spécifiquement la déamination de l’adénosine au site C [13]. Ainsi, en réduisant l’efficacité de l’édition au site C, le snoARN SNORD115 pourrait moduler finement le couplage du récepteur 5-HT2c à la protéine G, et donc la transduction du signal par la sérotonine. Ainsi, une nouvelle classe de cibles possibles pour les snoARN, les pré-ARNm, a été mis en évidence et a engendré un regain d’intérêt important pour l’étude de cette famille de molécules. En outre, une autre étude [
18] semble indiquer que le snoARN SNORD115 serait impliqué dans la régulation de l’épissage alternatif du pré-ARNm codant le récepteur 5-HT2c, selon un mécanisme indépendant de l’édition. En effet, en présence du snoARN SNORD115, l’ARN mature produit contiendrait l’exon V en entier, conduisant à la forme fonctionnelle du récepteur à la sérotonine. En revanche, en son absence, un site proximal d’épissage au niveau de l’exon V serait utilisé, conduisant à l’apparition d’un codon stop prématuré dans l’exon VI. Le récepteur ainsi produit est amputé de sa partie carboxy-terminale, et son affinité pour la protéine G serait alors 10 à 100 fois moins importante. Il est intéressant de mentionner que des petits ARN dérivés du snoARN SNORD115 ont été observés [
19–
21]. Les détails concernant leur nombre, abondance et extrémités sont l’objet de débats [19–21] ; ils pourraient néanmoins être impliqués dans l’épissage du pré-ARNm du récepteur de la sérotonine, ainsi que dans celui d’autres pré-ARNm cibles potentiels [
20]. Des observations similaires ont été faites pour d’autres snoARN et leurs petits fragments dérivés, comme SNORD88C, impliqué dans l’épissage du pré-ARNm de FGFR3 (fibroblast growth factor receptor 3) [
22]. Ceci indique que le snoARN SNORD115, comme de nombreux snoARN, serait le précurseur de petits ARNnc fonctionnels, dont le nombre, la nature, les voies de biogenèse ainsi que la fonction exacte devront être caractérisés plus précisément [19]. Bien que l’implication éventuelle des snoARN ou de leurs petits ARN dérivés dans les phénomènes d’épissage ou d’édition de pré-ARNm soient encore mal comprise, l’élucidation des mécanismes biologiques et l’identification des partenaires mis en jeu lors de la maturation des sno-miR pourraient permettre de mieux comprendre les mécanismes de pathologies complexes comme, par exemple, le syndrome de Prader-Willi. |
Le rôle des microARN dans les processus de différenciation cellulaire, mais également dans le développement de pathologies, en particulier l’évolution tumorale, dont ils peuvent servir de marqueurs, est aujourd’hui largement documenté [
23,
24]. À l’instar des microARN, des snoARN sont également retrouvés parmi les ARN circulants, représentant des biomarqueurs potentiels intéressants [
25,
26], et de nouveaux résultats tendent à indiquer que plusieurs snoARN sont également impliqués dans des processus tumoraux [
27–
31]. Par exemple, le snoARN à boîtes C/D U50 est sous-exprimé chez certains patients atteints de cancer de la prostate, et sa surexpression inhibe la prolifération cellulaire in vitro [
32–
34]. Un autre snoARN, à boîte H/ACA cette fois, est surexprimé dans certains types de cancers du poumon [25,
35]. Ainsi, des membres des deux familles de snoARN semblent impliqués dans la cancérogenèse, où ils peuvent se comporter comme oncogènes ou comme gènes suppresseurs de tumeurs. Bien que les mécanismes précis afférents à ces observations soient encore mal compris, une hypothèse attrayante est que l’existence de défauts de maturation des ARN ribosomiques, cibles canoniques des snoARN, et leur assemblage dans les ribosomes, puissent affecter la traduction protéique dans les cellules. Or, des défauts d’assemblage et de biogenèse des ribosomes ont été associés à l’évolution de processus tumoraux, en particulier chez des patients atteints de cancers du sein [
36]. Une hypothèse alternative serait que les snoARN concernés, ou des sous-fragments de ces snoARN, puissent intervenir en dehors de la biogenèse des ribosomes, expliquant les effets observés au niveau tumoral. Les phénomènes de production de microARN à partir de snoARN précurseurs décrits plus haut pourraient en être une illustration. Les données de la littérature montrent que deux microARN issus de précurseurs ressemblant à des snoARN, les miR-27b et miR-140, ont une forte influence sur l’évolution de certaines tumeurs [
37–
39] (Figure 3). Ainsi, une expression élevée de miR-140 dans les ostéosarcomes et dans les tumeurs du côlon ralentit la prolifération cellulaire, et entraîne la chimiorésistance de la tumeur [
40]. La surexpression de miR-27b dans des neuroblastomes ralentit également la prolifération cellulaire par une répression de l’expression du gène codant pour les récepteurs PPARγ (peroxisome proliferator-activated receptor γ) [
41].
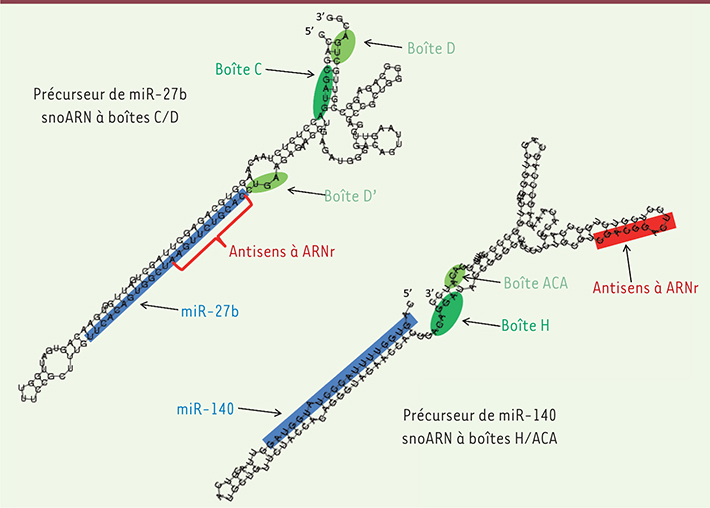
 | Figure 3.
Les précurseurs des miARN 27b et 140 ressemblent à des snoARN. Les structures secondaires des précurseurs des miARN miR-27b et miR-140 sont représentées, avec les boîtes C/D ou H/ACA indiquées en vert et la région antisens complémentaire à une région cible dans un ARN ribosomique en rouge. Le miARN mature correspondant est représenté en bleu [ 22,
43,
44]. |
|
La famille des snoARN illustre parfaitement l’importance de la compréhension des mécanismes conduisant à la maturation ou l’assemblage des ARNnc au sein de particules ribonucléoprotéiques fonctionnelles. Elle constitue un domaine d’étude aussi fascinant que primordial. Ainsi, les snoARN, ces « anciens » ARN auxquels de nouveaux rôles sont attribués, ne cessent de nous surprendre. Leur maturation en ARN fonctionnels plus petits ou la démonstration de leur implication, ainsi que celle de leurs petits ARN dérivés récemment identifiés, dans la régulation de l’édition et l’épissage alternatif, ou le lien possible de certains d’entre eux avec le syndrome de Prader-Willi ou les processus tumoraux, en sont des exemples. L’élucidation des mécanismes de maturation des snoARN en microARN pourrait ainsi permettre d’envisager, à plus long terme, des approches thérapeutiques pour ces pathologies. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nous tenons à remercier le Centre National de la Recherche Scientifique (CNRS), l’Université de Lorraine (UL) et la Ligue nationale contre le cancer (comités Meurthe-et-Moselle et Moselle) pour leur soutien financier. Nous tenons également à remercier Christiane Branlant et Bruno Charpentier pour leur relecture et commentaires sur le manuscrit ainsi que l’ensemble du laboratoire pour les discussions stimulantes.
|
1.
Rederstorff
M
. Une approche originale de sélection de nouveaux ARN non codants . Med Sci (Paris).
2011; ; 27 : :343.–345. 2.
Cavaille
J
. Des microARN comme s’il en pleuvait….
Med Sci (Paris).
2004; ; 20 : :399.–401. 3.
Kawaji
H
,
Nakamura
M
,
Takahashi
Y
, et al.
Hidden layers of human small RNAs . BMC Genomics.
2008; ; 9 : :157.. 4.
Ender
C
,
Krek
A
,
Friedlander
MR
, et al.
A human snoRNA with microRNA-like functions . Mol Cell.
2008; ; 32 : :519.–528. 5.
Saraiya
AA
,
Wang
CC.
, snoRNA, a novel precursor of microRNA in Giardia lamblia . PLoS Pathog.
2008; ; 4 : :e1000224.. 6.
Taft
RJ
,
Glazov
EA
,
Lassmann
T
, et al.
Small RNAs derived from snoRNAs . RNA.
2009; ; 15 : :1233.–1240. 7.
Brameier
M
,
Herwig
A
,
Reinhardt
R
, et al.
Human box C/D snoRNAs with miRNA like functions: expanding the range of regulatory RNAs . Nucleic Acids Res.
2011; ; 39 : :675.–686. 8.
Kishore
S
,
Gruber
AR
,
Jedlinski
DJ
, et al.
Insights into snoRNA biogenesis, processing from PAR-CLIP of snoRNA core proteins, small RNA sequencing . Genome Biol.
2013; ; 14 : :R45.. 9.
Scott
MS
,
Ono
M
. From snoRNA to miRNA: Dual function regulatory non-coding RNAs . Biochimie.
2011; ; 93 : :1987.–1992. 10.
Iwasaki
S
,
Kobayashi
M
,
Yoda
M
, et al.
Hsc70/Hsp90 chaperone machinery mediates ATP-dependent RISC loading of small RNA duplexes . Mol Cell.
2010; ; 39 : :292.–299. 11.
Cavaille
J
,
Buiting
K
,
Kiefmann
M
, et al.
Identification of brain-specific and imprinted small nucleolar RNA genes exhibiting an unusual genomic organization . Proc Natl Acad Sci USA.
2000; ; 97 : :14311.–14316. 12.
Rederstorff
M
,
Huttenhofer
A
. Small non-coding RNAs in disease development and host-pathogen interactions . Curr Opin Mol Ther.
2010; ; 12 : :684.–694. 13.
Vitali
P
,
Cavaille
J
. Petits ARN C/D et syndrome de Prader-Willi . Med Sci (Paris).
2005; ; 21 : :1017.–1019. 14.
De Smith
AJ
,
Purmann
C
,
Walters
RG
, et al.
A deletion of the HBII-85 class of small nucleolar RNAs (snoRNAs) is associated with hyperphagia, obesity and hypogonadism . Hum Mol Genet.
2009; ; 18 : :3257.–3265. 15.
Duker
AL
,
Ballif
BC
,
Bawle
EV
, et al.
Paternally inherited microdeletion at 15q11.2 confirms a significant role for the SNORD116 C/D box snoRNA cluster in Prader-Willi syndrome . Eur J Hum Genet.
2010; ; 18 : :1196.–1201. 16.
Sahoo
T
,
del Gaudio
D
,
German
JR
, et al.
Prader-Willi phenotype caused by paternal deficiency for the HBII-85 C/D box small nucleolar RNA cluster . Nat Genet.
2008; ; 40 : :719.–721. 17.
Schaaf
CP
,
Gonzalez-Garay
ML
,
Xia
F
, et al.
Truncating mutations of MAGEL2 cause Prader-Willi phenotypes and autism . Nat Genet.
2013; ; 45 : :1405.–1408. 18.
Kishore
S
,
Stamm
S
. The snoRNA HBII-52 regulates alternative splicing of the serotonin receptor 2C . Science.
2006; ; 311 : :230.–232. 19.
Bortolin-Cavaille
ML
,
Cavaille
J
. The SNORD115 (H/MBII-52) and SNORD116 (H/MBII-85) gene clusters at the imprinted Prader-Willi locus generate canonical box C/D snoRNAs . Nucleic Acids Res.
2012; ; 40 : :6800.–6807. 20.
Kishore
S
,
Khanna
A
,
Zhang
Z
, et al.
The snoRNA MBII-52 (SNORD 115) is processed into smaller RNAs and regulates alternative splicing . Hum Mol Genet.
2010; ; 19 : :1153.–1164. 21.
Rederstorff
M
,
Bernhart
SH
,
Tanzer
A
, et al.
RNPomics: defining the ncRNA transcriptome by cDNA library generation from ribonucleo-protein particles . Nucleic Acids Res.
2010; ; 38 : :e113.. 22.
Scott
MS
,
Ono
M
,
Yamada
K
, et al.
Human box C/D snoRNA processing conservation across multiple cell types . Nucleic Acids Res.
2012; ; 40 : :3676.–3688. 23.
Kahn
A
. L’impérialisme des micro-ARN s’étend maintenant au cancer . Med Sci (Paris).
2005; ; 21 : :687.–689. 24.
Ladeiro
Y
,
Zucman-Rossi
J
. Micro-ARN (miARN) et cancer : le cas des tumeurs hépatocellulaires . Med Sci (Paris).
2009; ; 25 : :467.–472. 25.
Liao
J
,
Yu
L
,
Mei
Y
, et al.
Small nucleolar RNA signatures as biomarkers for non-small-cell lung cancer . Mol Cancer.
2010; ; 9 : :198.. 26.
Zhang
L
,
Yang
M
,
Marks
P
, et al.
Serum non-coding RNAs as biomarkers for osteoarthritis progression after ACL injury . Osteoarthritis Cartilage.
2012; ; 20 : :1631.–1637. 27.
Martens-Uzunova
ES
,
Olvedy
M
,
Jenster
G
. Beyond microRNA - Novel RNAs derived from small non-coding RNA and their implication in cancer . Cancer Lett.
2013; ; 340 : :201.–211. 28.
Su
H
,
Xu
T
,
Ganapathy
S
, et al.
Elevated snoRNA biogenesis is essential in breast cancer . Oncogene.
2013 ; doi : 10.1038/onc.2013.89.
29.
Teittinen
KJ
,
Laiho
A
,
Uusimaki
A
, et al.
Expression of small nucleolar RNAs in leukemic cells . Cell Oncol (Dordr).
2013; ; 36 : :55.–63. 30.
Valleron
W
,
Ysebaert
L
,
Berquet
L
, et al.
Small nucleolar RNA expression profiling identifies potential prognostic markers in peripheral T-cell lymphoma . Blood.
2013; ; 120 : :3997.–4005. 31.
Williams
GT
,
Farzaneh
F
. Are snoRNAs and snoRNA host genes new players in cancer?
Nat Rev Cancer.
2012; ; 12 : :84.–88. 32.
Dong
XY
,
Guo
P
,
Boyd
J
, et al.
Implication of snoRNA U50 in human breast cancer . J Genet Genomics.
2009; ; 36 : :447.–454. 33.
Dong
XY
,
Rodriguez
C
,
Guo
P
, et al.
SnoRNA U50 is a candidate tumor-suppressor gene at 6q14.3 with a mutation associated with clinically significant prostate cancer . Hum Mol Genet.
2008; ; 17 : :1031.–1042. 34.
Soeno
Y
,
Fujita
K
,
Kudo
T
, et al.
Generation of a mouse model with down-regulated U50 snoRNA (SNORD50) expression, its organ-specific phenotypic modulation . PLoS One.
2013; ; 8 : :e72105.. 35.
Mei
YP
,
Liao
JP
,
Shen
J
, et al.
Small nucleolar RNA 42 acts as an oncogene in lung tumorigenesis . Oncogene.
2011; ; 31 : :2794.–2804. 36.
Belin
S
,
Beghin
A
,
Solano-Gonzalez
E
, et al.
Dysregulation of ribosome biogenesis, translational capacity is associated with tumor progression of human breast cancer cells . PLoS One.
2009; ; 4 : :e7147.. 37.
Buffa
FM
,
Camps
C
,
Winchester
L
, et al.
microRNA-associated progression pathways and potential therapeutic targets identified by integrated mRNA and microRNA expression profiling in breast cancer . Cancer Res.
2011; ; 71 : :5635.–5645. 38.
Husted
S
,
Sokilde
R
,
Rask
L
, et al.
MicroRNA expression profiles associated with development of drug resistance in Ehrlich ascites tumor cells . Mol Pharm.
2011; ; 8 : :2055.–2062. 39.
Susuki
D
,
Kimura
S
,
Naganuma
S
, et al.
Regulation of microRNA expression by hepatocyte growth factor in human head and neck squamous cell carcinoma . Cancer Sci.
2011; ; 102 : :2164.–2171. 40.
Song
B
,
Wang
Y
,
Xi
Y
, et al.
Mechanism of chemoresistance mediated by miR-140 in human osteosarcoma and colon cancer cells . Oncogene.
2009; ; 28 : :4065.–4074. 41.
Lee
JJ
,
Drakaki
A
,
Iliopoulos
D
,
Struhl
K
. MiR-27b targets PPARgamma to inhibit growth, tumor progression and the inflammatory response in neuroblastoma cells . Oncogene.
2011; ; 31 : :3818.–3825. 42.
Eddy
SR
. Non-coding RNA genes and the modern RNA world . Nat Rev Genet.
2001; ; 2 : :919.–929. 43.
Ono
M
,
Scott
MS
,
Yamada
K
, et al.
Identification of human miRNA precursors that resemble box C/D snoRNAs . Nucleic Acids Res.
2011; ; 39 : :3879.–3891. 44.
Scott
MS
,
Avolio
F
,
Ono
M
, et al.
Human miRNA precursors with box H/ACA snoRNA features . PLoS Comput Biol.
2009; ; 5 : :e1000507.. 45.
Dunoyer
P
. La bataille du silence . Med Sci (Paris).
2009; ; 25 : :505.–512. |