| |
| Med Sci (Paris). 2014 March; 30(3): 231–233. Published online 2014 March 31. doi: 10.1051/medsci/20143003003.IAP et Rho : enfin connectées Laurence Dubrez,1,2* Arthur Marivin,1,2 and Jean Berthelet1,2 1Inserm UMR866, Faculté de médecine, 7 boulevard Jeanne d’Arc, 21079Dijon, France 2Université de Bourgogne, 21079Dijon, France MeSH keywords: Animaux, Protéines régulatrices de l'apoptose, métabolisme, Humains, Protéines IAP, génétique, Souris, Souris knockout, Liaison aux protéines, Transduction du signal, physiologie, Protéines G rho |
Les inhibitors of apoptosis (IAP) Les IAP (inhibitors of apoptosis), en particulier cIAP1, cIAP2 et XIAP, contrôlent le destin de vie ou de mort des cellules en réponse à différents stress environnementaux ou cellulaires [
1]. Ces protéines ont une activité E3-ubiquitine ligase. Elles catalysent la conjugaison d’une molécule ubiquitine ou d’une chaîne de ces molécules sur une protéine cible, modifiant ainsi la durée de vie, l’activité ou le réseau d’interaction de leurs protéines partenaires. Leurs partenaires les mieux caractérisés sont les caspases effectrices de l’apoptose, des composantes des voies d’activation du facteur de transcription NF-ƙB (nuclear factor-ƙB), des intermédiaires de la signalisation des récepteurs du TNF (tumor necrosis factor) ou du TGF-β (transforming growth factor-β), des régulateurs transcriptionnels, etc. [
2]. Les IAP ont été impliquées dans la régulation de la mort cellulaire, de la prolifération, de la différenciation et de la sécrétion de cytokines pro-inflammatoires. Leur expression est fréquemment altérée dans les tumeurs, et une surexpression a souvent été associée à un mauvais pronostic ou à une mauvaise réponse des cellules tumorales à un traitement chimio ou radio-thérapeutique. Six molécules inhibitrices des IAP (IAP antagonists ou Smac mimetics) sont aujourd’hui en cours d’évaluation clinique dans des essais de phase I et/ou II dans le traitement antitumoral [
3]. Inversement, les IAP peuvent aussi avoir des propriétés antitumorales, particulièrement dans le lignage lymphocytaire [3]. Un criblage génétique réalisé chez la drosophile par l’équipe de Montell en 2004 a révélé un rôle des IAP dans la régulation de la migration cellulaire. En effet, une surexpression de drosophila IAP1 (DIAP1) est capable de compenser le défaut de migration de cellules embryonnaires causé par l’inactivation de Rac, une petite GTPase de la famille Rho [
4]. Les mécanismes moléculaires n’ont pas été clairement établis, cependant, les auteurs ont mis en évidence une interaction de DIAP1 avec Rac. |
La famille des protéines Rho La famille Rho comprend 22 membres dont les chefs de files sont RhoA, Rac1 et cdc42. Ce sont des régulateurs importants des modifications du cytosquelette d’actine [
5]. Ces molécules contrôlent ainsi tous les changements morphologiques de la cellule, son adhésion, sa migration, sa polarisation, ainsi que les transports vésiculaires intracellulaires. Ce sont des GTPases, majoritairement présentes dans le cytosol, dans une conformation inactive liée au nucléotide guanylique GDP (guanosine-5’-triphosphate). En réponse à différents stimulus, elles adoptent une conformation active liée au GTP (guanosine-5’-triphosphate), qui leur permet d’activer leurs effecteurs (Figure 1). Les membres de la famille Rho ont des fonctions distinctes. Par exemple, l’activation de RhoA conduit à la formation de fibres de stress, alors que celle de Rac1 et cdc42 permet la formation de lamellipodes et de filopodes [
6]. Les protéines Rho sont soumises à des mécanismes croisés de régulation, l’activation d’une protéine Rho étant associée à l’inhibition des autres membres de la famille impliqués dans des processus cellulaires antagonistes [
7]. Les IAP pourraient participer à ces processus de régulation.
 | Figure 1.
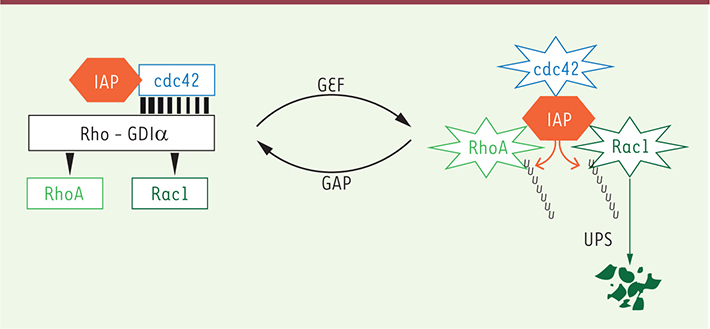
L’activation des RhoGTPases est contrôlée par des facteurs d’échanges (GEF : guanine nucleotide exchange factor) qui catalysent la transition GDP-GTP. Sous leur forme active, les RhoGTPases sont associées aux compartiments membranaires, où elles fixent et activent des protéines effectrices. Une fois activées, les protéines Rho sont soit dégradées par le complexe du protéasome après adressage par un signal ubiquitine, soit recyclées en formes inactives grâce à l’action de protéines GAP (GTPase accelerating proteins) qui catalysent l’hydrolyse du GTP. Les GEF et les GAP, exprimées en grand nombre dans les cellules, sont plus ou moins spécifiques pour l’une ou l’autre des protéines Rho, et assurent la sélectivité de la voie intracellulaire activée et de la réponse cellulaire. Seule une infime fraction des RhoGTPases sont activées dans la cellule à un moment donné. Elles sont maintenues sous forme inactive dans le cytosol, par leur association avec les protéines RhoGDI. Les RhoGDI, au nombre de trois, sont récemment apparues comme un pivot dans la régulation de l’activation et de la stabilité des RhoGTPases. En effet, les RhoGDI lient et stabilisent aussi bien RhoA, Rac1 et cdc42, chacune des protéines Rho étant en compétition pour sa liaison à son chaperon moléculaire. Les IAP, qui comprennent cIAP1 et XIAP, sont des régulateurs de l’homéostasie des RhoGTPases. Elles stabilisent cdc42 en favorisant son interaction avec RhoGDIα, alors qu’au contraire, elles catalysent l’ubiquitination et la dégradation de Rac1 par le complexe du protéasome. |
|
Les IAP : des régulateurs de l’action des RhoGTPases La régulation des RhoGTPases par les IAP a récemment été confirmée dans les cellules de mammifères. L’équipe dirigée par le Dr Rajalingam a montré une interaction de cIAP1 et de XIAP avec les membres de la sous-famille Rac (Rac1, Rac2 et Rac3) [
8]. Ces IAP s’avèrent être des régulateurs importants de la stabilité de Rac1. Elles catalysent le transfert de chaînes d’ubiquitine sur la forme active de Rac1, conduisant à sa dégradation par le complexe du protéasome, en réponse à un traitement des cellules par la toxine bactérienne CNF1 (facteur cytotoxique nécrosant 1), ou lors d’une déplétion de RhoGDIα, un chaperon moléculaire capable de lier et de stabiliser les protéines Rho. Dans un travail publié récemment, nous avons confirmé l’interaction directe de cIAP1 avec Rac1, mais aussi avec RhoA et cdc42 [
9]. Comme DIAP1 chez la drosophile, cIAP1 et XIAP lient les deux formes, actives et inactives, des RhoGTPases. Alors que cIAP1 est capable d’induire l’ubiquitination et la dégradation de Rac1 [8], il stabilise cdc42 en renforçant son association avec son chaperon moléculaire RhoGDIα (Figure 1) [9]. De plus, nos résultats montrent que cIAP1 est nécessaire à l’activation de cdc42 en réponse à une stimulation des cellules par le TNFα, l’EGF (epithelial growth factor), ou par l’expression de l’oncogène HRas-V12. Les résultats de ces différentes études positionnent les IAP comme des régulateurs de l’homéostasie des RhoGTPases (Figure 1). Les IAP pourraient être un des chaînons manquants permettant d’expliquer la régulation croisée des différents membres de la famille Rho et leur activation séquentielle lors d’un processus migratoire. |
Quelles sont les conséquences physiologiques de ces interactions ? Bien que cIAP1, cIAP2 et XIAP soient toutes trois capables de contrôler l’activité ou la stabilité des protéines Rho, leurs fonctions ne semblent pas équivalentes. Une analyse microscopique de fibroblastes embryonnaires de souris déficients pour l’une au l’autre des IAP montre des différences significatives de distribution du réseau d’actine et de morphologie, suggérant que chacune des IAP peut avoir un rôle spécifique dans la régulation du cytosquelette. Le contenu en protéines Rac1 [8] et cdc42 [9] de fibroblastes embryonnaires de souris cIAP1-/-
est modifié avec une forte proportion de formes actives. Comparées à des fibroblastes de souris sauvages, ces cellules ont une morphologie très allongée avec de fines protrusions membranaires dynamiques, comparables à des filopodes. Elles adhèrent fortement à une sous-couche de cellules endothéliales, et comblent très rapidement une brèche dans un tapis cellulaire [8]. Cependant, elles ne sont plus capables d’activer cdc42 et de former de nouveaux filopodes en réponse à une stimulation par le TNFα ou l’EGF [9], suggérant une régulation très perturbée des RhoGTPases. Afin d’analyser l’importance de cIAP1 dans l’invasion tumorale, nous avons transformé ces fibroblastes par l’oncogène HRas-V12. La délétion de cIAP1 inhibe la capacité de l’oncogène à activer cdc42, à accélérer la croissance des cellules dans un milieu semi-solide, à favoriser l’adhésion des cellules sur un tapis de cellules endothéliales et leur intercalation entre les cellules endothéliales [9]. In vivo, la délétion de cIAP1 diminue la croissance des tumeurs xénogreffées chez la souris nude et retarde fortement le développement de nodules cancéreux pulmonaires après injection de cellules tumorales dans la veine caudale [9]. Un traitement de cellules tumorales par un antagoniste des IAP conduit aussi à des changements morphologiques importants avec un allongement des cellules et l’apparition de protubérances à leur surface [8,
10], reflet d’une atteinte des mécanismes de régulation du cytosquelette. Ceci pourrait avoir des conséquences importantes sur le pouvoir métastatique, en altérant la migration des cellules, leur adhésion à la matrice extracellulaire ou sur un endothélium, et leur migration à travers la barrière endothéliale, permettant l’invasion des organes adjacents. Il serait donc prudent de prendre ces résultats en considération dans les essais cliniques utilisant des antagonistes des IAP dans le traitement antitumoral. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
A.M. remercie la Société française d’hématologie et J.B. la Fondation pour la recherche médicale pour leur aide doctorale de 4e année. Nous sommes particulièrement reconnaissants au conseil régional de Bourgogne, à l’Association pour la recherche contre le cancer et au comité de la Côte d’Or de la Ligue contre le cancer pour leur soutien.
|
1.
Gyrd-Hansen
M
,
Meier
P
. IAPs: from caspase inhibitors to modulators of NF-kappaB, inflammation and cancer . Nat Rev Cancer.
2010; ; 10 : :561.–574. 2.
Cartier
J
,
Marivin
A
,
Berthelet
J
,
Dubrez
L
. Les IAP au cœur de la signalisation NF-kB . Med Sci (Paris).
2012; ; 28 : :69.–75. 3.
Fulda
S
,
Vucic
D
. Targeting IAP proteins for therapeutic intervention in cancer . Nat Rev Drug Discov.
2012; ; 11 : :109.–124. 4.
Geisbrecht
ER
,
Montell
DJ
. A role for Drosophila IAP1-mediated caspase inhibition in Rac-dependent cell migration . Cell.
2004; ; 118 : :111.–125. 5.
Primeau
M
,
Lamarche-Vane
N
. Coup d’œil sur les petites GTPases Rho . Med Sci (Paris).
2008; ; 24 : :157.–162. 6.
Gadea
G
. Migration des cellules tumorales : GEF et GAP montrent le chemin . Med Sci (Paris).
2009; ; 25 : :343.–345. 7.
Boulter
E
,
Estrach
S
,
Garcia-Mata
R
,
Feral
CC
. Off the beaten paths: alternative and crosstalk regulation of Rho GTPases . FASEB J.
2012; ; 26 : :469.–479. 8.
Oberoi
TK
,
Dogan
T
,
Hocking
JC
, et al.
IAPs regulate the plasticity of cell migration by directly targeting Rac1 for degradation . EMBO J.
2011; ; 31 : :14.–28. 9.
Marivin
A
,
Berthelet
J
,
Cartier
J
, et al.
cIAP1 regulates TNF-mediated cdc42 activation and filopodia formation . Oncogene.
2013; ; 25
novembre (online).
10.
Tchoghandjian
A
,
Jennewein
C
,
Eckhardt
I
, et al.
Identification of non-canonical NF-kappaB signaling as a critical mediator of Smac mimetic-stimulated migration, invasion of glioblastoma cells . Cell Death Disease.
2013; ; 4 : :e564.. |