| |
| Med Sci (Paris). 2014 November; 30: 32–35. Published online 2014 November 17. doi: 10.1051/medsci/201430s207.Perspective économique sur les traitements ciblés Valérie Seror1,2* 1Inserm UMR912, Sciences économiques et sociales de la santé et traitement de l’information médicale (SESSTIM), 13006, Marseille, France 2Université Aix Marseille, UMRS912, IRD (Institut de recherche pour le développement), 13006, Marseille, France |

Alors que les évolutions sociales dans les pays développés se traduisent par un individualisme croissant [
1], on observe dans le même temps une tendance forte à la mobilisation collective des patients [
2]. C’est dans ce contexte particulier que s’inscrit le développement du champ dit de la « médecine personnalisée », au sein duquel les thérapies ciblées, résultant de l’utilisation de biomarqueurs ou de tests génomiques, occupent aujourd’hui une place majeure. La possibilité d’estimer la réponse des patients aux traitements à partir de caractéristiques individuelles (constitutionnelles) et/ou liées à la maladie (somatiques) est en effet souvent présentée comme préfigurant une nouvelle ère, celle d’une médecine davantage « sur mesure » (tailored treatments plutôt que one size fits all) [
3]. Alors qu’un nombre croissant de biomarqueurs et tests génomiques sont désormais intégrés à la pratique clinique [
4], les thérapies ciblées pourraient ainsi contribuer à satisfaire la demande des patients pour plus de transparence dans l’information médicale et pour plus d’implication dans la prise de décision médicale [
5]. Mais les difficultés d’information des patients concernant leurs options thérapeutiques restent entières, la question de la décision éclairée du patient devenant même un véritable enjeu dans le contexte des thérapies ciblées [
6]. Par ailleurs, le développement des thérapies ciblées est favorisé par le contexte de crise de l’innovation pharmaceutique, qui se traduit par des coûts de recherche et développement sans cesse croissants [
7], peu de nouveaux médicaments commercialisés [
8] et une inquiétude croissante quant aux toxicités des médicaments prescrits [
9]. Alors qu’on pourrait considérer que les entreprises pharmaceutiques n’ont aucun intérêt à envisager une segmentation du marché de leurs médicaments, le développement des thérapies ciblées est cependant susceptible de retarder la commercialisation des médicaments sous forme de générique [
10]. Ces constats pourraient expliquer, au moins pour partie, les investissements croissants de l’industrie pharmaceutique dans la recherche et le développement de biomarqueurs et de tests génomiques. Parmi les biomarqueurs et tests génomiques dont la commercialisation a été approuvée par la FDA (Food and drug administration, États-Unis) ou l’EMA (European medicines agency), la plupart visent à améliorer les traitements des cancers (meilleurs rapports bénéfices/risques). La perspective d’une médecine plus stratifiée, avec des arbres de décisions plus complexes et optimisés pour la prise de décision médicale, pose cependant la question des coûts associés. Dans un contexte d’inquiétude croissante à propos des dépenses de santé [
11], prescrire certains traitements aux seuls patients susceptibles d’en bénéficier le plus pourrait participer à la réduction des dépenses de santé, mais les coûts d’identification de ces patients par biomarqueurs ou tests génomiques sont potentiellement substantiels [
12–
14]. En d’autres termes, la question se pose des bénéfices cliniques à attendre des thérapies ciblées au regard des moyens à mettre en œuvre pour identifier les patients susceptibles d’y répondre. |
Les surcoûts des tests sont-ils compensés par un meilleur rapport coût-efficacité des traitements ciblés ? Cette question est cruciale du point de vue de l’Assurance maladie, pivot des systèmes de santé des pays développés. Le besoin de disposer d’études coût-efficacité est pointé dans la littérature internationale, ces études permettant aux assurances maladies (publiques ou privées) de disposer d’éléments chiffrés quant à l’impact économique attendu des innovations thérapeutiques, sur lesquels fonder leurs décisions de prise en charge et de remboursement [
15,
16]. Concernant la question de la compensation des coûts des tests (biomarqueurs ou tests génomiques) par l’amélioration du rapport coût-efficacité des traitements, les travaux publiés donnent une réponse positive pour certaines formes de cancer colorectal [
17], de cancer du poumon [
18] ou de cancer du sein [
19]. Mais ces conclusions ne sont vraisemblablement pas vérifiées pour n’importe quelle valeur monétaire des tests et des traitements ciblés par ces tests. Pour illustrer cette question de la relation entre cotations des tests et prix des médicaments ciblés par ces tests, et les enjeux qu’elle soulève, on peut s’appuyer sur une étude récente [
13] visant à évaluer l’apport d’un test génomique pour guider la décision médicale de chimiothérapie administrée à des patientes ayant certains types de cancer du sein (avec envahissement ganglionnaire mais sans métastases, soit environ 30 % des cancers du sein). Cette étude coût-efficacité, menée à partir de données rétrospectives, s’appuyait, d’une part sur les données de l’essai clinique PACS01 comparant des résultats cliniques résultant d’une chimiothérapie à base d’anthracyclines (six cycles de FEC100) ou à base d’anthracyclines et de taxanes (trois cycles de FEC100 suivis de trois cycles de docetaxel) [
20] et, d’autre part, sur le génotypage de tumeurs de patientes incluses dans cet essai clinique PACS01 [
21]. Cette étude coût-efficace avait pour objectif de comparer la prise en charge standard des patientes (chimiothérapie avec anthracyclines et taxanes) à une stratégie innovante impliquant un test génomique. Selon le résultat du test génomique, une chimiothérapie sans taxane était supposée être administrée aux patientes identifiées comme étant de « bon pronostic », alors qu’une chimiothérapie avec anthracyclines et taxanes était supposée être administrée aux patientes de « mauvais pronostic ». Sur le plan de l’efficacité de la stratégie innovante comparée à celle de la stratégie standard de chimiothérapie, il ressortait de l’étude clinique [21] que les patientes de « bon pronostic » (environ 80 % d’entre elles) ont un taux de survie sans rechute à cinq ans qui n’est pas modifié par le fait d’avoir reçu, ou non, des taxanes dans leur chimiothérapie. Ce résultat suggère que les patientes de « bon pronostic » ne bénéficient pas de l’adjonction de taxanes dans leur chimiothérapie, alors qu’elles en subissent les toxicités [
22]. En revanche, le taux de survie à cinq ans était plus élevé chez les patientes de « mauvais pronostic » qui avaient eu une chimiothérapie avec taxanes (69,2 % versus 60,9 %), suggérant un bénéfice significatif de l’adjonction de taxanes pour ces patientes. Ces résultats illustrent la complémentarité entre le test génomique et les anthracyclines qu’il cible, dans la mesure où l’utilisation conjointe du test et du traitement ciblé génère un plus grand bénéfice clinique que leur utilisation séparée. Sur le plan des coûts, l’évaluation des deux stratégies (standard et innovante) avait consisté en la valorisation monétaire des données individuelles de consommations hospitalières de soins collectées dans le cadre de l’essai clinique PACS01 [
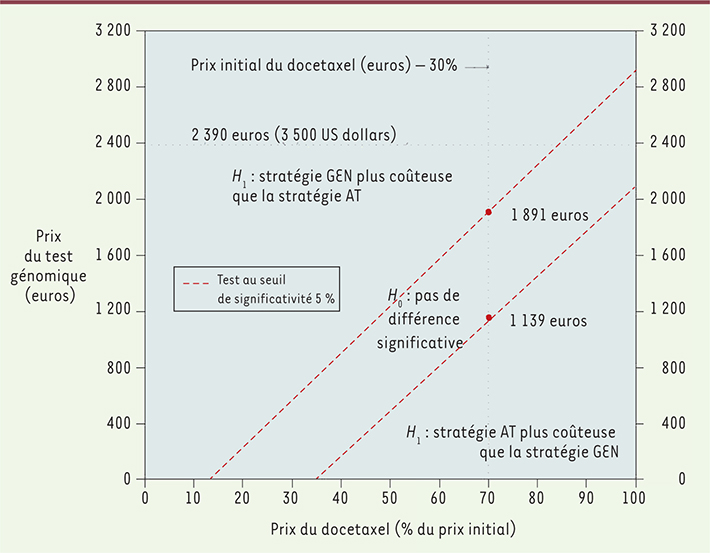
23]. La mise en regard des coûts des stratégies à l’efficacité attendue (Figure 1) illustre l’interdépendance de la cotation du test génomique et des prix des médicaments utilisés dans les traitements. Au moment de la réalisation de l’étude, le docetaxel (taxane la plus couramment utilisée) n’était pas encore un médicament générique, le test génomique représentait une option coût-efficace à condition que le coût de l’analyse génomique reste inférieur à 2 090 €. En supposant une baisse de 30 % du prix du docetaxel, ce qui correspond aux baisses de prix généralement observées lors du passage aux génériques), le test génomique demeurait une option coût-efficace pour un coût de l’analyse génomique inférieur à 1 139 €. On peut noter que ces valeurs seuil de cotation du test sont cohérentes avec les cotations d’autres tests génomiques utilisés pour la prise en charge du cancer du sein (plus de 3 000 € pour les tests Oncotype and Mammaprint). Mais, plus fondamentalement, on observe non seulement une complémentarité clinique du test et du traitement ciblé, mais également que le caractère coût-efficace de la stratégie innovante résulte de l’interdépendance des prix du test et des médicaments impliqués dans les stratégies évaluées.
 | Figure 1.
Résultat de l’analyse coût-efficacité sur la comparaison de la prise en charge standard versus innovante (test génomique) du cancer du sein avec envahissement ganglionnaire sans métastase. Dans cet exemple, le niveau de significativité est fixé à 5 %. La valeur 100 % correspond au prix initial du docetaxel. Par exemple, 70 % correspond à une diminution de 30 % du prix initial. L’analyse a également été effectuée pour des niveaux de significativité de 10 % et 1 %. (extrait de [ 13]). |
|
Quels enjeux pour l’Assurance maladie ? Les assurances maladie sont confrontées à des arbitrages entre faciliter l’adoption des innovations thérapeutiques et maintenir leurs capacités de financement des biens et services de santé offerts à leurs adhérents [
24,
25]. Dans le contexte actuel d’attention croissante portée aux dépenses de santé, l’introduction de biomarqueurs et de tests génomiques dans la pratique clinique pose avec force la question de l’impact à attendre sur les comptes de l’Assurance maladie, question que les études coût-efficacité peuvent éclairer. En France comme dans les autres pays européens ou aux États-Unis, la cotation des tests est principalement fondée sur leur coût de réalisation technique, alors que la fixation des prix des médicaments tient compte de leur utilité clinique et de l’état de santé des patients [12]. Fonder les décisions de cotation des tests sur leur apport à l’utilité clinique des traitements en plus de leurs coûts de réalisation permettrait d’assurer une plus grande cohérence des procédures de fixation des prix et des cotations [12,
26], mais complexifierait la démarche de cotations des tests, particulièrement dans le cas des traitements ciblés [
27]. Dans le contexte de l’étude dont les résultats ont été présentés précédemment, où l’usage du test génomique permet de réduire la toxicité de la chimiothérapie administrée aux patientes identifiées comme étant de « bon pronostic », une cotation intégrant les gains en qualité de vie induits par le test poserait la question de leur valorisation monétaire. Cette question est complexe et fait actuellement l’objet d’investigations méthodologiques sur le consentement sociétal à payer pour des gains en qualité de vie [
28,
29]. Mais, fonder les cotations des tests sur leurs coûts de réalisation n’élude pas véritablement cette question puisque, dans ce cas, la rémunération des gains en qualité de vie peut être, de fait, captée par l’assurance maladie ou attribuée au médicament ciblé par le test (dans le cas d’une négociation ou renégociation du prix du médicament ciblé par le test). |
Le développement des biomarqueurs et des tests génomiques pourrait permettre de prescrire certains traitements aux seuls patients susceptibles d’en bénéficier, afin d’éviter des traitements inutiles, coûteux et toxiques. À cet égard, il a été montré que l’ensemble des médicaments prescrits pourraient s’avérer inefficaces chez plus de 40 % des patients traités, ce qui suggère la possibilité de gains importants en efficience dans la prise en charge des patients [
30]. Concernant la toxicité des traitements, l’impact à long terme des traitements des cancers constitue actuellement un enjeu important du fait des avancées thérapeutiques qui permettent aujourd’hui de considérer la plupart des cancers comme des maladies chroniques. Ainsi, en France, l’étude des effets à long terme des traitements des cancers du sein est actuellement en cours avec la constitution de la cohorte CANTO (cancer toxicities, investigateur-coordinateur Fabrice André). Sur un plan économique, cibler les traitements sur les patients susceptibles d’en bénéficier le plus pourrait freiner l’escalade thérapeutique et les coûts associés, notamment dans la prise en charge des cancers. Mais, pour étayer les décisions de prise en charge et de fixation des prix/cotations par l’Assurance maladie, les essais cliniques des thérapies ciblées devraient systématiquement intégrer un recueil de données permettant l’estimation des coûts induits par les innovations thérapeutiques, de même qu’un recueil de données de qualité de vie et de perception des effets secondaires des traitements par les patients. Enfin, la complémentarité des tests et des médicaments qu’ils ciblent pointent la nécessité d’une évaluation du service médical rendu par les tests et les médicaments ciblés, qui devrait être conduite de façon coordonnée et non pas disjointe. À cet égard, on peut noter que des barrières organisationnelles à l’évaluation conjointe des services médicaux rendus par les tests et les médicaments sont observées tant en France que dans le reste de l’Europe ou en Amérique du Nord [12]. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Hofstede
G
,
Hofstede
GJ
,
Minkov
M
. Cultures and organizations . New York: : McGraw-Hill; , 1997. 2.
Holzer
B
. Political consumerism between individual choice and collective action: social movements, role mobilization and signalling . Int J Cons Stud.
2006; ; 30: :405.–415. 3.
Lesko
LJ
. Personalized medicine: elusive dream or imminent reality? . Clin Pharmacol Ther.
2007; ; 81 : :807.–816. 4.
Hoggatt
J
. Personalized medicine -trends in molecular diagnostics: exponential growth expected in the next ten years . Mol Diagn Ther.
2011; ; 15 : :53.–55. 5.
Coulter
A
. Paternalism or partnership? Patients have grown up-and there’s no going back . Br Med J.
1999; ; 319 : :719.–720. 6.
Seror
V
,
Marino
P
,
Bertucci
F
, et al.
Breast cancer patients’ views on the use of genomic testing to guide decisions about their postoperative chemotherapy . Public Health Genomics.
2013; ; 16 : :110.–117. 7.
DiMasi
JA
,
Hansen
RW
,
Grabowski
HG
. The price of innovation: new estimates of drug development costs . J Health Econ.
2003; ; 22 : :151.–185. 8.
Kola
I
,
Landis
J
. Can the pharmaceutical industry reduce attrition rates?
Nat Rev Drug Discov.
2004; ; 3 : :711.–715. 9.
Moore
TJ
,
Cohen
MR
,
Furberg
CD
. Serious adverse drug events reported to the Food and drug administration, 1998–2005 . Arch Intern Med.
2007; ; 167 : :1752.–1759. 10.
Blair
ED
,
Stratton
EK
,
Kaufmann
M
. The economic value of companion diagnostics and stratified medicines . Expert Rev Mol Diagn.
2012; ; 12 : :791.–794. 11.
Marino
P
,
Bertucci
F
,
Goncalvez
A
,
Seror
V
. Tests diagnostiques et thérapies ciblées en cancérologie : enjeux économiques . Med Sci (Paris).
2012; ; 28 : :19.–23. 12.
Fugel
HJ
,
Nuijten
M
,
Postma
M
. Stratified medicine, reimbursement issues . Front Pharmacol.
2012; ; 3 : :181.. 13.
Marino
P
,
Siani
C
,
Bertucci
F
, et al.
Economic issues involved in integrating genomic testing into clinical care: the case of genomic testing to guide decision-making about chemotherapy for breast cancer patients . Breast Cancer Res Treat.
2011; ; 129 : :401.–409. 14.
Davis
JC
,
Furstenthal
L
,
Desai
AA
, et al.
The microeconomics of personalized medicine: today’s challenge and tomorrow’s promise . Nat Rev Drug Discov.
2009; ; 8 : :279.–286. 15.
Trosman
JR
,
Van Bebber
SL
,
Phillips
KA
. Health technology assessment and private payers’ coverage of personalized medicine . J Oncol Pract.
2011; ; 7 : :s18s.–s124. 16.
Deverka
PA
. Pharmacogenomics, evidence, and the role of payers . Public Health Genomics.
2009; ; 12 : :149.–157. 17.
Frank
M
,
Mittendorf
T
. Influence of pharmacogenomic profiling prior to pharmaceutical treatment in metastatic colorectal cancer on cost effectiveness: a systematic review . Pharmacoeconomics.
2013; ; 31 : :215.–228. 18.
Atherly
AJ
,
Camidge
Dr
. The cost-effectiveness of screening lung cancer patients for targeted drug sensitivity markers . Br J Cancer.
2012; ; 106 : :1100.–1106. 19.
Retel
VP
,
Joore
MA
,
Drukker
CA
, et al.
Prospective cost-effectiveness analysis of genomic profiling in breast cancer . Eur J Cancer.
2013; ; 49 : :3773.–3779. 20.
Roche
H
,
Fumoleau
P
,
Spielmann
M
, et al.
Sequential adjuvant epirubicin-based and docetaxel chemotherapy for node-positive breast cancer patients: the FNCLCC PACS 01 Trial . J Clin Oncol.
2006; ; 24 : :5664.–5671. 21.
Bertucci
F
,
Borie
N
,
Roche
H
, et al.
Gene expression profile predicts outcome after anthracycline-based adjuvant chemotherapy in early breast cancer . Breast Cancer Res Treat.
2011; ; 127 : :363.–373. 22.
Ladislav
S.
Toxicities of taxanes . J Cancer Res Ther.
2013; ; 9 : :161.. 23.
Marino
P
,
Siani
C
,
Roche
H
, et al.
Cost-effectiveness of adjuvant docetaxel for node-positive breast cancer patients: results of the PACS 01 economic study . Ann Oncol.
2010; ; 21 : :1448.–1454. 24.
Eichler
HG
,
Bloechl-Daum
B
,
Abadie
E
, et al.
Relative efficacy of drugs: an emerging issue between regulatory agencies and third-party payers . Nat Rev Drug Discov.
2010; ; 9 : :277.–291. 25.
Schreyogg
J
,
Baumler
M
,
Busse
R
. Balancing adoption and affordability of medical devices in Europe . Health Policy.
2009; ; 92 : :218.–224. 26.
Meckley
LM
,
Neumann
PJ
. Personalized medicine: factors influencing reimbursement . Health Policy.
2010; ; 94 : :91.–100. 27.
Seror
V
,
Elasri
K
,
Avenel
E
. Premières applications de la pharmacogénomique en oncologie - stratégies industrielles et enjeux de régulation publique . Revue d’Économie Industrielle.
2007; ; 120 : :235.–252. 28.
Bobinac
A
,
van Exel
J
,
Rutten
FF
,
Brouwer
WB
. The value of a QALY: individual willingness to pay for health gains under risk . Pharmacoeconomics.
2014; ; 32 : :75.–86. 29.
Robinson
A
,
Gyrd-Hansen
D
,
Bacon
P
, et al.
Estimating a WTP-based value of a QALY: the chained approach . Soc Sci Med.
2013; ; 92 : :92.–104. 30.
Aspinall
MG
,
Hamermesh
RG
. Realizing the promise of personalized medicine . Harv Bus Rev.
2007; ; 85 : :108.–117, 165.. |