| |
| Med Sci (Paris). 2014 February; 30(2): 160–165. Published online 2014 February 24. doi: 10.1051/medsci/20143002013.L’interleukine-7 comme thérapeutique immuno-adjuvante dans le traitement du choc septique Guillaume Monneret,1,2* Astrid Villars-Méchin,1 Julie Demaret,1,2 Anne-Perrine Foray,1 and Fabienne Venet1,2 1Hospices civils de Lyon, hôpital Edouard Herriot, laboratoire d’immunologie cellulaire, 5, place d’Arsonval, 69437Lyon Cedex 03, France 2EAM 4174 Hémostase, sepsis, inflammation, Hospices civils de Lyon, université Lyon I, Lyon, France |
Sepsis et choc septique : problèmes majeurs de santé publique
Les états septiques (association d’une infection et d’une réponse inflammatoire systémique) restent un réel problème de santé publique, car ils concernent près de 80 000 patients par an en France, un million aux États-Unis et une estimation basse de 20 millions dans le monde. Ils regroupent différents types d’infections (septicémie, pneumopathie, péritonite, pyélonéphrite, méningite, etc.) et représentent la première cause de mortalité dans un service de réanimation [
1–
3]. Leur incidence est en constante augmentation du fait du vieillissement de la population, de l’emploi croissant d’immunosuppresseurs, de chimiothérapies, et d’une meilleure prise en charge des comorbidités qui leur sont généralement associées (cancer, diabète, etc.). En dépit des progrès réalisés dans la prise en charge précoce des patients (remplissage vasculaire1, anti- biothérapie appropriée), la mortalité liée à ces syndromes reste élevée (30 à 40 % pour le choc septique, la forme la plus grave). Les hypothèses récentes font état de 10 000 décès quotidiens liés aux états septiques dans le monde. De nombreux essais de thérapeutiques adjuvantes ont été conduits depuis 25 ans et se sont révélés infructueux. D’une manière générale, les molécules testées visaient à bloquer la réponse inflammatoire par différentes approches : anticorps anti-TNF (tumor necrosis factor), anti-IL-1, anti-LPS (lipopolysaccharide), ou anti-TLR4 (Toll-like receptor 4) [3]. Les données récentes démontrent que, si la phase précoce du syndrome est probablement due à une réponse inflammatoire exacerbée (responsable des défaillances d’organe), elle est très rapidement compensée par des mécanismes immunosuppresseurs [1,
2]. Alors que certains experts proposent une évolution schématiquement biphasique de la balance pro/anti-inflammatoire au cours du temps, d’autres considèrent que les deux réponses sont concomitantes. Au final, les deux possibilités convergent vers une même situation, et il s’avère que les patients septiques présentent, rapidement après le début du syndrome, des signes majeurs d’immunodépression [1]. Cette dernière explique, au moins en partie, l’échec des thérapeutiques anti-inflammatoires dans le choc septique. En effet, grâce aux progrès de la prise en charge précoce des patients (remplissage, antibiothérapie probabiliste2 précoce) et hormis quelques situations particulières mais assez rares (méningococcies, pneumococcies fulminantes), peu de patients décèdent précocement. L’essentiel de la mortalité est donc tardive, dans un contexte d’immunosuppression favorisant la survenue d’infections secondaires et ne justifiant probablement pas une approche anti-inflammatoire. |
Immunodépression induite par le choc septique L’immunodépression des patients de réanimation est connue depuis les années 1970 (anergie cutanée à des allergènes de rappel) [
4]. Le développement d’outils biologiques simples et standardisés permettant une évaluation rapide de l’immunocompétence des patients a permis de mieux en décrire les caractéristiques. Il est maintenant admis que l’ensemble des fonctions immunitaires sont profondément altérées. Plusieurs mécanismes opèrent de concert : production massive d’IL-10 (médiateur puissamment immunosuppresseur), phénomène de tolérance à l’endotoxine, régulation épigénétique et déclenchement de processus apoptotiques de grande ampleur [2,
5,
6]. Les conséquences sont systémiques (sang circulant, rate, poumons) et affectent les deux bras de la réponse immunitaire. En premier lieu, la réponse innée est atteinte. Différentes anomalies sont documentées : diminution de la phagocytose et de la bactéricidie (monocytes, polynucléaires neutrophiles), diminution du chimiotactisme (monocytes, polynucléaires neutrophiles), déficit de production des cytokines pro-inflammatoires en réponse à une re-stimulation bactérienne (phénomène de tolérance à l’endotoxine), diminution du nombre de cellules dendritiques circulantes, et altération de la présentation de l’antigène par les cellules présentatrices d’antigènes du fait de la diminution, voire de la disparition, des molécules HLA-DR (human leukocyte antigen-DR, complexe majeur d’histocompatibilité de classe II) à la surface de ces cellules [5, 6]. |
Altérations lymphocytaires T induites par le choc septique Lymphopénie et apoptose Une lymphopénie sévère est souvent retrouvée après un choc septique [
7]. En effet, il a été observé que le sepsis représente la première cause de lymphopénie chez les patients hospitalisés, devant les pathologies hématologiques, la transplantation ou l’infection par le VIH (virus de l’immunodéficience humaine) [ 7]. Toutes les populations lymphocytaires sont affectées, à l’exception des lymphocytes T régulateurs (voir plus loin) [
8]. L’amplitude de la lymphopénie est corrélée à la survenue d’infections nosocomiales et/ou à la mortalité [
9–
11]. Elle peut durer plusieurs semaines, et l’absence de retour à un compte lymphocytaire normal est associée à des complications infectieuses tardives. Cette lymphopénie est principalement due à des processus apoptotiques décrits en détail par l’équipe du Pr Hotchkiss [ 2]. Sous-populations lymphocytaires T CD4+
Les sous-populations de lymphocytes T CD4 +
helper (Th) sont schématiquement classées en cellules Th1, Th2 et Th17 en fonction des cytokines qu’elles produisent. Initialement, il a été montré que les lignées Th1 et Th2 étaient altérées (production de cytokines et expression des facteurs de transcription [Tbet ( Th1-specific T box transcription factor)/Gata-3 ( Gata binding protein 3)] diminuées) [ 5]. Il s’agit d’un phénomène contrôlé par la méthylation des histones et le remodelage de la chromatine [
12]. Récemment explorée du fait de son identification plus tardive, la lignée Th17 est également atteinte : diminution de production d’IL-17 et d’IL-22, et altération de l’expression de ROR-γt, le facteur de transcription qui lui est spécifique [8,
13]. Connaissant le rôle clé des cellules Th17 dans la réponse aux bactéries extracellulaires et aux champignons, les dysfonctionnements de ces cellules expliquent, au moins en partie, la survenue accrue d’infections nosocomiales, en particulier candidoses et aspergilloses. Différents modèles animaux de péritonites mimant le choc septique et l’immunodépression qu’il induit ont reproduit ce risque de surinfection fongique. Le lymphocyte T « exténué » Le phénotype correspondant aux lymphocytes T dits exténués (traduction de T-cell exhaustion) a été initialement décrit chez la souris souffrant d’infections virales chroniques [
14]. Il a été ensuite identifié en clinique humaine (cancers et infections chroniques) [
15]. Il correspond à une perte progressive de la fonctionnalité des cellules : perte de la production de cytokines (IL-2, TNF, IFN-γ [interféron-γ]), diminution de la prolifération lymphocytaire, perte des propriétés de cytotoxicité, et apoptose. Deux mécanismes expliquent ce phénomène : l’environnement cellulaire riche en cytokines immunosuppressives et l’apparition de molécules de corégulation inhibitrices (PD-1 [ programmed cell death protein-1], CTLA-4 [ cytotoxic T-lymphocyte antigen-4], LAG-3 [ lymphocyte-activation gene-3], TIM, etc.). Toutes ces caractéristiques sont retrouvées chez les patients ayant survécu à un choc septique (Figure 1).
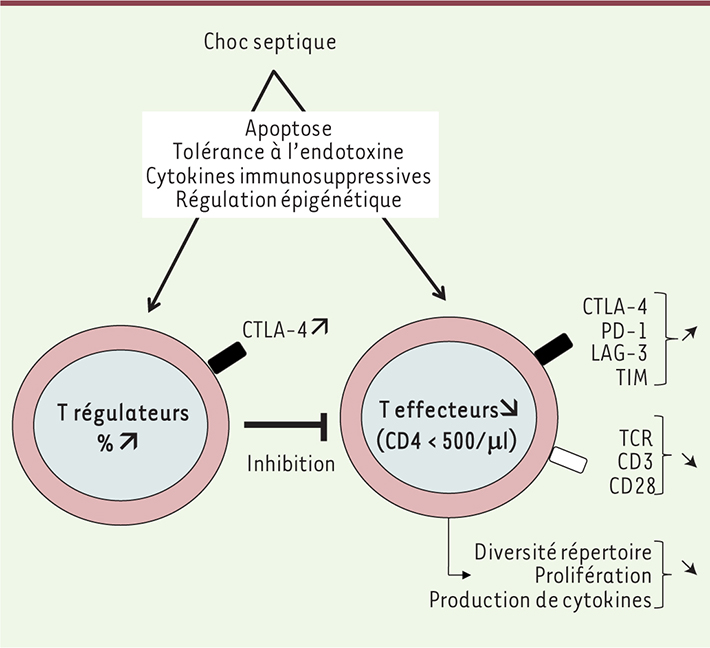
 | Figure 1.
Conséquences du choc septique sur les lymphocytes T CD4+. Les caractéristiques des lymphocytes T exténués sont présentes après un choc septique. Ce phénomène s’explique par la surexpression de molécules inhibitrices (CTLA-4, PD-1, LAG-3 et TIM), et par une diminution de l’expression du TCR et des molécules CD3 et CD28. Par ailleurs, une augmentation des lymphocytes T régulateurs a été rapportée. |
La surexpression des molécules inhibitrices est maintenant documentée par plusieurs équipes distinctes, y compris au niveau d’organes comme la rate [
16–
18]. Elle est globalement associée à la mortalité. Plus spécifiquement, les molécules de la famille PD-1 sont associées à la survenue d’infections nosocomiales, ainsi qu’à la diminution de la prolifération lymphocytaire après un choc septique [18]. D’une manière générale, la prolifération lymphocytaire mesurée ex vivo est très diminuée après un choc septique, quels que soient les inducteurs utilisés : anticorps anti-CD3/CD28, PHA (phytohemagglutinin), PMA (phorbol 12-myristate 13-acetate), et ConA (concanavaline A) [5]. La production de cytokines est également abaissée et nous avons évoqué précédemment le déclenchement de processus apoptotiques [2]. Toutes les caractéristiques du lymphocyte T exténué sont donc présentes après un choc septique. D’un point de vue fonctionnel, cette anergie lymphocytaire peut se mesurer in vivo chez les patients. En effet, ces derniers présentent des réponses aux tests cutanés (intradermoréaction aux antigènes de rappel) très altérées. La négativité aux tests cutanés est associée à la mortalité et aux infections nosocomiales [
19]. Altérations du récepteur T (TCR) Sur un plan quantitatif, l’expression du TCR est diminuée après un choc septique. Cela est illustré par la forte diminution de l’expression des molécules CD3 (stœchiométriquement associées au TCR). Cette baisse est accentuée chez les patients qui vont décéder [
20]. Sur le plan qualitatif, nous avons observé de graves altérations dans la diversité du répertoire T à la suite d’un choc septique [
21]. Cette moindre diversité, indépendante de la lymphopénie, était associée à la mortalité et à la survenue d’infections nosocomiales [ 21]. Augmentation des cellules T régulatrices Initialement décrite en 2003 [
22], l’augmentation du pourcentage de lymphocytes T régulateurs (Treg) circulants a été largement confirmée au gré de l’amélioration de leur phénotypage par cytométrie en flux [
23]. Cette élévation persiste chez les patients qui vont décéder [ 22]. Plusieurs études chez l’animal ont confirmé l’augmentation des Treg circulants et montré que leur inhibition restaurait la prolifération lymphocytaire, améliorait les défenses antimicrobiennes et augmentait la survie des animaux. Étant capables d’agir négativement sur les réponses innées et adaptatives, ces cellules jouent probablement un rôle important dans la survenue des infections nosocomiales après un choc septique. |
Immunostimulation comme thérapeutique adjuvante dans le traitement du choc septique Données générales Il résulte de l’immunodépression induite par le choc septique une incapacité à correctement éliminer le foyer infectieux initial, ainsi qu’une susceptibilité accrue aux infections nosocomiales secondaires, aux réactivations virales (HSV [ herpes simplex virus], CMV [cytomégalovirus]) ou aux infections fongiques [ 1]. Quand elles sont quantifiées, l’amplitude et la persistance dans le temps de l’immunodépression sont la plupart du temps corrélées à une augmentation de la mortalité [ 6]. Sachant que la grande majorité des patients survivent aux premières heures du syndrome, la mortalité survient donc principalement à distance du choc (ou des défaillances initiales d’organes) dans un contexte potentiellement immunosuppresseur. Des données récentes agrégeant plusieurs études de suivi immunitaire montrent que les patients qui normalisent progressivement leurs fonctions immunitaires (en général en moins d’une semaine) vont évoluer favorablement et rester indemnes d’infection nosocomiale. À l’inverse, les patients dont les dysfonctionnements immunitaires persistent au cours du temps auront tendance à développer plus d’infections secondaires et seront à risque élevé de décès. Ce groupe représente plus de 50 % des patients ayant présenté un choc septique, et compte pour 65 % de la mortalité totale [ 6]. La prise en compte de cette immunodépression et son traitement potentiel sont donc devenus un réel enjeu thérapeutique [
24]. Les premiers essais ont cherché à stimuler le versant inné de la réponse immunitaire en utilisant l’IFN-γ et le GM-CSF ( granulocyte-macrophage colony-stimulating factor), et ont donné des résultats prometteurs [
25,
26]. La description exhaustive des profondes altérations lymphocytaires associées aux premiers résultats convaincants des essais cliniques évaluant l’interleukine-7 (IL-7) recombinante humaine utilisée dans des contextes lymphopéniques ont fait émerger cette nouvelle approche thérapeutique dans le traitement du choc septique. L’IL-7 et son récepteur L’IL-7 (25 kDa) appartient à une famille d’hématopoïétines regroupant les cytokines de classe 1 (IL-2, IL-3, IL-4, IL-5, GM-CSF, IL-9, IL-13, IL-15). Elle est synthétisée principalement par les cellules du stroma épithélial du thymus et de la moelle osseuse. Son récepteur est composé de deux protéines : une chaîne α ou IL-7Rα (CD127) et une chaîne commune aux cytokines de classe 1 : γc (CD132) [
27,
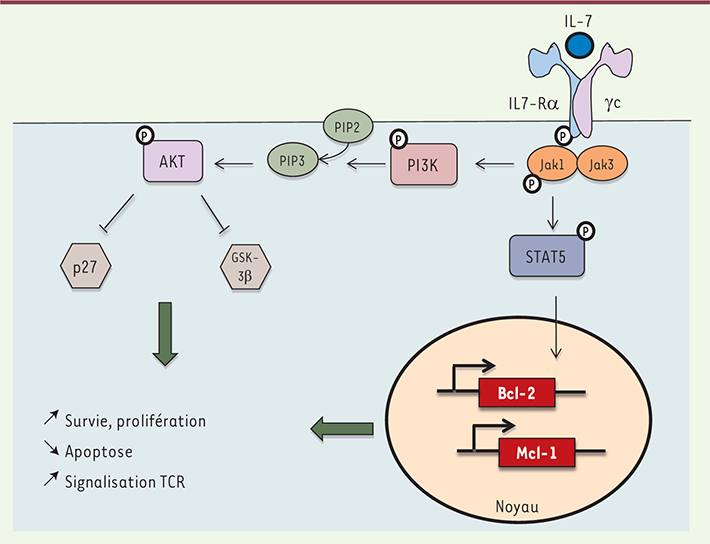
28]. Cette dernière est exprimée par l’ensemble des cellules hématopoïétiques. L’IL-7Rα est exprimé essentiellement par les cellules de la lignée lymphoïde, telles que les lymphocytes B immatures, les thymocytes et la majorité des lymphocytes T matures. Il n’est pas ou peu exprimé sur les Treg. La liaison de l’IL-7 sur la chaîne α de son récepteur conduit à une hétérodimérisation α-γc qui entraîne l’activation de Jak3 ( Janus kinase 3, tyrosine kinase associée de manière constitutive à la région carboxy-terminale de la chaîne γc) (Figure 2). Jak3, une fois activée, entraîne la phosphorylation de Jak1 et du CD127. Cette étape conduit à la création de sites de liaison pour les facteurs de transcription STAT ( signal transducer and activator of transcription)-1, -2, -3 et -5 qui seront à leur tour phosphorylés, puis transloqués vers le noyau de la cellule, aboutissant à l’activation de gènes anti-apoptotiques (voir plus loin). Par ailleurs, la voie de signalisation par la PI3K ( phosphoinositide 3-kinase) (activée par Jak1) permet le recrutement d’AKT (protéine kinase B) au niveau membranaire où elle est activée. AKT favorise la stabilité de c-myc et de la cycline-D, deux protéines intervenant dans l’activation du cycle cellulaire. Cet effet est obtenu par inactivation de GSK-3β ( glycogen synthase kinase-3β), inhibiteur de ces deux protéines. De plus, AKT inhibe la transcription de médiateurs de l’apoptose et de gènes intervenant dans l’inhibition du cycle cellulaire.
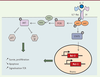 | Figure 2.
Signal intracellulaire relayé par l’IL-7. La liaison de l’IL-7 sur son récepteur (constitué de deux chaînes, IL-7Rα [CD127] et IL-7RγC [CD132]) conduit à l’activation de Jak3 et de Jak1, puis des facteurs de transcription STAT, aboutissant à l’activation de gènes anti-apoptotiques. Par ailleurs, Jak1, via la PI3K, active AKT qui inhibe l’apoptose et stimule la prolifération cellulaire. |
Fonctions biologiques de l’IL-7 [ 27, 28] L’IL-7 est principalement un facteur de survie pour différentes sous-populations de progéniteurs et de cellules lymphoïdes matures. L’IL-7, d’une part, induit la synthèse de facteurs anti-apoptotiques (Bcl-2 [ B-cell lymphoma 2], Bcl-xl [ B-cell lymphoma-extra large]) et, d’autre part, inhibe l’apoptose par suppression de l’activité de protéines pro-apoptotiques (Bax [ Bcl-2-associated X protein], Bim). Ainsi, l’IL-7 agit principalement sur la survie, l’homéostasie, le développement et la prolifération des lymphocytes T. Chez l’homme, elle est indispensable (cytokine non redondante) à leur développement (survie des thymocytes double négatifs/réarrangement du TCR/maturation/différenciation) au niveau du thymus, mais également au niveau des tissus lymphoïdes périphériques. L’IL-7 est en effet disponible en permanence au niveau des organes lymphoïdes secondaires du fait de sa production continue par les cellules stromales. De ce fait, elle induit de façon ininterrompue des signaux anti-apoptotiques et de costimulation essentiels à la survie des lymphocytes T naïfs. Elle est ainsi impliquée dans la régulation de la prolifération des lymphocytes T CD4 + et des CD8 + en réponse à une lymphopénie. L’IL-7 joue également un rôle dans la transition des lymphocytes T effecteurs aux lymphocytes T mémoires. Bien que le CD127 soit exprimé par un large éventail de lymphocytes T, l’IL-7 agit de façon préférentielle sur certaines sous-populations. Par exemple, l’action de l’IL-7 est plus puissante sur les lymphocytes T naïfs et sur les « récents émigrants du thymus » (RTE), chez lesquels elle peut induire une prolifération même en l’absence de signalisation par le TCR. En augmentant préférentiellement l’expansion des RTE et des lymphocytes T naïfs comparativement aux lymphocytes T effecteurs, l’IL-7 entraîne une diversification du répertoire du TCR. En lien avec ses actions sur la prolifération et sur la diversité du répertoire T, l’IL-7 est capable de restaurer, dans le lymphocyte T exténué, un phénotype à nouveau fonctionnel. Elle restaure la production de cytokines, diminue l’expression des molécules de corégulation inhibitrices (PD-1) et augmente l’expression des molécules d’adhésion nécessaires au chimiotactisme vers les sites infectés. Enfin, son administration diminue le pourcentage de Treg circulants. IL-7 et essais cliniques Dans les essais cliniques [ 27,
29], l’IL-7 a été utilisée dans le traitement des patients présentant des lymphopénies idiopathiques ou des pathologies induites par une lymphopénie sévère (patients infectés par le VIH avec lymphopénie persistante en dépit d’une thérapie antirétrovirale efficace). Elle est également utilisée pour stimuler l’immunité et améliorer la clairance virale chez des patients infectés par le virus JC 3. Une autre utilisation, actuellement évaluée dans plusieurs types de cancer, a pour but d’accélérer la reconstitution immune après chimiothérapie. Elle est également testée dans la reconstitution post-greffe de moelle osseuse. À l’heure actuelle, les premiers résultats sont prometteurs. L’IL-7 induit une augmentation rapide de cellules T circulantes (l’effet est stable plusieurs mois), une augmentation de la diversité du répertoire et une diminution du pourcentage de Treg circulants. Plus de 500 patients ont reçu de l’IL-7 dans différentes situations cliniques et aucun effet indésirable notoire n’a été signalé. Néanmoins, la surveillance à plus long terme d’éventuels effets indésirables (apparition ou réactivation de pathologies auto-immunes, de pathologies hématologiques touchant la lignée lymphoïde) reste de rigueur avant de pouvoir définitivement conclure à l’innocuité de la molécule. IL-7 et sepsis Aucun essai clinique n’a été mené en clinique humaine dans cette indication. Néanmoins, deux approches expérimentales renforcent l’idée que l’IL-7 pourrait être utile chez les patients septiques présentant de sévères altérations lymphocytaires. Premièrement, dans les modèles animaux de choc septique reproduisant la situation clinique (modèle de péritonite induisant une immunodépression favorisant les infections secondaires), l’IL-7 prévient la mortalité et les infections secondaires fongiques ou bactériennes, améliore la survie des lymphocytes ainsi que leur chimiotactisme, restaure la production d’IFN-γ et la réactivité aux tests cutanés [
30,
31]. Deuxièmement, ex vivo, l’IL-7 restaure la fonctionnalité des lymphocytes de patients septiques. Dans un travail récent [
32], il a été montré que l’administration d’IL-7 améliorait toutes les anomalies induites par le choc septique : prolifération lymphocytaire (des lymphocytes T CD4 + et CD8 +), production d’IFN-γ, phosphorylation de STAT5, induction de Bcl-2 après stimulation du TCR ( via des anticorps anti-CD3/CD2/CD28). L’IL-7 permettait un retour à des valeurs observées chez des sujets sains [ 32]. Ces résultats montrent que la voie de l’IL-7 (récepteur/signal intracellulaire) reste mobilisable après un choc septique. On connaît par ailleurs ses effets sur les Treg, sur la diversité du récepteur, sur le chimiotactisme, qui se surajoutent aux améliorations observées ex vivo. Il est raisonnable de penser que l’IL-7 représente une réelle alternative thérapeutique en agissant sur les nombreuses facettes des altérations lymphocytaires induites par le choc septique. De plus, considérant le rôle clé des lymphocytes T CD4 + dans l’orchestration de la réponse immunitaire, l’hypothèse d’une stimulation de l’immunité innée [
33] et, plus particulièrement, de l’augmentation de l’expression monocytaire de HLA-DR via la production d’IFN-γ, est également fondée. Elle reste néanmoins à être établie. |
Le choc septique induit une profonde immunodépression qui atteint le versant adaptatif de la réponse immunitaire. L’amplitude et la persistance dans le temps des altérations lymphocytaires sont associées à un mauvais pronostic et à la survenue d’infections nosocomiales. De ce fait, l’immunostimulation est aujourd’hui considérée comme une réelle option thérapeutique adjuvante et l’IL-7, compte tenu des premiers résultats obtenus dans diverses situations cliniques, est un candidat de choix. Il est entendu que cette approche thérapeutique ne sera menée que sur la base d’un suivi immunitaire [6] et sera dans un premier temps réservée aux seuls patients présentant une lymphopénie sévère persistante et/ou des dysfonctionnements lymphocytaires établis. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les auteurs sont soutenus par les Hospices civils de Lyon.
|
Footnotes |
1.
Hotchkiss
RS
,
Monneret
G
,
Payen
D
. Immunosuppression in sepsis: a novel understanding of the disorder and a new therapeutic approach . Lancet Infect Dis.
2013; ; 13 : :260.–268. 2.
Hotchkiss
RS
,
Karl
IE
. The pathophysiology and treatment of sepsis . N Engl J Med.
2003; ; 348 : :138.–150. 3.
Angus
DC
,
van der Poll
T
. Severe sepsis and septic shock . N Engl J Med.
2013; ; 369 : :840.–851. 4.
Meakins
JL
,
Pietsch
JB
,
Bubenick
O
, et al.
Delayed hypersensitivity: indicator of acquired failure of host defenses in sepsis and trauma . Ann Surg.
1977; ; 186 : :241.–250. 5.
Monneret
G
,
Venet
F
,
Pachot
A
,
Lepape
A
. Monitoring immune dysfunctions in the septic patient: a new skin for the old ceremony . Mol Med.
2008; ; 14 : :64.–78. 6.
Venet
F
,
Lukaszewicz
AC
,
Payen
D
, et al.
Monitoring the immune response in sepsis: a rational approach to administration of immunoadjuvant therapies . Curr Opin Immunol.
2013; ; 25 : :477.–483. 7.
Castelino
DJ
,
McNair
P
,
Kay
TW
. Lymphocytopenia in a hospital population-what does it signify?
Aust NZ J Med.
1997; ; 27 : :170.–174. 8.
Venet
F
,
Davin
F
,
Guignant
C
, et al.
Early assessment of leukocyte alterations at diagnosis of septic shock . Shock.
2010; ; 34 : :358.–363. 9.
Le Tulzo
Y
,
Pangault
C
,
Gacouin
A
, et al.
Early circulating lymphocyte apoptosis in human septic shock is associated with poor outcome . Shock.
2002; ; 18 : :487.–494. 10.
Felmet
KA
,
Hall
MW
,
Clark
RS
, et al.
Prolonged lymphopenia, lymphoid depletion, and hypoprolactinemia in children with nosocomial sepsis and multiple organ failure . J Immunol.
2005; ; 174 : :3765.–3772. 11.
Inoue
S
,
Suzuki-Utsunomiya
K
,
Okada
Y
, et al.
Reduction of immunocompetent T cells followed by prolonged lymphopenia in severe sepsis in the elderly . Crit Care Med.
2013; ; 41 : :810.–819. 12.
Carson
WF
,
Cavassani
KA
,
Dou
Y
,
Kunkel
SL
. Epigenetic regulation of immune cell functions during post-septic immunosuppression . Epigenetics.
2011; ; 6 : :273.–283. 13.
Van de Veerdonk
FL
,
Mouktaroudi
M
,
Ramakers
BP
, et al.
Deficient Candida-specific T-helper 17 response during sepsis . J Infect Dis.
2012; ; 206 : :1798.–1802. 14.
Zajac
AJ
,
Blattman
JN
,
Murali-Krishna
K
, et al.
Viral immune evasion due to persistence of activated T cells without effector function . J Exp Med. ; 188 : :2205.–2213. 15.
Wherry
EJ
. T cell exhaustion . Nat Immunol.
2011; ; 12 : :492.–499. 16.
Boomer
JS
,
Shuherk-Shaffer
J
,
Hotchkiss
RS
,
Green
JM
, A prospective analysis of lymphocyte phenotype, function over the course of acute sepsis . Crit Care.
2012; ; 16 : :R112.. 17.
Boomer
JS
,
To
K
,
Chang
KC
, et al.
Immunosuppression in patients who die of sepsis and multiple organ failure . JAMA.
2011; ; 306 : :2594.–2605. 18.
Guignant
C
,
Lepape
A
,
Huang
X
, et al.
Programmed death-1 levels correlate with increased mortality, nosocomial infection, immune dysfunctions in septic shock patients . Crit Care.
2011; ; 15 : :R99.. 19.
Christou
NV
,
Meakins
JL
,
Gordon
J
, et al.
The delayed hypersensitivity response and host resistance in surgical patients. 20 years later . Ann Surg.
1995; ; 222 : :534.–548. 20.
Venet
F
,
Bohe
J
,
Debard
AL
, et al.
Both percentage of gammadelta T lymphocytes and CD3 expression are reduced during septic shock . Crit Care Med.
2005; ; 33 : :2836.–2840. 21.
Venet
F
,
Filipe-Santos
O
,
Lepape
A
, et al.
Decreased T cell repertoire diversity in sepsis: a preliminary study . Crit Care Med.
2013; ; 41 : :111.–119. 22.
Monneret
G
,
Debard
AL
,
Venet
F
, et al.
Marked elevation of human circulating CD4+CD25+ regulatory T cells in sepsis-induced immunoparalysis . Crit Care Med.
2003; ; 31 : :2068.–2071. 23.
Venet
F
,
Chung
CS
,
Kherouf
H
, et al.
Increased circulating regulatory T cells (CD4+CD25+CD127-) contribute to lymphocyte anergy in septic shock patients . Intensive Care Med.
2009; ; 35 : :678.–686. 24.
Hotchkiss
RS
,
Opal
S
. Immunotherapy for sepsis-a new approach against an ancient foe . N Engl J Med.
2010; ; 363 : :87.–89. 25.
Docke
WD
,
Randow
F
,
Syrbe
U
, et al.
Monocyte deactivation in septic patients: restoration by IFN-gamma treatment . Nat Med.
1997; ; 3 : :678.–681. 26.
Meisel
C
,
Schefold
JC
,
Pschowski
R
, et al.
Granulocyte-macrophage colony-stimulating factor to reverse sepsis-associated immunosuppression: a double-blind, randomized, placebo-controlled multicenter trial . Am J Respir Crit Care Med.
2009; ; 180 : :640.–648. 27.
Mackall
CL
,
Fry
TJ
,
Gress
RE
. Harnessing the biology of IL-7 for therapeutic application . Nat Rev Immunol.
2011; ; 11 : :330.–342. 28.
Lundstrom
W
,
Fewkes
NM
,
Mackall
CL
. IL-7 in human health and disease . Semin Immunol.
2012; ; 24 : :218.–224. 29.
Morre
M
,
Beq
S
. Interleukin-7 and immune reconstitution in cancer patients: a new paradigm for dramatically increasing overall survival . Target Oncol.
2012; ; 7 : :55.–68. 30.
Unsinger
J
,
Burnham
CA
,
McDonough
J
, et al.
Interleukin-7 ameliorates immune dysfunction and improves survival in a 2-hit model of fungal sepsis . J Infect Dis.
2012; ; 206 : :606.–616. 31.
Unsinger
J MM
,
Kasten
KR
,
Hoekzema
AS
, et al.
IL-7 Promotes T cell viability, trafficking, and functionality and improves survival in sepsis . J Immunol.
2010; ; 184 : :3768.–3779. 32.
Venet
F
,
Foray
AP
,
Villars-Mechin
A
, et al.
IL-7 restores lymphocyte functions in septic patients . J Immunol.
2012; ; 189 : :5073.–5081. 33.
Kasten
KR
,
Prakash
PS
,
Unsinger
J
, et al.
Interleukin-7 (IL-7) treatment accelerates neutrophil recruitment through gamma delta T-cell IL-17 production in a murine model of sepsis . Infect Immun.
2010; ; 78 : :4714.–4722. |