| |
| Med Sci (Paris). 2014 January; 30(1): 18–21. Published online 2014 January 24. doi: 10.1051/medsci/20143001005.Ramollir le cortex Un prérequis à l’asymétrie de la division ovocytaire Agathe Chaigne,1,2 Marie-Hélène Verlhac,1,2** and Marie-Emilie Terret1,2* 1Centre interdisciplinaire de recherche en biologie, CNRS-UMR7241, Inserm-U1050, Équipe labellisée Ligue contre le cancer, Collège de France, 11, place Marcelin Berthelot, 75005Paris, France 2Memolife Laboratory of Excellence and Paris Science Lettre, Paris, F-75005, France MeSH keywords: Animaux, Division cellulaire, Cytocinèse, physiologie, Femelle, Haploïdie, Humains, Mâle, Mammifères, Méiose, Ovocytes, cytologie |
Former un embryon diploïde nécessite la mise en commun de la moitié des génomes du père et de la mère. La différenciation des gamètes (ovocyte et spermatozoïde) s’accompagne donc d’une réduction du nombre de chromosomes pour passer d’une cellule diploïde à une cellule haploïde. Cette réduction du matériel génétique se produit lors de la méiose et s’accompagne d’une division cellulaire et d’une spécialisation indispensables au développement du nouvel individu. Chez la femelle, tout en éliminant la moitié du génome, l’ovocyte conserve un maximum de cytoplasme contenant les réserves stockées lors de sa croissance, ce qui est indispensable pour toutes les espèces à développement externe où l’embryon se développe uniquement grâce à ces réserves accumulées. Comment ce partitionnement inégal est-il réalisé dans l’ovocyte de mammifère ? |
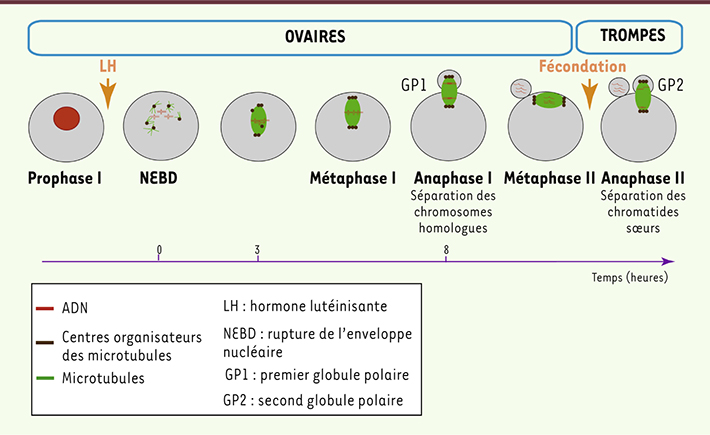
La division de l’ovocyte, une division asymétrique La méiose commence avant la naissance dans les gonades embryonnaires ; les ovocytes restent bloqués en prophase de première division (méiose I) jusqu’à la puberté chez les mammifères. Puis, tous les mois, un pic de LH (hormone lutéinisante) provoque la reprise de la méiose et sa dernière étape, la maturation méiotique. Le premier événement remarquable est la rupture de l’enveloppe nucléaire (NEBD : nuclear envelope breakdown) qui est suivie par la formation d’un fuseau de microtubules autour des chromosomes répliqués et appariés au niveau des chiasma (Figure 1). Ce fuseau se forme à l’emplacement du noyau, quasiment au centre de la cellule. Chez la souris, cinq à six heures après NEBD, le fuseau migre selon son grand axe vers le cortex le plus proche [
1], et, huit à neuf heures après NEBD, une première division asymétrique a lieu avec expulsion d’un premier globule polaire contenant la moitié des chromosomes homologues et une quantité de cytoplasme réduite à son minimum. Le fuseau de deuxième division méiotique se reforme directement excentré et parallèle au cortex. L’ovocyte reste bloqué en attente de la fécondation, qui déclenchera l’achèvement de la méiose avec l’expulsion du second globule polaire contenant la moitié des chromatides sœurs.
 | Figure 1.
Principaux événements de la maturation méiotique de l’ovocyte de souris. L’ovocyte est arrêté dans l’ovaire en prophase de première division de méiose (prophase I). La maturation méiotique est déclenchée par le pic de LH (hormone lutéinisante) qui provoque la rupture de l’enveloppe nucléaire (NEBD). Le fuseau de microtubules est formé environ trois heures après NEBD et il migre au cortex à partir de NEBD + 6 h. L’anaphase I, qui consiste en la séparation des chromosomes homologues, est suivie de la cytokinèse, ici l’extrusion du premier globule polaire (GP1). Le fuseau se reforme ensuite parallèlement au cortex, et l’ovocyte reste arrêté en métaphase II. L’anaphase II, qui séparera les chromatides sœurs, sera déclenchée dans les trompes par la fécondation, menant à l’extrusion du second globule polaire (GP2). |
L’asymétrie des divisions méiotiques est permise par le positionnement périphérique des fuseaux de division dans cette très grosse cellule de 80 µm de diamètre. Quels sont les mécanismes de positionnement du fuseau? |
Les mécanismes de positionnement du fuseau Lors de la division des cellules somatiques, le fuseau est positionné grâce aux microtubules astraux, nucléés par les centrosomes qui organisent également pôles et microtubules du fuseau. Les ovocytes sont dépourvus de centrosomes canoniques et possèdent à la place des MTOC (microtubule organizing centers) dépourvus de centrioles. Le positionnement du fuseau ne dépend donc pas des microtubules, mais de l’actine [1,
2]. En prophase, les ovocytes présentent un réseau de microfilaments d’actine très dense qui se désagrège à NEBD [
3], puis réapparaît progressivement formant un réseau cytoplasmique très dynamique comprenant également une cage d’actine entourant le fuseau de microtubules [
4,
5] (Figure 2A). Ce réseau dépend de la formine-2, un nucléateur de filaments droits d’actine [4–
7], de spire 1/2 [
8] et d’un ensemble de vésicules qui sont situées aux nœuds du réseau d’actine et qui recrutent ces nucléateurs [
9]. Ce réseau d’actine et sa dynamique sont indispensables à la migration du fuseau puisque dans des ovocytes ne possédant pas la formine-2 [4, 5], ou possédant une quantité diminuée de spire 1/2 [8], ou dont la dynamique de l’actine est abolie [
10], le fuseau ne migre pas à la périphérie (ou cortex) de l’ovocyte. Par ailleurs, le positionnement du fuseau dépend également de la voie mos/MAPK (mitogen activated protein kinase) [1].
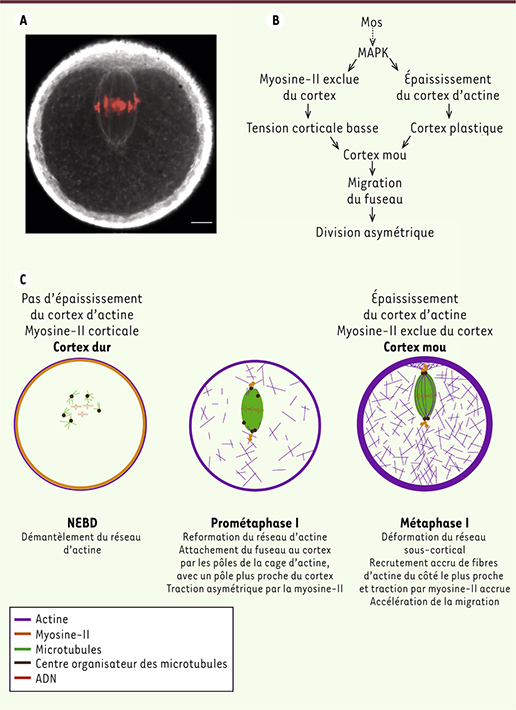
 | Figure 2.
Ramollir le cortex : un prérequis à l’asymétrie de la division ovocytaire. A. Réseaux d’actine dans un ovocyte en fin de méiose I (actine en blanc, chromosomes en rouge ; barre d’échelle : 10 µm). B. Rôle central de mos dans l’asymétrie de la division de l’ovocyte de souris en méiose I. Mos active la voie des MAPkinases, qui contribue à ramollir le cortex en délocalisant la myosine-II du cortex et en activant la nucléation d’un épaississement du cortex d’actine. Ce ramollissement est indispensable à la migration du fuseau au cortex. C. Modèle : pourquoi ramollir le cortex pour faire migrer le fuseau ? Le fuseau se forme où se trouvait le noyau c’est-à-dire légèrement excentré. Il est progressivement accroché par ses deux pôles au cortex dans un réseau d’actine en formation, avec de la myosine II aux pôles. Du fait de la plus grande proximité d’un des pôles au cortex, l’amplitude de la force de traction est asymétrique ce qui met le fuseau en mouvement. Le cortex mou se déforme en retour, ce qui permet le recrutement de plus de fibres d’actine, l’amplification du mouvement, et finalement la migration du fuseau jusqu’au cortex. |
|
Un cortex mou participe au positionnement asymétrique du fuseau Très récemment, un autre réseau d’actine a été observé : un épaississement du cortex d’actine, détectable trois heures après NEBD et atteignant une épaisseur maximale de 4 µm avant l’expulsion du globule polaire (Figure 2A) [
11]. Cet épaississement est nucléé par le nucléateur de filaments branchés Arp2/3 (actin related protein 2 et 3) ; il est également contrôlé par la voie mos/MAPK et est indispensable à la migration du fuseau [11]. Malgré la présence de ce réseau très épais, il a été montré par la technique d’aspiration à l’aide de micropipettes que dans les ovocytes de souris, la tension du cortex diminue au cours de la maturation méiotique [
12]. Au contraire, la tension corticale augmente dans les cellules somatiques qui se divisent, leur permettant de s’arrondir et de positionner leur fuseau via l’interaction entre microtubules astraux et cortex rigide. Afin de comprendre ce paradoxe, nous avons mesuré la tension corticale dans différentes conditions : dans des ovocytes contrôles (wt), qui présentent à la fois un réseau de microfilaments cytoplasmiques et un épaississement cortical en fin de méiose I, dans des ovocytes dépourvus de réseau cytoplasmique (formine-2-/-), ou d’épaississement cortical (mos-/-). La tension corticale est élevée en prophase dans ces trois cas, mais pour les ovocytes wt et formine-2-/-, elle diminue pendant la maturation méiotique. Au contraire, elle reste élevée dans les ovocytes dépourvus d’épaississement cortical (mos-/-). Comment expliquer cette chute de tension ? La myosine-II agit en coordination avec l’actine pour exercer des forces au sein de nombreux types cellulaires ; en particulier ces protéines sont responsables de l’augmentation de la tension corticale dans la plupart des cellules mitotiques. Dans les ovocytes, la myosine-II est enrichie au cortex des ovocytes en prophase contribuant ainsi à une tension élevée, puis elle est progressivement exclue du cortex, ce qui est reflété par la chute de tension corticale dans les stades tardifs de la méiose I. Cet évènement est également contrôlé par la voie mos/MAPK [11] ; ainsi dans les ovocytes mos-/- dépourvus d’épaississement cortical, la myosine-II est toujours enrichie au cortex en méiose I, ce qui corrèle avec le maintien d’une tension corticale élevée. En outre, l’épaississement du cortex d’actine contribue également à ramollir le cortex en augmentant sa plasticité, c’est-à-dire sa capacité à être déformé et à conserver la déformation (Figure 2B). Ce ramollissement est indispensable à la migration du fuseau puisque durcir le cortex artificiellement l’empêche [11]. Comment expliquer que ramollir le cortex soit indispensable à la migration du fuseau ? Tout d’abord, il faut comprendre les forces mises en jeu. Le réseau cytoplasmique nucléé par la formine-2 joue un rôle précoce dans la mise en mouvement initiale du fuseau [4, 5,
13]. Le fuseau, au départ un peu excentré, est tiré par l’interaction entre actine et myosine-II se situant aux pôles du fuseau [5,
6, 11,
14]. Cette traction s’exerce des deux côtés du fuseau, mais un pôle étant initialement plus proche du cortex, la force est plus grande de ce côté [
15]. La force de traction qui s’exerce sur le fuseau agit en retour sur le cortex de l’ovocyte, provoquant une déformation de l’épaississement du cortex d’actine (Figure 2A). D’après un modèle mathématique soutenu par les mesures de tension, si la tension est trop forte (cas des mos-/-), le cortex ne peut pas se déformer et amplifier le mouvement du fuseau ; la vitesse du fuseau reste faible, ce qui expliquerait que dans les ovocytes mos-/-, le fuseau demeure central pendant le temps de la division. En conditions physiologiques, le cortex se déforme asymétriquement, permettant le recrutement de plus de fibres d’actine et une amplification du mouvement : le fuseau accélère vers le cortex en fin de méiose I [1, 5, 13] (Figure 2C). |
Dépourvus des centrosomes qui positionnent les fuseaux des cellules somatiques, les ovocytes possèdent des mécanismes originaux actine-dépendants assurant l’asymétrie de leurs divisions, en modulant en particulier les propriétés physiques du cortex. Il est intéressant de remarquer que l’exclusion de la myosine-II du cortex ainsi que l’épaississement d’actine permettant de ramollir le cortex et faire migrer le fuseau sont tous les deux contrôlés par la même voie de signalisation, la voie mos/MAPK (Figure 2B). En outre, l’augmentation de la plasticité en fin de méiose I pourrait également jouer un rôle dans l’expulsion d’un petit globule polaire, assurant un maintien de la déformation locale du cortex pendant la cytokinèse. Ainsi la voie des MAPK, une voie ubiquitaire essentielle notamment dans la communication entre cellules, permettrait la coordination temporelle entre deux événements successifs au sein d’une même cellule. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ce travail est financé par la Ligue nationale contre le cancer (EL2012/LNCC/MHV). Agathe Chaigne est financée par l’école Normale Supérieure (ENS) de Paris.
|
1.
Verlhac
M-H
,
Lefebvre
C
,
Guillaud
P
, et al.
Asymmetric division in mouse oocytes: with or without Mos . Curr Biol.
2000; ; 10 : :1303.–1306. 2.
Longo
F
,
Chen
D
. Development of cortical polarity in mouse eggs: Involvement of the meiotic apparatus . Dev Biol.
1985; ; 107 : :382.–394. 3.
Azoury
J
,
Lee
KW
,
Georget
V
, et al.
Symmetry breaking in mouse oocytes requires transient F-actin meshwork destabilization . Development.
2011; ; 138 : :2903.–2908. 4.
Azoury
J
,
Lee
KW
,
Georget
V
, et al.
Spindle positioning in mouse oocytes relies on a dynamic meshwork of actin filaments . Curr Biol.
2008; ; 18 : :1514.–1519. 5.
Schuh
M
,
Ellenberg
J
. A New model for asymmetric spindle positioning in mouse oocytes . Curr Biol.
2008; ; 18 : :1986.–1992. 6.
Dumont
J
,
Million
K
,
Sunderland
K
, et al.
Formin-2 is required for spindle migration and for the late steps of cytokinesis in mouse oocytes . Dev Biol.
2007; ; 301 : :254.–265. 7.
Leader
B
,
Lim
H
,
Carabatsos
MJ
, et al.
Formin-2, polyploidy, hypofertility and positioning of the meiotic spindle in mouse oocytes . Nat Cell Biol.
2002; ; 4 : :921.–928. 8.
Pfender
S
,
Kuznetsov
V
,
Pleiser
S
, et al.
Spire-type actin nucleators cooperate with formin-2 to drive asymmetric oocyte division . Curr Biol.
2011; ; 21 : :955.–960. 9.
Schuh
M
. An actin-dependent mechanism for long-range vesicle transport . Nat Cell Biol.
2011; ; 13 : :1431.–1436. 10.
Holubcová
Z
,
Howard
G
,
Schuh
M
. Vesicles modulate an actin network for asymmetric spindle positioning . Nat Cell Biol.
2013; ; 15 : :937.–947. 11.
Chaigne
A
,
Campillo
C
,
Gov
NS
, et al.
A soft cortex is essential for asymmetric spindle positioning in mouse oocytes . Nat Cell Biol.
2013; ; 15 : :958.–966. 12.
Larson
SM
,
Lee
HJ
,
Hung
PH
, et al.
Cortical mechanics and meiosis II completion in mammalian oocytes are mediated by myosin-II and ezrin-radixin-moesin (ERM) proteins . Mol Biol Cell.
2010; ; 21 : :3182.–3192. 13.
Yi
K
,
Rubinstein
B
,
Unruh
JR
, et al.
Sequential actin-based pushing forces drive meiosis I chromosome migration and symmetry breaking in oocytes . J Cell Biol.
2013; ; 200 : :567.–576. 14.
Simerly
C
,
Nowak
G
,
Lanerolle
P de
, et al.
Differential expression and functions of cortical myosin IIA and IIB isotypes during meiotic maturation, fertilization, and mitosis in mouse oocytes and embryos . Mol Biol Cell.
1998; ; 9 : :2509.–2525. 15.
Maro
B
,
Verlhac
MH
. Polar body formation: new rules for asymmetric divisions . Nat Cell Biol.
2002; ; 4 : :E281.–E283. |