| |
| Med Sci (Paris). 2013 December; 29(12): 1151–1160. Published online 2013 December 20. doi: 10.1051/medsci/20132912020.Les leishmanioses vues au travers du réseau international des Instituts Pasteur Hechmi Louzir,1* Karim Aoun,2 Gerald F. Späth,3 Dhafer Laouini,1 Eric Prina,3 Kathleen Victoir,4 and Aïda Bouratbine2 1Laboratoire transmission, contrôle et immunobiologie des infections, LR 11-IPT-02, Institut Pasteur de Tunis, 13, place Pasteur, BP 74, 1002Tunis, Tunisie 2Laboratoire de parasitologie-mycologie, LR 11-IPT-06 parasitoses médicales, biotechnologie et biomolécules, Institut Pasteur de Tunis, 13, place Pasteur, BP 74, 1002Tunis, Tunisie 3Unité de parasitologie moléculaire et signalisation, CNRS, URA 2581, Institut Pasteur, 25, rue du Docteur Roux, 75015Paris, France 4Direction internationale, Institut Pasteur, 25, rue du Docteur Roux, 75015Paris, France |

Les leishmanioses font partie des maladies infectieuses négligées qui affectent les populations les plus pauvres de la planète. Elles sont causées par un parasite protozoaire du genre Leishmania, transmis par la piqûre d’un insecte vecteur, le phlébotome [
1]. L’infection est responsable d’un large spectre de manifestations cliniques, allant de la simple forme cutanée localisée aux formes cutanée diffuse, cutanéo-muqueuse et viscérale, de pronostic plus grave [
2]. Quelle que soit la forme clinique, la prise en charge des malades reste compliquée. En effet, les outils de diagnostic demeurent inadaptés au contexte socio-économique de nombreuses zones d’endémies, et le peu de médicaments existants sont en général moyennement efficaces, assez toxiques et coûteux [1]. Il est urgent de concevoir de nouveaux concepts pour la décentralisation de la prise en charge diagnostique, et d’identifier de nouvelles drogues. Par ailleurs, la maladie est immunisante, ce qui indique que la vaccination est possible. De par la localisation géographique de certains Instituts Pasteur dans des zones d’endémie, l’étude des leishmanioses a toujours constitué une thématique de recherche et d’actions de santé publique développée par les équipes pasteuriennes (Figure 1).
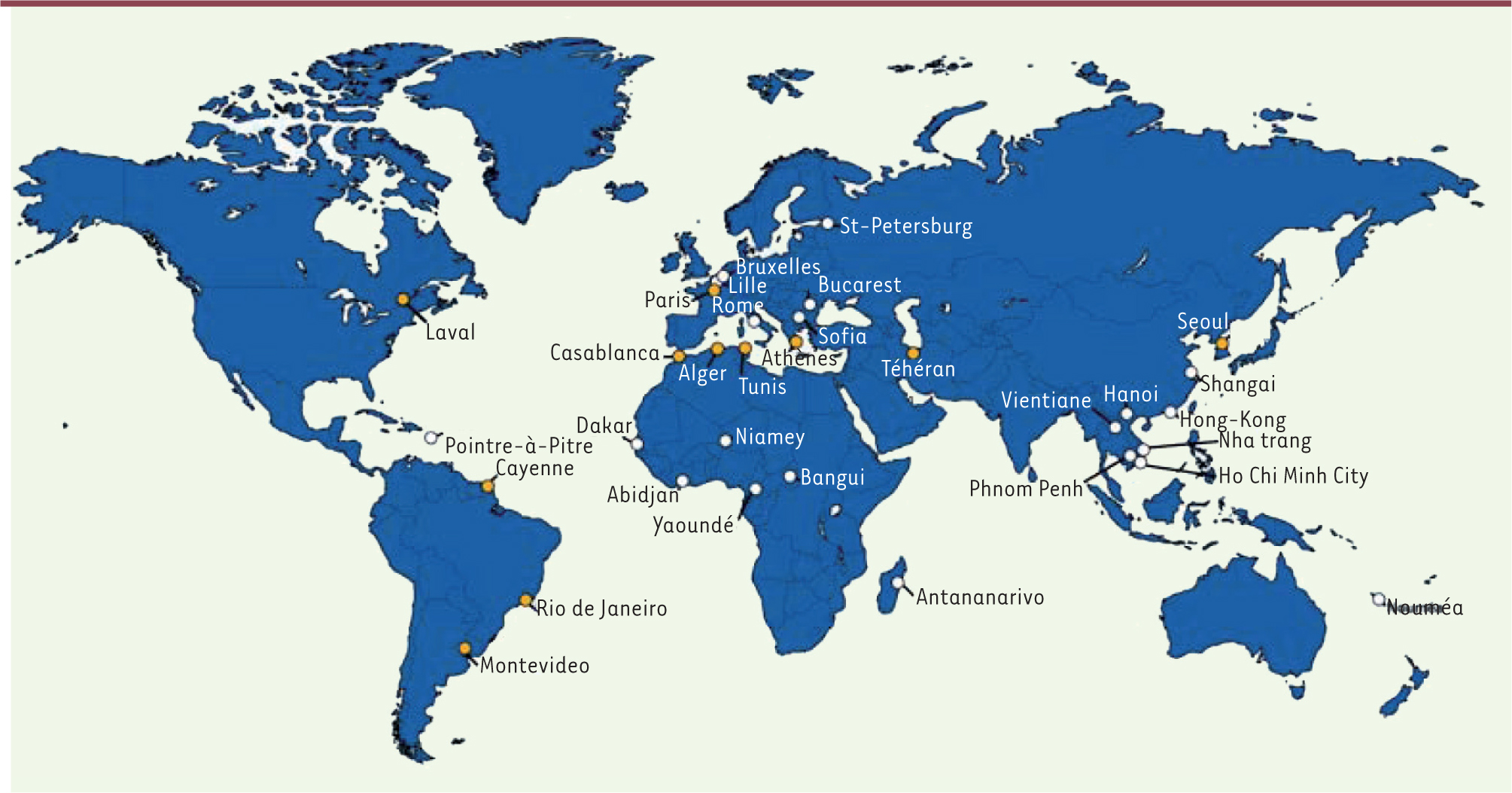
 | Figure 1.
Le réseau international des Instituts Pasteur, avec, indiqués par un cercle jaune, les Instituts ayant des équipes partenaires du réseau d’étude des leishmanioses (LeishRIIp).
|
Dans cette contribution, nous analyserons les grands défis posés par les leishmanioses et développerons plus particulièrement les aspects relatifs au diagnostic, au traitement et à la vaccination, notamment ceux menés au sein du réseau international des Instituts Pasteur (RIIP). |
Les leishmanioses : présentations cliniques et contextes éco-épidémiologiques Près de 20 espèces du genre Leishmania (L.) évoluant dans des systèmes hôte-parasite spécifiques sont pathogènes pour l’homme [1]. Elles provoquent chez l’individu infecté des expressions cliniques diverses groupées en trois formes principales : la leishmaniose viscérale (LV), la leishmaniose cutanée (LC) et la leishmaniose cutanéo-muqueuse (LCM). Il est cependant à noter que la grande majorité des infections resteront asymptomatiques tout en induisant une réponse immune, probablement protectrice, comme en témoigne l’hypersensibilité acquise aux antigènes leishmaniens [
3]. Les manifestations cliniques induites dépendent des espèces impliquées et sont modulées par des facteurs tels que la virulence de la souche parasitaire, l’espèce phlébotomienne vectrice ou encore le profil immunitaire de l’individu infecté [1, 2]. Présentations cliniques Environ 350 millions d’individus sont exposés aux leishmanioses dans plus de 90 pays dans lesquels près de 1,5 à 2 millions de nouveaux cas sont recensés annuellement (1 à 1,5 million de cas de LC et 300 000 à 500 000 cas de LV) (voir
Encadré 1
). L’Inde, le Bangladesh, le Soudan et le Brésil sont les plus touchés par la LV alors que l’Afghanistan, l’Algérie, la Syrie et encore le Brésil comptent le plus de cas de LC [ 1]. |
1. DONNÉES ÉPIDÉMIOLOGIQUES Leishmanioses humaines dans le monde 350 millions d’individus exposés dans près de 90 pays 2 millions de nouveaux cas/an : 1,5 M de LC et 500 000 de LV 70 000 décès/an par LV Peu de possibilités et de nouveautés thérapeutiques Leishmanioses humaines dans la zone RIIP 12 des 25 pays du RIIP touchés Algérie, Brésil, Iran, Maroc et Tunisie les plus concernés Près de 5 000 cas de LV et 100 000 à 120 000 cas de LC par an
|
Leishmaniose viscérale La LV est la forme la plus grave, elle engage le pronostic vital en l’absence de traitement adapté. Elle est causée par deux espèces : L. donovani, anthroponotique fortement endémique en Afrique de l’Est et dans le sous-continent indien [ 2,
4], et L. infantum, zoonotique à réservoir canin, qui prévaut dans les pays du pourtour méditerranéen, le Moyen-Orient et l’Amérique du Sud (syn. L. chagasi). L. donovani touche toutes les tranches d’âges, alors que L. infantum affecte principalement les enfants et les individus immunodéprimés, particulièrement ceux qui sont infectés par le VIH (virus de l’immunodéficience acquise) [ 2, 4]. Les symptômes sont dominés notamment par une fièvre irrégulière et prolongée, une splénomégalie et une anémie, et leur intensité reflète une multiplication importante des parasites dans certains organes hématopoïétiques. Le pronostic est fortement tributaire du terrain sur lequel survient l’infection et de la rapidité de la prise en charge [ 1]. Une particularité de la LV due à L. donovani est la fréquence des atteintes cutanées post-kala-azar (autre nom de la LV). Dans les mois ou les années qui suivent une LV, près de la moitié des patients développent des lésions de type maculo-papules et nodules, souvent hypochromiques, touchant la face et souvent les membres et le tronc. Cette atteinte cutanée, dénommée aussi « leishmaniose dermique post-kala-azar » (LDPKA), est difficile à traiter. Elle pourrait jouer un rôle important dans la transmission du parasite. Leishmaniose cutanée Les LC se présentent comme des lésions inflammatoires, souvent ulcérées et surinfectées, qui guérissent spontanément au bout de quelques mois à quelques années, mais laissent place à des cicatrices indélébiles [
5]. Leur préjudice est à la fois fonctionnel et esthétique. Les LC présentent la distribution géographique la plus large. Dans l’ancien monde, elles sévissent de l’Extrême-Orient jusqu’au Maghreb où les espèces les plus impliquées sont L. tropica et L. major [ 4, 5]. L. tropica, plutôt à l’origine d’une leishmaniose anthroponotique, est responsable d’épidémies dans les grandes agglomérations urbaines du Moyen-Orient et d’Asie Centrale, alors que L. major est responsable d’épidémies de leishmaniose zoonotique en milieu rural [ 5]. Il est cependant actuellement admis que ces deux espèces coexistent dans de nombreux foyers dont ceux du Maghreb, et qu’il existe dans ces foyers un réservoir animal de L. tropica. Ces résultats ont été obtenus grâce à une collaboration entre les Instituts Pasteur de Tunis et d’Alger dans le cadre d’une action inter-pasteurienne financée par le RIIP
6–
8. La LC touche également les Amériques du Centre et du Sud où L. braziliensis est l’espèce la plus fréquente [ 2]. La LCM, rencontrée principalement dans le continent sud-américain [ 4], est presqu’exclusivement causée par L. braziliensis [ 5]. Elle se caractérise par une atteinte muqueuse secondaire survenant un à cinq ans après une LC initiale [ 2]. Facteurs éco-épidémiologiques Durant les dernières décennies, les changements environnementaux rapportés dans certaines régions d’endémies, telles que l’intensification de la mobilisation des ressources hydrauliques et la création de zones irriguées, expliquent l’augmentation de l’incidence des cas et la survenue de nombreuses épidémies. Par ailleurs, l’urbanisation galopante, le plus souvent non structurée, fait que l’homme s’expose davantage en investissant des biotopes sauvages où la transmission des leishmanies est élevée. Les nouveaux quartiers à habitats insalubres (bidonvilles), favorables à la prolifération des chiens et des phlébotomes, offrent des conditions propices aux épidémies de LV à L. infantum [
9] L’impact du changement climatique sur l’épidémiologie des leishmanioses n’est pas encore bien évalué. En 2012, la LV a été déclarée maladie émergente en Europe, et son impact potentiel en santé publique est important ; cette évolution est en grande partie due au réchauffement global récent [
10]. Le risque d’extension vers le nord de L. infantum à partir des pays méditerranéens est en outre étayé par des études récentes sur la répartition des phlébotomes et sur la détection du parasite dans des zones aujourd’hui non endémiques [
11,
12]. Enfin, les guerres et les mouvements de réfugiés ont été à l’origine d’épidémies dévastatrices des différentes formes de leishmanioses comme celles de LV à L. donovani au Soudan, de LC à L. major au Pakistan, et de LC à L. tropica en Afghanistan et tout récemment en Syrie [5]. |
Réduire l’impact des leishmanioses : relever le défi en combinant plusieurs actions Les leishmanioses font partie des maladies tropicales dites « négligées », même si elles comptent parmi les infections les plus fréquentes chez les 2,7 milliards d’individus vivant en dessous du seuil de pauvreté [
13]. La LV compte parmi les maladies tropicales négligées à plus fort taux de mortalité [13]. Elle est également de celles qui provoquent le plus grand nombre d’années perdues par incapacité et décès prématurés, entraînant des milliards de dollars en salaires perdus et gardant les populations à risque d’infection piégées dans un cycle de pauvreté [13]. En 2007, l’adoption par l’assemblée de l’Organisation mondiale de la santé (OMS) d’une résolution pour le contrôle des maladies tropicales négligées marqua un tournant dans la lutte contre ces maladies [13]. La principale stratégie mise alors en œuvre grâce à une forte mobilisation internationale concerna la chimiothérapie préventive, qui permet d’envisager la possibilité de contrôler, voire d’éliminer, la plupart des maladies tropicales négligées. Cette stratégie n’a cependant pas été retenue pour les leishmanioses car non appropriée [13]. Un traitement de masse ne peut, en effet, être envisagé sans preuve diagnostique préalable et sans contrôle médical, en raison de la toxicité de la majorité des molécules médicamenteuses disponibles et de la gravité de certaines formes cliniques. La maîtrise des leishmanioses se fonde toujours sur la combinaison de plusieurs actions adaptées aux différents contextes éco-épidémiologiques et ciblant les différents maillons de la chaîne de transmission. Parmi les mesures de contrôle qui concernent l’homme, la prise en charge diagnostique décentralisée, l’identification de nouvelles molécules médicamenteuses efficaces, plus accessibles et moins toxiques, et la mise au point de vaccins sont au centre des recherches entreprises par les instituts du RIIP. Leishmaniose viscérale : innover pour améliorer le suivi de l’infection La LV sévit en foyers, elle affecte en général les populations pauvres vivant dans les zones rurales reculées. Chez ces populations défavorisées, les symptômes de la maladie persistent souvent pendant des mois, voire des années avant que le patient n’aille consulter ou meurt en raison de complications comme les hémorragies massives, les surinfections ou les anémies sévères [
14]. Le pronostic de cette affection est par ailleurs fortement lié à la rapidité du diagnostic et de la mise en place du traitement, car un traitement tardif, entrepris sur un terrain fragilisé sur lequel se greffent souvent des complications, expose au risque de décès [ 14]. Il est également à signaler que les patients non traités agissent comme un réservoir de parasites dans les zones où la LV est anthroponotique, ce qui contribue en conséquence à l’augmentation du risque de transmission [ 14]. L’amélioration de la prise en charge des cas de LV et la lutte contre cette parasitose passent par le raccourcissement du délai du diagnostic. Cependant, la clinique est peu contributive pour porter ce diagnostic à un stade précoce. Le défi est de pouvoir poser un diagnostic biologique fiable et rapide chez des patients ayant peu ou pas d’accès à des centres de soins bien équipés. Les tests biologiques doivent être sensibles, spécifiques, rapides et simples d’utilisation. C’est, en effet, l’utilisation d’un modèle de soin « tester et traiter de façon efficace et rapide » qui permettrait de réduire la probabilité de perdre de vue les patients. Enfin, afin de faciliter le suivi et d’optimiser une prise en charge décentralisée, il est également important de promouvoir des tests permettant de suivre l’évolution post-thérapeutique compte tenu de l’émergence de nombreuses résistances aux antimoniés pentavalents qui restent à ce jour les médicaments les plus utilisés. Différents tests diagnostiques praticables sur le terrain ont été évalués dans les zones d’endémie de LV en Afrique de l’Est, dans le sous-continent indien et également dans certains instituts du RIIP. Il s’agit surtout de tests permettant de mettre en évidence des anticorps spécifiques tels que les tests d’agglutination directe [14,
15]. Ces derniers, bien que sensibles, sont sujets à des problèmes de conservation et mettent en évidence des marqueurs de l’infection leishmanienne plutôt que des biomarqueurs de la maladie évolutive. Les bandelettes réactives utilisant l’antigène recombinant rK39 se sont également avérées intéressantes bien que leurs performances soient variables en fonction des régions [14,
16,
17]. Elles ne peuvent cependant pas être utilisées dans le suivi post-thérapeutique à cause de la persistance des anticorps. La détection des antigènes permet de pallier cet inconvénient ; un exemple de test non invasif (commercialisé sous le nom Katex) est la détection d’antigènes leishmaniens dans les urines [
18]. En effet, la négativation des antigènes parasitaires en cas d’évolution favorable démontre toute l’importance des biomarqueurs d’évolutivité de la maladie [14]. La mise au point de tests biologiques pratiqués sur des prélèvements moins invasifs que les prélèvements sanguins est particulièrement intéressante. Le « fluide oral » ou « salive entière » est une source actuellement très explorée dans le cadre du diagnostic des maladies infectieuses. Il est simple à collecter tout particulièrement chez les enfants. Il est également facile à conserver à température ambiante, présente peu de risque infectieux lors de la manipulation et permet de rechercher aussi bien les anticorps spécifiques, les antigènes solubles que l’ADN des agents parasitaires
19–
22. Son utilisation avec succès dans la mise en évidence d’anticorps spécifiques anti-rK39 et d’ADN leishmanien chez les enfants atteints de LV nous permet d’envisager l’utilisation de la salive pour un diagnostic sur le terrain [
21]. La caractérisation précise des antigènes leishmaniens et leur nature glycoprotéique pourront ouvrir des perspectives dans la conception de nouveaux outils pour le diagnostic et le suivi des cas de LV [19,
20]. Difficultés thérapeutiques et nouveaux espoirs En l’absence de vaccins sûrs et efficaces, la chimiothérapie reste, avec la lutte antivectorielle, les mesures principales pour le contrôle des leishmanioses. Toutefois, l’arsenal de médicaments disponibles est limité, et tous les traitements actuels présentent des inconvénients importants, dont leur voie d’administration (parentérale), leur toxicité et leur coût, qui limitent leur utilisation dans les zones d’endémie. Agents thérapeutiques actuels L’injection de dérivés pentavalents de l’antimoine reste le traitement prescrit en première intention pour les LV et ceci dans la plupart des régions du monde. Cela nécessite cependant un traitement long (20 à 30 jours en fonction de la zone géographique) dont la toxicité est importante (3 à 5 % de mortalité). En outre, la résistance de L. donovani à ces dérivés de l’antimoine est confirmée au Népal et dans l’État du Bihar, en Inde : elle pourrait se développer aussi dans d’autres régions du sous-continent indien ainsi qu’en Afrique. L’amphotéricine B est actuellement utilisée comme médicament de seconde intention en Inde, mais son administration doit se faire sous surveillance médicale et elle est connue pour sa néphrotoxicité. L’AmBisome™, une formulation liposomale de l’amphotéricine B, possède une activité remarquable, même en une seule injection en Inde, mais son coût est très élevé (20 $ par flacon de 50 mg), et son administration se fait par perfusion intraveineuse lente. Deux autres agents thérapeutiques, la miltéfosine et la paromomycine, ont été récemment développés ou reformulés, et les résultats obtenus ont suscité de nouveaux espoirs pour le traitement de la LV. La miltéfosine a été introduite en Inde en 2002 et les essais de phase IV viennent de se terminer. Elle a été enregistrée pour le traitement de la leishmaniose cutanée (LC) en Colombie et est à l’essai pour d’autres formes de LC. Une formulation parentérale à faible coût de la paromomycine a terminé les phases III et IV des essais cliniques et a été enregistrée pour le traitement de la LV en Inde en 2006 [
23]. Elle est actuellement en phase III des essais cliniques réalisés en Afrique de l’Est. Cependant, des études de laboratoire ont montré que ces deux molécules pouvaient sélectionner rapidement des parasites résistants
24–
27, ce qui représente un risque lors de traitements, même de courtes durées. Pour la miltéfosine, sa disponibilité sur le marché des médicaments de comptoir et son utilisation incontrôlée peuvent grandement augmenter ce risque de développement de résistances. L’utilisation intensive de la miltéfosine est limitée par sa tératogénicité et la nécessité pour les femmes en âge de procréer de prendre des contraceptifs pendant au moins deux mois après la fin du traitement [
28]. Actuellement, un seul autre candidat médicament anti-leishmanien est en essai clinique pour le traitement de la LV, la sitamaquine, une 8-aminoquinoléine pour laquelle des essais de phase IIb ont été réalisés en Inde en 2007. En conclusion, à ce jour, aucun médicament idéal n’est disponible, qui remplisse les conditions nécessaires pour une thérapie anti-leishmanienne efficace, c’est-à-dire une grande efficacité, une faible toxicité, une administration aisée, et un faible coût, sans induction cependant de résistance médicamenteuse chez les parasites. RIIP et développement de nouvelles stratégies Il y a donc un besoin urgent de développer de nouvelles stratégies pour mettre en place un solide portefeuille de nouveaux composés anti- Leishmania qui utilisent des concepts novateurs basés sur l’identification et l’optimisation de composés phares. De telles approches devraient conduire à surmonter la situation actuelle et permettre de lutter plus efficacement contre cette maladie mortelle, voire finalement de l’éradiquer. Ces dernières années, l’Institut Pasteur et les différents instituts du réseau international sont apparus comme une structure de premier plan pour promouvoir le développement de médicaments contre les différentes formes de leishmaniose. Dans un récent rapport du G-Finder 1,, l’Institut Pasteur et ses partenaires du réseau figuraient parmi les 12 plus importants sponsors de la R&D sur les trypanosomatidés, et ceci en partie grâce à la coordination d’un consortium international appelé LEISHDRUG 2 avec la contribution de la communauté européenne (7 e programme cadre). Ce programme était consacré notamment à l’exploration de voies de signalisation spécifiques des Leishmania dans le but d’identifier et de valider les protéines kinases de ce parasite comme nouvelles cibles thérapeutiques. Ce projet comprenait quatre institutions partenaires (IP Paris, IP Montevideo, IP Tunis, IP Corée). Il a permis d’importantes découvertes sur les évènements de signalisation spécifiques de Leishmania impliqués dans le développement et la virulence du parasite (G. Späth, information non publiée)
29–
32, la structure et la biologie des protéines kinases parasitaires
33–
35, ainsi que l’identification de nouveaux composés anti- Leishmania à travers le développement de méthodes de criblage adaptables au haut débit et basées sur des tests spécifiques de cible et des essais phénotypiques [
36]. Divers efforts indépendants réalisés à l’IP Paris et à l’IP Tunis ont concerné de nouvelles formulations de médicaments, y compris des thérapies topiques
37–
39, ou sont engagés dans le développement de composés actifs en médicaments potentiels via le consortium TransLeish 3 parrainé par l’Agence nationale de recherche (ANR). Ces efforts concernant le développement de molécules ayant une activité anti- Leishmania sont aussi activement poursuivis à l’IP Tunis sur la molécule eIF4A [
40,
41], à l’Institut Pasteur hellénique sur la protéine kinase GSK-3 [
42] et à l’IP Corée [
43,
44]. La vaccination est-elle faisable ? Quels sont les pré-requis pour le développement de vaccins ? Le fait que la majorité des individus ayant développé la maladie, ou parfois une simple infection asymptomatique, résistent secondairement à la réinfection est un argument en faveur de la faisabilité d’un vaccin. Cependant, malgré les grandes avancées dans la compréhension de la biologie du parasite et de la réponse de l’hôte, il existe encore un « gap » dans les connaissances. Contrairement à la situation de la quasi-totalité des vaccins humains utilisés actuellement, où le mécanisme effecteur nécessite une réponse anticorps, la définition des corrélats de protection est plus difficile quand une réponse cellulaire est souhaitée, comme cela est le cas au cours des leishmanioses. De plus, dans cette situation, la valeur prédictive des modèles expérimentaux quant à la situation humaine est faible. Une autre difficulté réside dans le choix des antigènes cibles. Sur quelle base va-t-on sélectionner les candidats vaccins parmi plus de 8 000 séquences codantes de Leishmania ? Réponse immune à une infection par Leishmania En termes d’immunité et de protection, une littérature abondante, à laquelle ont contribué plusieurs instituts du RIIP, notamment l’IP Téhéran, l’IP Guyane, l’Institut Armand-Frappier et l’IP Tunis, a concerné l’étude de la leishmaniose expérimentale de la souris. Ce modèle est à la base de la démonstration de la dichotomie des sous-populations cellulaires T CD4 + fonctionnellement distinctes (Th1 et Th2) et des cytokines qu’elles produisent [
45,
46]. En réponse à l’inoculation expérimentale de L. major, les souris C57BL/6 développent une réponse de type Th1 qui permet le contrôle de la croissance parasitaire, et résistent à l’infection, notamment grâce à la production de facteurs d’activation des macrophages tels que l’interféron (IFN)-γ et le facteur de nécrose des tumeurs (TNF). Au contraire, les souris BALB/c développent une réponse de type Th2, avec la production des IL-4, IL-5, IL-6, et IL-10, qui corrèle avec le développement d’une maladie progressive [
47]. Les évènements décisifs d’orientation de cette réponse ont lieu dans les sites d’inoculation parasitaire et dans les organes lymphoïdes, et ce dans les 1 res heures de l’infection. Le rôle du microenvironnement cytokinique et des cellules dendritiques y est fondamental. Les cellules cytotoxiques T CD8 + contribuent également à la protection et la résistance contre Leishmania [
48]. Chez l’homme, la définition des mécanismes immunopathologiques et immunoprotecteurs intervenant au cours des leishmanioses est rendue difficile par la nécessité de faire des études longitudinales et par l’hétérogénéité génétique des populations humaines et parasitaires. Cependant, les données obtenues chez l’homme semblent confirmer la dichotomie de la réponse cellulaire T CD4+ (Th1/Th2) observée chez la souris. En effet, chez les patients ayant développé une forme cutanée localisée, la réponse immune cellulaire est caractérisée par la prolifération des lymphocytes sanguins et la production d’IFN-γ et d’IL-2 en réponse aux antigènes parasitaires. C’est aussi le cas des individus vivant dans les foyers de LC ayant été en contact avec le parasite. L’intensité de cette réponse cellulaire corrèle avec l’intensité de leur réaction d’hypersensibilité retardée (HSR) à la leishmanine [
49]. À l’inverse, chez les patients atteints de LV existent une anergie cellulaire vis-à-vis des antigènes du parasite ainsi qu’une négativité des tests d’HSR à la leishmanine. Cependant, l’analyse de l’expression de certains gènes codant pour des cytokines au niveau des sites de multiplication parasitaire (moelle osseuse, rate) montre un niveau élevé d’ARN messagers codant pour l’INF-γ mais aussi l’IL-10. L’expression de l’IL-10 régresse après un traitement efficace, ce qui suggère un conflit entre une réponse cellulaire de type Th1 et une accumulation de cytokines suppressives dont l’origine cellulaire peut être multiple (Th2, macrophage, autres). Il semble qu’au cours de la LV, il y ait une séquestration lymphocytaire tissulaire (sites de multiplication parasitaire) contrastant avec une anergie périphérique. La LV est aussi caractérisée par une hypergamma globulinémie comprenant notamment des anticorps anti-leishmania inefficaces pour neutraliser le parasite, mais utiles pour le diagnostic. La leishmaniose cutanéo-muqueuse est aussi caractérisée par une anergie cellulaire et une négativité des tests cutanés à la leishmanine. Durant la forme muqueuse, une réponse mixte des lymphocytes circulants de type Th1 et Th2 est souvent détectée ainsi que dans les sites cutanés [
50]. La réponse cellulaire cytotoxique (cellules T CD8+) a été peu étudiée [48](Figure 2).
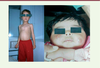 | Figure 2.
Fillette de 5 ans atteinte de leishmaniose viscérale infantile; nourrisson présentant des lésions de leishmaniose cutanée zoonotique.
|
Perspectives de vaccination En termes de vaccination, grâce aux contributions des IP d’Iran, de Tunis, de Grèce, mais aussi et surtout de la FIOCRUZ 4, plusieurs dizaines de candidats vaccins (antigènes élués de la surface des macrophages infectés, protéines impliquées dans la virulence du parasite, antigènes potentiellement sécrétés/excrétés, etc.) et de stratégies vaccinales (protéines parasitaires, parasites vivants atténués, vaccins ADN avec ou sans adjuvants) qui protègent efficacement la souris, sont maintenant disponibles [
51–
53
Chez l’homme, les essais de parasites tués n’ont pas abouti, alors que ceux utilisant les nouvelles générations de vaccins sont encore très limités, à l’exception de celui dénommé L111f ou LEISH-F1 qui combine trois antigènes différents – la TSA (thiol-spécifique antioxydant), la LmSTI1 (stress-inducible protein-1) et le LeIF (elongation and initiation factor) – et un adjuvant, le lipide monophosphoryle A désacylé (MPL) en émulsion (MPL-SE). Ce vaccin a été testé dans des essais cliniques dans différentes régions endémiques dont le Brésil et l’Inde [
54]. Cependant, les parasites tués, tout comme les vaccins sous-unitaires, sont capables d’induire une réponse T CD4+ et des anticorps, mais pas de réponse T CD8+ restreinte par les molécules du complexe majeur d’histocompatibilité (CMH) de classe I, alors que des données récentes suggèrent un rôle important de la réponse cytotoxique anti-leishmanienne dans l’immunité et la protection [48]. Pour concevoir de tels vaccins, il faut que l’antigène s’exprime dans les cellules de la personne vaccinée. Deux modèles récents de vaccins peuvent répondre à cette exigence : les virus recombinants et les vaccins ADN. Un vaccin à base d’adénovirus recombinant codant pour deux antigènes de leishmanies, KMP-11 et HASPB, est en cours de développement par une équipe anglaise [
55]. Un autre projet, mis en place dans le 7e programme cadre européen, auquel contribue l’équipe de l’IP Tunis, consiste à développer un vaccin à base d’ADN codant pour cinq antigènes de Leishmania
5. Cette formulation vaccinale vient de passer les phases précliniques et est actuellement à l’étude pour un développement clinique. Par ailleurs, lors des piqûres infectantes, la salive du vecteur contribue à l’établissement de l’infection et à la pathogénie de la leishmaniose [
56]. L’effet aggravant de la salive du phlébotome sur le développement de la maladie est confirmé par l’effet immunosuppresseur de certains composants sur les fonctions des macrophages tissulaires et des lymphocytes Th1, notamment en inhibant la production d’IFN-γ [
57]. Il est intéressant de signaler que la salive du vecteur, composée d’une trentaine de protéines, est aussi immunogène et confère aux souris pré-exposées aux piqûres de phlébotomes non infectés une protection immunologique vis-à-vis d’expositions secondaires au parasite en présence de salive. Cette protection est attribuée au développement d’une réponse cellulaire de type Th1, qui crée un microenvironnement cellulaire et cytokinique hostile à l’installation et au développement du parasite. Utilisant une approche transcriptomique, l’équipe de l’IP Tunis s’intéresse à la composition de la salive du vecteur (Phlebotomus papatasi) en vue de l’identification de biomarqueurs d’exposition (par la détection d’anticorps dirigés contre la protéine SP32) ou d’autres protéines cibles de réponses cellulaires pouvant constituer de bons candidats vaccins
58–
60. En conclusion, nous pensons qu’un vaccin contre les leishmanioses pourrait être composé de plusieurs protéines parasitaires qui généreraient différents peptides pouvant s’associer aux molécules du CMH de classe II et I. Cela permettrait non seulement d’induire une réponse cellulaire (T CD4 et T CD8), mais surtout d’être la cible de cette dernière par leur expression à la surface des macrophages infectés. L’association d’au moins une protéine de la salive du vecteur capable d’induire une réponse T avec production d’IFN-γ permettrait, lors de la transmission naturelle du parasite, de créer rapidement un environnement cellulaire (Th1) et cytokinique (IFN-γ) favorable au contrôle de la multiplication parasitaire. La nature de l’adjuvant est fondamentale afin d’orienter la réponse vaccinale vers le développement des effecteurs souhaités. |
LeishRiip : une suite logique des actions pasteuriennes en réponse aux défis posés par les leishmanioses Historiquement, les IP ont été les lieux privilégiés de plusieurs découvertes sur les leishmanioses. La description de la LV infantile a été bien documentée dans les archives de l’Institut Pasteur de Tunis dès 1908 (voir
Encadré 2
). Les travaux de Charles Nicolle permirent dès cette date de rattacher l’étiologie leishmanienne aux cas d’« anémie splénique infantile », entité clinique décrite sur les rives sud et nord du bassin méditerranéen et dont l’étiologie était inconnue, de distinguer cette nouvelle forme de LV du kala-azar indien décrit principalement chez l’adulte, et de nommer L. infantum l’espèce parasitaire causale [
61]. Toujours en 1908, à l’IP de Tunis, Nicolle optimisa l’utilisation du milieu de culture de Novy et Neal (actuel milieu NNN) et identifia le chien comme réservoir de L. infantum [
62]. Quelques années plus tard, à l’IP voisin d’Alger, les frères Edmond et Etienne Sergent et leurs collaborateurs ont été les premiers, dès 1921, à apporter les preuves du rôle vecteur des phlébotomes en incriminant Phlebotomus papatasi dans la transmission de l’agent du « Clou de Biskra ». Les contributions brésiliennes sont aussi nombreuses. Ainsi, la 1re atteinte muqueuse a été rapportée par Carini en 1912 alors que Viannia a été l’instigateur de l’utilisation des dérivés de l’antimoine, encore largement utilisés de nos jours, pour le traitement de la LC et la LCM (1912).
2. PRINCIPALES DATES ASSOCIEES AUX LEISHMANIOSES [
63–
65] Antiquité Tablettes d’argile du palais de Ninive, transcrites probablement d’un écrit akkadien du 3e millénaire avant J.-C., invoquent une ulcération de la face. Statuette de l’époque précolombienne, découverte au Pérou, illustrant une lésion caractéristique mutilante du nez. Période médiévale Plusieurs médecins arabo-musulmans, dont Abu Mansour Al Bukhari, décrivent en détail l’affection cutanée appelée Balkh douloureux du nom d’une localité du nord de l’Afghanistan. Xe siècle : Avicenne attribue ces lésions cutanées à la piqûre d’un insecte. XVe et XVIe siècles : des textes mentionnent le risque encouru par les ouvriers agricoles de retour des Andes à contracter une maladie cutanée dite andine ou de la vallée. Des médecins indiens utilisent le terme sanskrit kala azar (fièvre noire) pour décrire la leishmaniose viscérale. Époque moderne 1756 : Alexander Russel fait la 1re description de leishmaniose cutanée chez un patient turc. Il l’appelle bouton d’Alep. 1885 : David Cunningham met en évidence le parasite dans une lésion d’ulcère de Delhi. 1891 : observation confirmée par Firth qui nomme le parasite Sporozoa furunculosa. 1989 : Peter Borovsky, en Russie, incrimine le parasite protozoaire comme agent de la leishmaniose cutanée et décrit le kinétoplaste. 1900 : William Leishman et Charles Donovan, en Inde, découvrent indépendamment le parasite (appelé plus tard Leishmania donovani) dans des frottis de rate de malades atteints de kala-azar et l’incriminent comme agent étiologique de la maladie. 1903 : James Homer Wright met de nouveau en évidence l’agent causal de la leishmaniose cutanée de l’ancien Monde (L. tropica) et le nomma Helcosoma tropicum. 1904 : Rogers cultive l’agent causal de la leishmaniose viscérale. A. Laveran et M. Catoire, en Tunisie, rapportent la 1re observation de leishmaniose viscérale dans le Bassin Méditerranéen. 1908 : Charles Nicolle et collaborateurs mettent en évidence à Tunis l’agent causal de la leishmaniose viscérale infantile, le nomment L. infantum, et le mettent, ainsi que le parasite L. tropica, en culture sur milieu Mc Neal, Novy et Nicolle (NNN). Ils démontrent également que le chien en est le réservoir. 1909 : A. Lindenberg ainsi que A. Carini et U. Paranhos mettent indépendamment en évidence au Brésil l’agent causal de l’épidémie de l’ulcère de Bauru sévissant à São Paolo. 1911 : Gaspar Vianna nomme l’agent étiologique de l’ulcère de Bauru L. brazilienses (changé en 1916 en braziliensis). Pedroso et Dias da Silva mettent en culture le parasite sur milieu NNN. 1912 : Gaspar Vianna utilise en 1912 le tartrate de potassium et d’antimoine pour traiter l’infection à L. braziliensis. 1923 : Montenegro inocule L. braziliensis à l’homme. 1926 : le test de Montenegro pour le diagnostic de la leishmaniose est introduit. 1921 : les frères Sergent et leurs collaborateurs, à Alger, mettent expérimentalement en évidence sur leurs propres personnes la transmission du parasite L. major par le vecteur Phlebotomus papatasi. 1961 : Pessoa propose le nom des différentes sous espèces de Leishmania du nouveau Monde. 1974 : P.J. Gardener, M.L. Chance et W. Peters mettent au point le typage iso-enzymatique des parasites. 1984 : David Sacks met en évidence le stade métacyclique infectieux du parasite et démontre avec Malcolm Mc Conville, six ans plus tard, que la structure du lipophosphoglycane à la surface du protozoaire est responsable de sa différenciation en sa forme métacyclique. 1987 : description du paradigme Th1/Th2 au cours de la leishmaniose murine. 2005 : publication du génome de L. major, suivie, deux ans plus tard, de celle de L. infantum et de L. braziliensis.
|
À partir des années 1970, le regroupement des IP en réseau formel et fonctionnel, le réseau international des Instituts Pasteur et Instituts associés a largement favorisé le développement de nombreuses collaborations entre les différents Instituts Pasteur et leurs partenaires dans les différents domaines des leishmanioses. Cette dynamique de recherche collaborative s’est depuis renforcée avec la mise en place des appels à projets dans le cadre des actions concertées inter-pasteuriennes (ACIP) durant les années 1990 et, plus récemment, les programmes transversaux de recherche (PTR). D’autres opportunités de financements (Commission Européenne, OMS, autres) ont donné des possibilités supplémentaires aux équipes du RIIP de monter des projets de R&D autour des leishmanioses, notamment des essais thérapeutiques. La création récente du réseau LeishRIIP6 a pour objectif de coordonner les efforts de recherche des IP du réseau dans le domaine spécifique des leishmanioses par l’échange des informations et des expertises, l’identification des synergies et des complémentarités et le montage de projets spécifiques fédérateurs et structurants. Elle permettra sans nul doute de dynamiser encore plus la recherche à travers le RIIP par la promotion de grands programmes transversaux tout en préservant l’excellence scientifique, l’esprit et les valeurs pasteuriens. Actuellement, le LeishRIIP comprend 11 instituts et 18 laboratoires. Il est aussi ouvert à de nombreux partenaires scientifiques et institutionnels. Les actions du réseau couvrent essentiellement trois domaines jugés stratégiques : (1) le développement de nouveaux médicaments en utilisant des approches novatrices ciblant des molécules importantes de la biologie du parasite ; (2) la compréhension des mécanismes de résistance de l’hôte et l’identification des effecteurs immunologiques impliqués, ceci dans l’optique de développer des vaccins plus efficaces ; et (3) le développement d’outils innovants pour le diagnostic précoce et le suivi des cas de LV sous traitement, en favorisant particulièrement les outils non invasifs utilisant notamment l’urine et/ou la salive (Figure 3).
 | Figure 3.
Description, par Charles Nicolle, des « corps de Leishman » et les formes de culture en milieu Novy-Neal. D’après les archives de l’Institut Pasteur de Tunis, février 1908. |
|
En conclusion, implanté dans tous les continents et intégré aux structures de santé et de recherche locales, le réseau des Instituts Pasteur constitue une opportunité unique pour une approche multidisciplinaire des grands enjeux de santé à travers le monde. La plateforme LeishRIIP, dédiée aux leishmanioses, constitue au sein de ce réseau un atout de taille pour promouvoir les recherches fondamentales et leurs applications en réponse aux besoins identifiés sur le terrain (diagnostiques, nouvelles drogues, vaccins). Une telle mobilisation se justifie pour lutter contre les leishmanioses qui menacent la santé humaine, notamment par leur fréquence, par la gravité de certaines formes cliniques et parce qu’elles touchent des populations particulièrement vulnérables. Ce réseau sera soutenu par des plates-formes fonctionnelles et des partenaires externes pour compléter son panel d’expertises et ainsi avoir un impact plus important pour comprendre et mieux lutter contre ce fléau que constituent les leishmanioses. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
WHO . Control of the leishmaniases . World Health Organ Tech Rep Ser.
2010; : XII–XIII : :1.–186. 2.
Pearson
RD
,
Sousa
AQ
. Clinical spectrum of Leishmaniasis . Clin Infect Dis.
1996; ; 22 : :1.–13. 3.
Louzir
H
,
Dellagi
K
. Les leishmanioses : un modèle d’étude des interactions hôte-parasite ; implications pour la maladie humaine . Ann Inst Pasteur Actualités.
1999; ; 10 : :67.–80. 4.
Alvar
J
,
Velez
ID
,
Bern
C
, et al.
Leishmaniasis worldwide, global estimates of its incidence . PLoS One.
2012; ; 7 : :e35671.. 5.
Reithinger
R
,
Dujardin
JC
,
Louzir
H
, et al.
Cutaneous leishmaniasis . Lancet Infect Dis.
2007; ; 7 : :581.–596. 6.
Boubidi
SC
,
Benallal
K
,
Boudrissa
A
, et al.
Phlebotomus sergenti (Parrot, 1917) identified as Leishmania killicki host in Ghardaia, south Algeria . Microbes Infect.
2011; ; 13 : :691.–696. 7.
Bousslimi
N
,
Ben-Ayed
S
,
Ben-Abda
I
, et al.
Natural infection of North African gundi (Ctenodactylus gundi) by Leishmania tropica in the focus of cutaneous leishmaniasis, Southeast Tunisia . Am J Trop Med Hyg.
2012; ; 86 : :962.–965. 8.
Tabbabi
A
,
Bousslimi
N
,
Rhim
A
, et al.
First report on natural infection of Phlebotomus sergenti with Leishmania promastigotes in the cutaneous leishmaniasis focus in southeastern Tunisia . Am J Trop Med Hyg.
2011; ; 85 : :646.–647. 9.
Gonzalez
R
,
De Sousa
L
,
Devera
R
, et al.
Seasonal and nocturnal domiciliary human landing/biting behaviour of Lutzomyia (Lutzomyia) evansi and Lutzomyia (Psychodopygus) panamensis (Diptera ; Psychodidae) in a periurban area of a city on the Caribbean coast of eastern Venezuela (Barcelona ; Anzoategui State) . Trans R Soc Trop Med Hyg.
1999; ; 93 : :361.–364. 10.
Lindgren
E
,
Andersson
Y
,
Suk
JE
, et al.
Public health. Monitoring EU emerging infectious disease risk due to climate change . Science.
2012; ; 336 : :418.–419. 11.
Menn
B
,
Lorentz
S
,
Naucke
TJ.
, Imported travelling dogs as carriers of canine vector-borne pathogens in Germany . Parasit Vectors.
2010; ; 3 : :34.. 12.
Naucke
TJ
,
Menn
B
,
Massberg
D
,
Lorentz
S.
, Sandflies leishmaniasis in Germany . Parasitol Res.
2008; ; 103 : (suppl 1)
:S65.–S68. 13.
Hotez
PJ
,
Molyneux
DH
,
Fenwick
A
, et al.
Control of neglected tropical diseases . N Engl J Med.
2007; ; 357 : :1018.–1027. 14.
Chappuis
F
,
Sundar
S
,
Hailu
A
, et al.
Visceral leishmaniasis : what are the needs for diagnosis, treatment and control?
Nat Rev Microbiol.
2007; ; 5 : :873.–882. 15.
Oliveira
E
,
Saliba
SW
,
Saliba
JW
,
Rabello
A
. Validation of a direct agglutination test prototype kit for the diagnosis of visceral leishmaniasis . Trans R Soc Trop Med Hyg.
2013; ; 107 : :243.–247. 16.
Cunningham
J
,
Hasker
E
,
Das
P
, et al.
A global comparative evaluation of commercial immunochromatographic rapid diagnostic tests for visceral leishmaniasis . Clin Infect Dis.
2012; ; 55 : :1312.–1319. 17.
Saghrouni
F
,
Gaied-Meksi
S
,
Fathallah
A
, et al.
Immunochromatographic rK39 strip test in the serodiagnosis of visceral leishmaniasis in Tunisia . Trans R Soc Trop Med Hyg.
2009; ; 103 : :1273.–1278. 18.
Attar
ZJ
,
Chance
ML
,
el-Safi
S
, et al.
Latex agglutination test for the detection of urinary antigens in visceral leishmaniasis . Acta Trop.
2001; ; 78 : :11.–16. 19.
Abeijon
C
,
Kashino
SS
,
Silva
FO
, et al.
Identification and diagnostic utility of Leishmania infantum proteins found in urine samples from patients with visceral leishmaniasis . Clin Vaccine Immunol.
2012; ; 19 : :935.–943. 20.
Sarkari
B
,
Chance
M
,
Hommel
M
. Antigenuria in visceral leishmaniasis : detection and partial characterisation of a carbohydrate antigen . Acta Trop.
2002; ; 82 : :339.–348. 21.
Galai
Y
,
Chabchoub
N
,
Ben-Abid
M
, et al.
Diagnosis of mediterranean visceral leishmaniasis by detection of Leishmania antibodies and Leishmania DNA in oral fluid samples collected using an Oracol device . J Clin Microbiol.
2011; ; 49 : :3150.–3153. 22.
Huang
H
,
Mackeen
MM
,
Cook
M
, et al.
Proteomic identification of host, parasite biomarkers in saliva from patients with uncomplicated Plasmodium falciparum malaria . Malar J.
2012; ; 11 : :178.. 23.
Sinha
PK
,
Jha
TK
,
Thakur
CP
, et al.
Phase 4 pharmacovigilance trial of paromomycin injection for the treatment of visceral leishmaniasis in India . J Trop Med.
2011; ; 2011 : :645203.. 24.
Hendrickx
S
,
Inocencio da Luz
RA
,
Bhandari
V
, et al.
Experimental induction of paromomycin resistance in antimony-resistant strains of L. donovani : outcome dependent on in vitro selection protocol . PLoS Negl Trop Dis.
2012; ; 6 : :e1664.. 25.
Jhingran
A
,
Chawla
B
,
Saxena
S
, et al.
Paromomycin : uptake and resistance in Leishmania donovani
. Mol Biochem Parasitol.
2009; ; 164 : :111.–117. 26.
Perez-Victoria
FJ
,
Castanys
S
,
Gamarro
F
.
Leishmania donovani resistance to miltefosine involves a defective inward translocation of the drug . Antimicrob Agents Chemother.
2003; ; 47 : :2397.–2403. 27.
Perez-Victoria
FJ
,
Sanchez-Canete
MP
,
Seifert
K
, et al.
Mechanisms of experimental resistance of Leishmania to miltefosine : Implications for clinical use . Drug Resist Updat.
2006; ; 9 : :26.–39. 28.
Berman
J
. Visceral leishmaniasis in the New World and Africa . Indian J Med Res.
2006; ; 123 : :289.–294. 29.
Hem
S
,
Gherardini
PF
,
Osorio y Fortea
J
, et al.
Identification of Leishmania-specific protein phosphorylation sites by LC-ESI-MS/MS and comparative genomics analyses . Proteomics.
2010; ; 10 : :3868.–3883. 30.
Morales
MA
,
Watanabe
R
,
Laurent
C
, et al.
Phosphoproteomic analysis of Leishmania donovani pro- and amastigote stages . Proteomics.
2008; ; 8 : :350.–363. 31.
Palmeri
A
,
Gherardini
PF
,
Tsigankov
P
, et al.
PhosTryp : a phosphorylation site predictor specific for parasitic protozoa of the family trypanosomatidae . BMC Genomics.
2011; ; 12 : :614.. 32.
Tsigankov
P
,
Gherardini
PF
,
Helmer-Citterich
M
,
Zilberstein
D
. What has proteomics taught us about Leishmania development?
.
Parasitology.
2012; ; 139 : :1146.–1157. 33.
Foucher
AL
,
Rachidi
N
,
Gharbi
S
, et al.
Apoptotic marker expression in the absence of cell death in staurosporine-treated Leishmania donovani
. Antimicrob Agents Chemother.
2013; ; 57 : :1252.–1261. 34.
Horjales
S
,
Schmidt-Arras
D
,
Limardo
RR
, et al.
The crystal structure of the MAP kinase LmaMPK10 from Leishmania major reveals parasite-specific features and regulatory mechanisms . Structure.
2012; ; 20 : :1649.–1660. 35.
Morales
MA
,
Pescher
P
,
Spath
GF
.
Leishmania major MPK7 protein kinase activity inhibits intracellular growth of the pathogenic amastigote stage . Eukaryot Cell.
2010; ; 9 : :22.–30. 36.
Aulner
N
,
Danckaert
A
,
Rouault-Hardoin
E
, et al.
High content analysis of primary macrophages hosting proliferating Leishmania amastigotes : application to anti-leishmanial drug discovery.
Plos Negl Trop Dis.
2013; ; 7 : :e2154.. 37.
Ben Salah
A
,
Ben Messaoud
N
,
Guedri
E
, et al.
Topical paromomycin with or without gentamicin for cutaneous leishmaniasis . N Engl J Med.
2013; ; 368 : :524.–532. 38.
Lecoeur
H
,
Buffet
P
,
Morizot
G
, et al.
Optimization of topical therapy for Leishmania major localized cutaneous leishmaniasis using a reliable C57BL/6 Model . PLoS Negl Trop Dis.
2007; ; 1 : :e34.. 39.
Lecoeur
H
,
Buffet
PA
,
Milon
G
,
Lang
T
. Early curative applications of the aminoglycoside WR279396 on an experimental Leishmania major-loaded cutaneous site do not impair the acquisition of immunity . Antimicrob Agents Chemother.
2010; ; 54 : :984.–990. 40.
Barhoumi
M
,
Meddeb-Garnaoui
A
,
Kyle Tanner
N
, et al.
DEAD-box proteins, like Leishmania eIF4A, modulate interleukin (IL)-12, IL-10 and tumor necrosis factor-alpha production by human monocytes . Parasite Immunol.
2013; ; 35 : :199.–199. 41.
Barhoumi
M
,
Tanner
NK
,
Banroques
J
, et al.
Leishmania infantum LeIF protein is an ATP-dependent RNA helicase and an eIF4A-like factor that inhibits translation in yeast . FEBS J.
2006; ; 273 : :5086.–5100. 42.
Xingi
E
,
Smirlis
D
,
Myrianthopoulos
V
, et al.
6-Br-5methylindirubin-3’oxime (5-Me-6-BIO) targeting the leishmanial glycogen synthase kinase-3 (GSK-3) short form affects cell-cycle progression and induces apoptosis-like death : exploitation of GSK-3 for treating leishmaniasis . Int J Parasitol.
2009; ; 39 : :1289.–1303. 43.
Siqueira-Neto
JL
,
Moon
S
,
Jang
J
, et al.
An image-based high-content screening assay for compounds targeting intracellular Leishmania donovani amastigotes in human macrophages . PLoS Negl Trop Dis.
2012; ; 6 : :e1671.. 44.
Siqueira-Neto
JL
,
Song
OR
,
Oh
H
, et al.
Antileishmanial high-throughput drug screening reveals drug candidates with new scaffolds . PLoS Negl Trop Dis.
2010; ; 4 : :e675.. 45.
Mougneau
E
,
Bihl
F
,
Glaichenhaus
N
. Cell biology and immunology of Leishmania . Immunol Rev.
2011; ; 240 : :286.–296. 46.
Tacchini-Cottier
F
,
Weinkopff
T
,
Launois
P.
, Does T helper differentiation correlate with resistance or susceptibility to infection with L. major? Some insights from the murine model . Front Immunol.
2012; ; 3 : :32.. 47.
Sacks
D
,
Noben-Trauth
N
. The immunology of susceptibility and resistance to Leishmania major in mice . Nat Rev Immunol.
2002; ; 2 : :845.–858. 48.
Stager
S
,
Rafati
S.
, CD8+ T cells in Leishmania infections : friends or foes?
Front Immunol. , 2012; ; 3 : :5.. 49.
Sassi
A
,
Louzir
H
,
Ben Salah
A
, et al.
Leishmanin skin test lymphoproliferative responses and cytokine production after symptomatic or asymptomatic Leishmania major infection in Tunisia . Clin Exp Immunol.
1999; ; 116 : :127.–132. 50.
Castellano
LR
,
Filho
DC
,
Argiro
L
, et al.
Th1/Th2 immune responses are associated with active cutaneous leishmaniasis and clinical cure is associated with strong interferon-gamma production . Hum Immunol.
2009; ; 70 : :383.–390. 51.
Das
A
,
Ali
N.
, Vaccine development against Leishmania donovani . Front Immunol.
2012; ; 3 : :99.. 52.
Raman
VS
,
Duthie
MS
,
Fox
CB
, et al.
Adjuvants for Leishmania vaccines : from models to clinical application . Front Immunol.
2012; ; 3 : :144.. 53.
Singh
B
,
Sundar
S
. Leishmaniasis : vaccine candidates and perspectives . Vaccine.
2012; ; 30 : :3834.–3842. 54.
Duthie
MS
,
Raman
VS
,
Piazza
FM
,
Reed
SG
. The development and clinical evaluation of second-generation leishmaniasis vaccines . Vaccine.
2012; ; 30 : :134.–141. 55.
Maroof
A
,
Brown
N
,
Smith
B
, et al.
Therapeutic vaccination with recombinant adenovirus reduces splenic parasite burden in experimental visceral leishmaniasis . J Infect Dis.
2012; ; 205 : :853.–863. 56.
Gomes
R
,
Oliveira
F.
, The immune response to sand fly salivary proteins, its influence on Leishmania immunity . Front Immunol.
2012; ; 3 : :110.. 57.
Mbow
ML
,
Bleyenberg
JA
,
Hall
LR
,
Titus
RG
. Phlebotomus papatasi sand fly salivary gland lysate down-regulates a Th1, but up-regulates a Th2, response in mice infected with Leishmania major . J Immunol.
1998; ; 161 : :5571.–5577. 58.
Marzouki
S
,
Ben Ahmed
M
,
Boussoffara
T
, et al.
Characterization of the antibody response to the saliva of Phlebotomus papatasi in people living in endemic areas of cutaneous leishmaniasis . Am J Trop Med Hyg.
2011; ; 84 : :653.–661. 59.
Marzouki
S
,
Abdeladhim
M
,
Abdessalem
CB
, et al.
Salivary antigen SP32 is the immunodominant target of the antibody response to Phlebotomus papatasi bites in humans . PLoS Negl Trop Dis.
2012; ; 6 : :e1911.. 60.
Abdeladhim
M
,
Jochim
RC
,
Ben Ahmed
M
, et al.
Updating the salivary gland transcriptome of Phlebotomus papatasi (Tunisian strain) : the search for sand fly-secreted immunogenic proteins for humans . PLoS One.
2012; ; 7 : :e47347.. 61.
Nicolle
C
. Sur trois cas d’infection splénique infantile à corps de Leishman observés en Tunisie . Arch Inst Pasteur Tunis.
1908; ; 1 : :1.–26. 62.
Nicolle
C
,
Compte
C
. Origine canine du Kala-azar . Arch Inst Pasteur Tunis.
1908; ; 1 : :109.–112. 63.
Theodorides
J
. Historical note on the discovery of cutaneous leishmaniasis transmission by Phlebotomus . Bull Soc Pathol Exot.
1997; ; 90 : :177.–178. 64.
Cox
FE
. History of human parasitology . Clin Microbiol Rev.
2002; ; 15 : :595.–612. 65.
Ul Bari
U
. Chronology of cutaneous leishmaniasis : an overview of the history of the disease . J Pakist Assoc Dermatol.
2006; ; 16 : :24.–27. |