| |
| Med Sci (Paris). 2013 December; 29(12): 1080–1082. Published online 2013 December 20. doi: 10.1051/medsci/20132912006.Influence de PD-1 sur la synapse immunologique Une facette de la régulation immunitaire ? Martin Larsen,1 Victor Appay,1 and Delphine Sauce1* 1Inserm UMRS-945, Infections et immunité, groupe Avenir, Université Pierre et Marie Curie, hôpital Pitié-Salpêtrière, 91, boulevard de l’Hôpital, 75013Paris, France MeSH keywords: Lymphocytes T CD8+, immunologie, Humains, Immunité, physiologie, Synapses immunologiques, Activation des lymphocytes, Récepteur-1 de mort cellulaire programmée |
Le monde contient une grande diversité d’agents pathogènes pour l’homme. Pour se protéger, une multitude de mécanismes de défense existent dont l’un des plus raffinés est le système immunitaire. Comme toute arme, le système immunitaire adaptatif représente, non seulement une protection, mais aussi une menace pour le soi, pouvant conduire à l’apparition de maladies inflammatoires et auto-immunes. Il est donc essentiel de développer des mécanismes de régulation visant à limiter le dérapage du système immunitaire. Ainsi, les réponses cellulaires T sont régulées par une balance entre des signaux activateurs et des signaux régulateurs. Celle-ci peut être assurée par les cellules régulatrices, les cytokines immunorégulatrices ou par l’expression de récepteurs inhibiteurs tels que CTLA-4 (cytotoxic T-lymphocyte antigen 4), TIM-3 (T-cell immunoglobulin domain and mucin domain 3), CD160 ou PD-1 (programmed cell death protein 1). Des études réalisées à la fois chez les souris ou l’homme ont démontré que la suppression de certaines fonctions immunitaires via l’augmentation des signaux inhibiteurs tels que PD-1 contribuait à l’épuisement réversible des réponses T dans le contexte d’une exposition antigénique chronique [
1]. Ceci a été particulièrement bien détaillé lors de l’infection par le VIH (virus de l’immunodéficience humaine) au cours de laquelle la perte progressive des fonctions T (prolifération, sécrétion cytokinique) a été associée à la chronicité virale et à la progression vers la maladie [
2]. |
PD-1 et ses ligands dans la réponse immunitaire L’expression du récepteur PD-1 (CD279 selon la nomenclature des clusters de différenciation) est inductible sur les cellules T CD4+, T CD8+, T natural killer (TNK), les cellules B et les monocytes activés. PD-1 est induit par l’engagement du TCR (T cell receptor) et du BCR (B cell receptor), et son expression augmente après stimulation par le tumor necrosis factor (TNF). Les deux ligands de PD-1 divergent dans leur profil d’expression, PD-L1 étant beaucoup plus ubiquitaire que PD-L2. PD-L1 (aussi appelé B7-H1 ou CD274) est constitutivement exprimé sur les cellules T et B, les cellules dendritiques (DC), les macrophages, les cellules souches mésenchymateuses. Son expression est accrue après activation. L’expression de PD-L1 n’est pas restreinte aux cellules hématopoïétiques, elle est détectée sur d’autres types cellulaires tels que les cellules endothéliales vasculaires, les cellules épithéliales, les cellules musculaires, les hépatocytes, les astrocytes, entre autres. PD-L2 (B7-DC ou CD273) est, quant à lui, induit seulement sur les cellules dendritiques et les macrophages, et peut être détecté sur les cellules endothéliales vasculaires. Ces interactions entre PD-1 et ses ligands non seulement répriment les cellules T au cours de la phase d’amorçage d’une réponse immunitaire dans les tissus lymphoïdes secondaires, mais modulent également les réponses des cellules T effectrices, soit au cours de la migration de ces cellules vers le site de l’inflammation, soit dans le tissu cible. Cela signifie que la présence de PD-1 influence les interactions entre les cellules T et les cellules présentatrices d’antigènes, ce qui peut entraîner une diminution de leur activation. |
Mécanisme de l’inhibition de la réponse immune relayée par PD-1 PD-1 est un monomère de type immunoglobuline exprimé à la surface cellulaire, et son domaine cytoplasmique contient deux domaines tyrosine, ITIM (Y225) (immunoreceptor tyrosine-based inhibitory motif) et ITSM (Y248) (immunoreceptor tyrosine-based switch motif). La phosphorylation d’un résidu tyrosine dans le domaine ITSM de PD-1 semble avoir un rôle fonctionnel clé dans la médiation immuno-inhibitrice de PD-1 : elle conduit au recrutement de la tyrosine phosphatase 2 contenant un domaine SH2 (SHP-2), qui est responsable de la déphosphorylation des molécules de signalisation à proximité du TCR dans la synapse immunologique, comme ZAP-70 (zeta-chain-associated protein kinase 70), JNK (c-Jun terminal kinase) et ERK [
3]. Ainsi, l’activité PI3K induite par CD28 (une molécule de costimulation) est diminuée et, par conséquent, conduit à une moindre activation d’Akt. Le mécanisme exact de l’action antagoniste de PD-1 sur la voie PI3K n’est pas encore clair. La régulation négative induite par la signalisation via PD-1 conduit à une diminution de la libération des cytokines et des chimiokines, une diminution de la cytotoxicité et une diminution de la survie cellulaire.(Figure 1)
 | Figure 1.
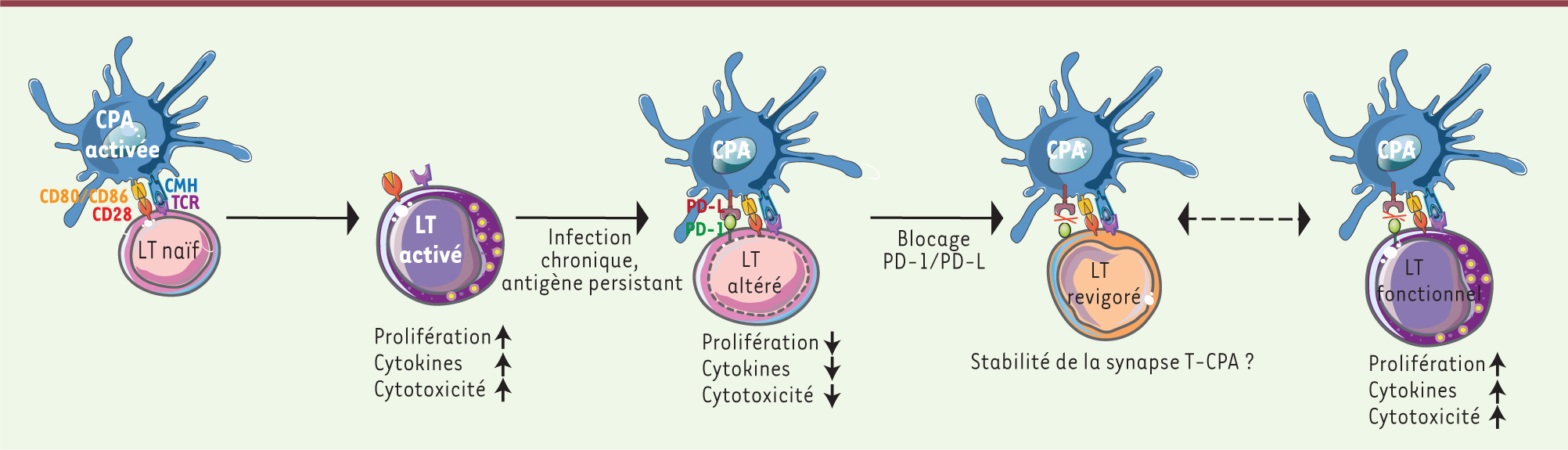
Voie PD-1-PD-L et régulation des fonctions lymphocytaires T. La voie PD-1-PD-L est impliquée dans la dysfonction des cellules T et le manque de contrôle du pathogène lors d’une infection virale chronique ou l’induction de tolérance lors de maladies auto-immunes. Les cellules présentatrices d’antigènes (CPA) activées portant l’antigène ont une expression accrue de CD80 et de CD86, et stimulent la prolifération, la production de cytokines et de l’activité cytotoxique des cellules T naïves spécifiques de l’antigène. Lors d’une infection chronique ou de la présence persistante de l’antigène, les lymphocytes T sont altérés et perdent leur capacité à proliférer. Les lymphocytes T « épuisés » expriment fortement PD-1 et reçoivent un signal fort co-inhibiteur lors de l’engagement des CPA exprimant PD-L. Le blocage des interactions entre PD-1 et ses ligands influence la stabilité de la synapse (motilité cellulaire) et ainsi « revigore » les cellules T afin que celles-ci puissent proliférer et regagner des fonctions effectrices, y compris la production de cytokines et la cytolyse. |
|
Un nouveau rôle pour PD-1 sur la synapse immunologique T CD8 +
Ici nous commentons les récents travaux qui démontrent une autre facette de l’altération de la fonction cellulaire par PD-1 : la modulation de la stabilité des synapses immunologiques. Dans ce contexte, les équipes de Saito et Bluestone [3,
4] ont montré que la signalisation via PD-1 induit une perte de la stabilité des synapses formées entre cellules T CD4+ et leurs cibles, qui entraîne une augmentation de la motilité cellulaire dans un modèle murin de diabète auto-immun. Dans une étude plus récente réalisée par Zinselmeyer et al., la stabilité de la synapse immunologique et la motilité cellulaire ont été étudiées dans le contexte de réponses antivirales CD4+ et CD8+ [
5]. Ces auteurs ont utilisé un modèle bien caractérisé, celui du lymphocytic choriomeningitis virus (LCMV) ; ils ont comparé la phase aiguë (souche Armstrong) et la phase persistante (souche Clone-13) de l’infection virale. La signalisation via PD-1 avait été préalablement largement étudiée dans ce système, montrant que l’infection persistante induit l’expression de PD-1 et l’épuisement des lymphocytes T [
6]. Dans leur travail récent, Zinselmeyer et al. montrent que les antigènes viraux LCMV se trouvent principalement dans la pulpe rouge et la zone marginale de la rate, alors que peu de protéines virales sont trouvées dans la pulpe blanche de la rate. Ils montrent ensuite que les cellules T CD4+ et CD8+ se déplacent plus rapidement dans le tissu ne contenant pas d’antigènes (pulpe blanche) que dans le tissu où les antigènes viraux sont présents (pulpe rouge) ; ceci suggère que les cellules T ne forment des synapses immunologiques que lorsque l’antigène est présent, comme décrit précédemment [3]. Contrairement aux résultats des études antérieures utilisant les cellules T CD4+, ceux de Zinselmeyer et al. montrent que la voie de signalisation PD-1-PD-L1 en fait stabilise la formation de la synapse immunitaire et diminue ainsi la vitesse des cellules T antivirales CD8+ et, à un moindre degré, celle des lymphocytes CD4+. Ces résultats ont été confirmés, dans le cas des lymphocytes T CD8+, dans un modèle in vitro de bicouche lipidique planaire, où le rôle de PD-1 et PD-L1 peut être examiné. Les lymphocytes T CD8+ épuisés (Clone-13) ou non épuisés (Armstrong) ont été obtenus à partir de souris infectées durant sept jours par les souches respectives de LCMV et ont été appliqués dans le système de bicouche planaire. Les lymphocytes T CD8+ PD-1hi (épuisés) forment une synapse plus stable que les lymphocytes T CD8+ PD-1lo (non épuisés) en présence et, plus surprenant aussi, en l’absence de PD-L1. Cela indique que la stabilité accrue de la synapse immunologique et, par conséquent, la paralysie cellulaire, sont fonction non seulement de l’interaction directe entre PD-1 et PD-L1, mais qu’elles peuvent perdurer en l’absence du ligand. |
Stabilisation ou déstabilisation de la synapse immunologique par PD-1 ? Pour résumer, trois études ont évalué l’effet de la signalisation PD-1 sur la stabilité de la synapse immunologique. Quelles que soient les études, il a été démontré que PD-1 agit par le recrutement de phosphatases SHP2 et la déphosphorylation ultérieure de corécepteurs proximaux du TCR (par exemple CD3ε et CD28) et des molécules de signalisation (ZAP-70, ERK et JNK). Ces mécanismes établissent ainsi un consensus quant à l’altération fonctionnelle des cellules T CD4+ et CD8+, incluant la capacité réduite de sécrétion de molécules effectrices, de cytotoxicité et de prolifération. Les trois études, réalisées dans différents contextes, ont analysé trois spécificités lymphocytaires T différentes ; ces travaux ont été effectués in vivo et in vitro en utilisant des outils de mesure très similaires. Cependant, deux études montrent que la signalisation via PD-1 déstabilise la synapse immunitaire des lymphocytes T CD4+ conduisant à une augmentation de la motilité de ces cellules [3, 4]. L’étude la plus récente, quant à elle, montre que la signalisation via PD-1 augmente la stabilité de la synapse immunologique CD8+ (et dans une moindre mesure CD4+), entraînant une paralysie de la motilité cellulaire [5]. Il reste à déterminer si ces différences sont dues à des différences de modèles ou de techniques ou reflètent des différences biologiques réelles entre les cellules T CD4+ et CD8+. On ne sait pas si la paralysie des cellules est un résultat secondaire de l’inactivation fonctionnelle induite par la signalisation via PD-1 ou, de façon plus intéressante, si elle constitue une étape en soi, précédant l’épuisement cytokinique. |
La signalisation via PD-1 est un mécanisme important de régulation qui empêche la suractivation de la réponse immunitaire des cellules T observée dans les maladies inflammatoires et les pathologies auto-immunes. Cette régulation négative ne se limite pas aux cellules T autoréactives, mais s’applique également aux cellules T spécifiques de pathogènes, ce qui peut limiter l’assaut du système immunitaire à l’encontre de ces pathogènes et participer ainsi à leur persistance chez l’hôte. L’augmentation d’expression de PD-1 observée lors d’infections chroniques a été fréquemment associée à un phénomène d’épuisement cellulaire T chez l’homme [2,
7,
8] et dans des modèles murins [6]. Cependant, certaines études, dont la nôtre, ont montré que l’expression de PD-1 est davantage synonyme de rétrocontrôle de l’activation cellulaire que d’épuisement per se [
9,
10]. Comme pour l’interprétation de l’expression cellulaire de PD-1, la cinétique précise des évènements engagés lors de la signalisation via PD-1, en particulier vis à vis de la formation de la synapse immunitaire et de la motilité des cellules T, reste encore ouvert au débat et requiert davantage d’investigations. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Keir
ME
,
Butte
MJ
,
Freeman
GJ
,
Sharpe
AH
. PD-1 and its ligands in tolerance and immunity . Annu Rev Immunol.
2008; ; 26 : :677.–704. 2.
Day
CL
,
Kaufmann
DE
,
Kiepiela
P
, et al.
PD-1 expression on HIV-specific T cells is associated with T-cell exhaustion and disease progression . Nature.
2006; ; 443 : :350.–354. 3.
Yokosuka
T
,
Takamatsu
M
,
Kobayashi-Imanishi
W
, et al.
Programmed cell death 1 forms negative costimulatory microclusters that directly inhibit T cell receptor signaling by recruiting phosphatase SHP2 . J Exp Med.
2012; ; 209 : :1201.–1217. 4.
Fife
BT
,
Pauken
KE
,
Eagar
TN
, et al.
Interactions between PD-1 and PD-L1 promote tolerance by blocking the TCR-induced stop signal . Nat Immunol.
2009; ; 10 : :1185.–1192. 5.
Zinselmeyer
BH
,
Heydari
S
,
Sacristan
C
, et al.
PD-1 promotes immune exhaustion by inducing antiviral T cell motility paralysis . J Exp Med.
2013; ; 210 : :757.–774. 6.
Barber
DL
,
Wherry
EJ
,
Masopust
D
, et al.
Restoring function in exhausted CD8 T cells during chronic viral infection . Nature.
2006; ; 439 : :682.–687. 7.
Larsen
M
,
Sauce
D
,
Deback
C
, et al.
Exhausted cytotoxic control of Epstein-Barr virus in human lupus . PLoS Pathog.
2011; ; 7 : :e1002328.. 8.
Sauce
D
,
Larsen
M
,
Abbott
RJ
, et al.
Upregulation of interleukin 7 receptor alpha and programmed death 1 marks an epitope-specific CD8+ T-cell response that disappears following primary Epstein-Barr virus infection . J Virol.
2009; ; 83 : :9068.–9078. 9.
Sauce
D
,
Almeida
JR
,
Larsen
M
, et al.
PD-1 expression on human CD8 T cells depends on both state of differentiation and activation status . Aids.
2007; ; 21 : :2005.–2013. 10.
Utzschneider
DT
,
Legat
A
,
Fuertes Marraco
SA
, et al.
T cells maintain an exhausted phenotype after antigen withdrawal and population reexpansion . Nat Immunol.
2013; ; 14 : :603.–610. |