| |
| Med Sci (Paris). 2013 December; 29(12): 1071–1073. Published online 2013 December 20. doi: 10.1051/medsci/20132912003.De la mesure en toute chose : dérégulation de p53, cancer et syndromes télomériques Sara Jaber,1 Iva Simeonova,1 and Franck Toledo1* 1Génétique de la suppression tumorale, Institut Curie, centre de recherche, CNRS UMR 3244, UPMC Université Paris 6, 26, rue d’Ulm, 75248Paris Cedex 05, France MeSH keywords: Animaux, Humains, Souris, Mutation, Tumeurs, génétique, Télomère, Protéine p53 suppresseur de tumeur, physiologie |
Inactivation de p53 dans les cancers p53 est l’un des facteurs de transcription les plus étudiés du fait de son importance clinique. En effet, le gène TP53 est muté dans plus de la moitié des cancers sporadiques, et la plupart des autres cancers surexpriment Mdm2 ou Mdm4, les principaux régulateurs négatifs de p53. De plus, les mutations germinales de TP53 causent le syndrome Li-Fraumeni de prédisposition au cancer [
1]. En réponse à divers stress cellulaires, notamment les cassures d’ADN et les signaux oncogéniques, la protéine p53 est stabilisée et activée. Elle induit alors la transcription de multiples gènes impliqués dans l’arrêt du cycle cellulaire, la sénescence, l’apoptose et diverses régulations métaboliques, qui contribuent à sa fonction de suppresseur de tumeur. Ainsi, p53 empêche la prolifération de cellules dont le génome est altéré, ce qui lui a valu le surnom de « gardien du génome » [
2]. La plupart des mutations du gène TP53 identifiées dans les cancers sont des mutations faux-sens ; elles affectent une région centrale de la protéine qui correspond au domaine de liaison à l’ADN qui reconnaît les promoteurs des gènes cibles de p53. Ces mutations sont essentiellement inactivatrices : elles réduisent ou abolissent la capacité de la protéine mutante à lier l’ADN, et donc à réguler ses cibles transcriptionnelles. |
La suractivation de p53 cause une dyskératose congénitale chez la souris La protéine p53 contient un second domaine de liaison à l’ADN, en son extrémité carboxy-terminale (carboxy terminal domain ou CTD) [
3]. La fonction du CTD restait toutefois controversée, d’autant plus que ce domaine est sujet à de nombreuses modifications post-traductionnelles aux effets régulateurs opposés. Pour mieux comprendre le rôle du CTD in vivo, notre équipe a créé une souris qui exprime une p53 tronquée de son domaine carboxy-terminal (p53∆31), via l’intégration par recombinaison homologue d’une mutation non-sens au locus p53 dans des cellules souches embryonnaires [
4]. L’analyse des souris p53∆31/∆31
a clairement montré que la délétion du CTD entraîne une augmentation de l’activité de p53, indiquant ainsi que le CTD exerce essentiellement un rôle régulateur négatif. Plus intéressant encore, la plupart de ces souris meurent rapidement après la naissance, en présentant les symptômes caractéristiques d’un dysfonctionnement télomérique [4]. Ces souris souffrent notamment d’aplasie médullaire et de fibrose pulmonaire, et leurs cellules ont des télomères anormalement courts (Figure 1). En fait, ces souris présentent la plupart des signes cliniques d’une dyskératose congénitale (DC), l’archétype des syndromes télomériques (Tableau I) [
5]. Ces résultats indiquent que p53 joue un rôle majeur, auparavant insoupçonné, dans la régulation du métabolisme des télomères.
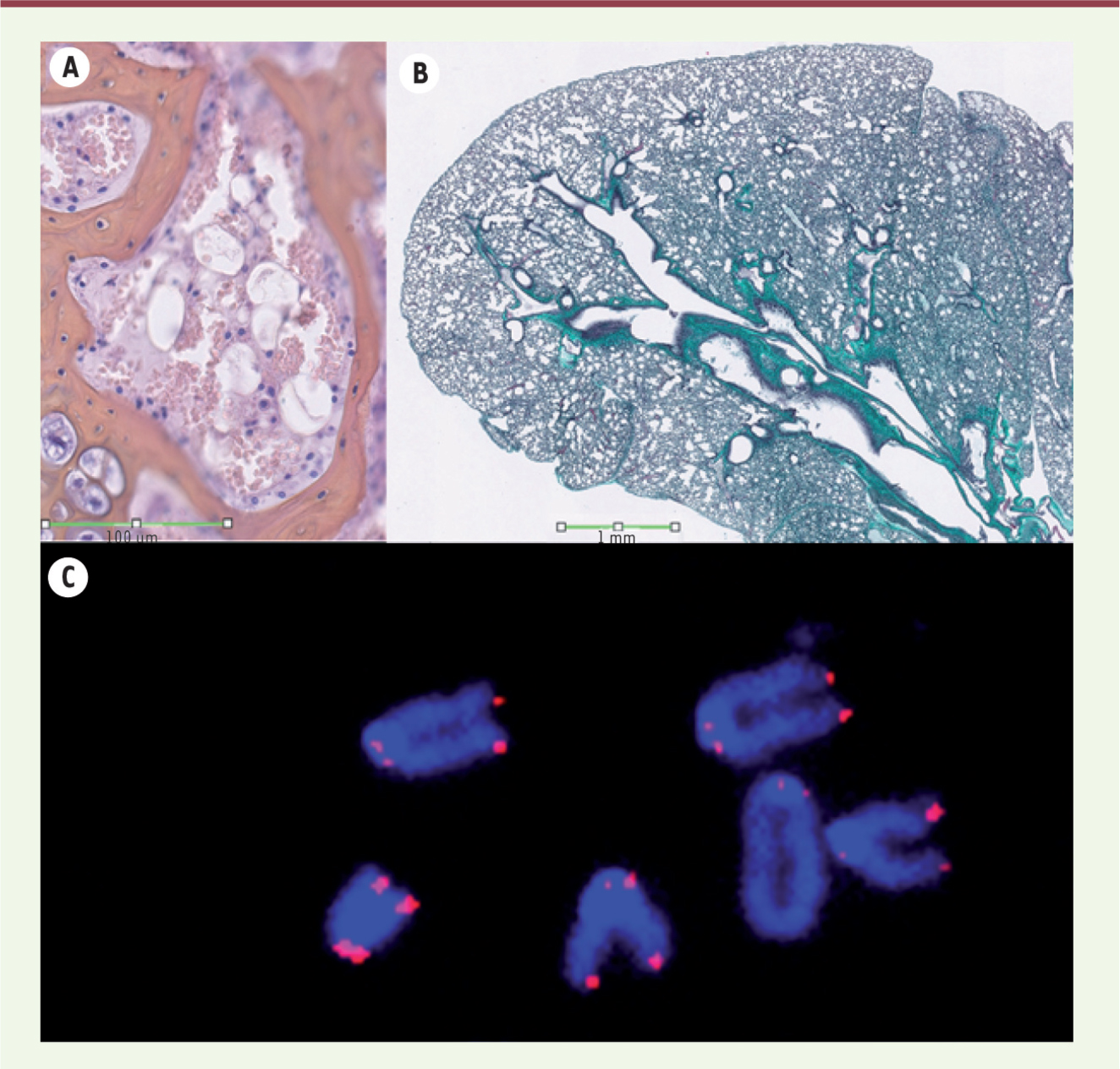
 | Figure 1.
Les souris exprimant la p53
∆31
présentent des caractéristiques de dyskératose congénitale. A. Marquage hématoxyline et éosine d’une section de sternum. La rareté des cellules (en bleu) dans la moelle osseuse de ces souris indique un défaut d’hématopoïèse. B. Marquage au trichrome de Masson d’une section de poumon. La coloration intense du collagène (en vert) démontre une fibrose pulmonaire. C. Analyse de la longueur des télomères par FISH quantitative avec une sonde spécifique des télomères (en rouge). La faible intensité du signal indique que les chromosomes des cellules mutantes ont des télomères anormalement courts. |
Tableau I.
| Caractéristiques phénotypiques des patients atteints de DC |
Pourcentage des souris p53
∆31/∆31
présentant ces caractéristiques |
| Caractéristiques physiques (triade diagnostique) |
|
| Hyperpigmentation cutanée |
100 % |
| Dystrophie unguéale |
8 % |
| Leucoplasie orale |
100 % |
| Symptômes pathologiques |
|
| Aplasie médullaire |
100 % |
| Fibrose pulmonaire |
87 % |
| Phénotype moléculaire |
|
| Dysfonctionnement télomérique |
100 % |
| Autres phénotypes potentiellement associés |
|
| Hypertrophie cardiaque |
100 % |
| Taille réduite |
63 % |
| Atrophie testiculaire |
91 % (des mâles) |
| Hypoplasie cérébelleuse |
30 % |
Manifestations phénotypiques de la dyskératose congénitale (DC) chez les souris
p53∆31/∆31
|
Nous avons ensuite montré que l’activation de p53 conduit à une diminution de l’expression de quatre gènes impliqués dans le maintien des télomères : Dyskerin (Dkc1), Rtel1, Tinf2 et Terf1 [4,
6] (→).
(→) Voir la Synthèse de T. Le Guen et al., page 1138 de ce numéro
Ces observations semblaient particulièrement importantes puisque chez l’homme la mutation de Dkc1, Rtel1 ou Tinf2 peut causer une dyskératose congénitale, alors que Terf1 a été impliqué dans l’aplasie médullaire. En utilisant des souris p53∆31/∆31
de fonds génétiques différents, nous avons également observé qu’un niveau plus élevé de Rtel1 permet d’atténuer la sévérité des symptômes des souris atteintes. Le phénotype télomérique causé par la délétion du CTD dépend donc des niveaux d’expression d’au moins l’un des gènes télomériques régulés par p53. |
La suractivation de p53 peut-elle causer une dyskératose congénitale chez l’homme ? Nos résultats chez la souris posent évidemment la question de leur pertinence en santé humaine. À ce titre, il est tout d’abord important de constater que les domaines carboxy-terminaux des protéines p53 murine et humaine sont très conservés. Par ailleurs, nous avons ciblé la mutation codant p53∆31, ainsi que trois autres mutations non-sens codant respectivement p53∆36, p53∆45 ou p53∆52, dans des fibroblastes embryonnaires murins par recombinaison homologue de type Cre/Lox. De ces quatre mutations affectant l’exon 10 du gène p53 murin, seules les deux dernières entraînent des niveaux plus faibles d’expression et d’activité de p53. Or les mutations non-sens équivalentes recensées dans les cancers humains codent également pour une p53 tronquée d’au moins 45 acides aminés [4]. Par ailleurs, une fraction importante des patients atteints de dyskératose congénitale (ou de son variant sévère le syndrome d’Hoyeraal-Hreidarsson [6]) ont des mutations dans les gènes DKC1 ou RTEL1, et nous avons montré que, comme chez la souris, l’activation de la p53 humaine entraîne une diminution de l’expression de ces deux gènes. Étant donné que les mutations des gènes dont l’implication dans une dyskératose congénitale a été identifiée n’expliquent que 50 % des cas cliniques, il devrait être intéressant de rechercher des mutations du gène TP53 chez les patients souffrant d’un syndrome télomérique dont l’origine moléculaire reste inexpliquée. |
Importance d’un dosage précis de p53 Outre sa fonction bien connue de suppresseur de tumeurs, p53 intervient dans des processus très variés tels que la longévité, la fertilité et la production de cellules souches. P53 est également impliquée dans certaines maladies comme le diabète et différentes maladies neurodégénératives [
7,
8] (→).
(→) Voir la Synthèse de M. Lacroix et al., page 1125 de ce numéro
Ces multiples fonctions justifient l’existence d’une régulation précise de p53 via - entre autres - ses principaux régulateurs négatifs Mdm2 et Mdm4. De fait, plusieurs modèles murins ont révélé l’impact de variations des niveaux d’activité de p53. En l’absence de p53, toutes les souris développent des tumeurs, fatales en moins de six mois [
9]. À l’inverse, chez les mutants Mdm2-/-
ou Mdm4-/-
, l’incapacité d’inhiber p53 se traduit par une létalité embryonnaire [
10]. Entre ces deux extrêmes, différents phénotypes intermédiaires ont été observés. Par exemple, la plupart des souris exprimant des p53 mutantes dont l’activité est réduite, mais non nulle (p53R172P ou p53∆P), développent des tumeurs dans la deuxième année de leur vie [
11,
12]. Les souris Super-p53, dont l’activité de p53 est une fois et demi supérieure à la normale, développent moins de tumeurs que les souris sauvages [
13]. Des souris p53+/m
, exprimant une p53 mutante avec une activité un peu plus forte, sont également résistantes au développement tumoral, mais souffrent d’un vieillissement accéléré [
14]. Notre étude montre que dans les souris p53∆31/∆31
, une activité de p53 encore plus élevée conduit à un raccourcissement télomérique et à une aplasie médullaire, entraînant la mort avant l’âge adulte. Il est important de noter que la plupart des souris p53+/∆31
(que nous avons observées pendant un an) ne présentent pas de phénotype notable, alors que les animaux p53+/∆31 Mdm4+/-
présentent le même phénotype que les souris p53∆
31/∆31 [4]. Ces résultats révèlent qu’une variation de l’activité p53 d’un facteur deux est suffisante pour induire ou non une aplasie médullaire létale, ce qui démontre l’importance physiologique de la régulation très précise de p53. |
De la mesure en toute chose : cette maxime célèbre semble s’appliquer parfaitement à la régulation de p53. En effet, si une activité anormalement basse de p53 favorise l’apparition de cancers, une activité accrue peut conduire à un vieillissement accéléré, voire une létalité prépubère ou même embryonnaire. Nos résultats ont révélé que le contrôle du métabolisme télomérique est une fonction importante de p53, et qu’une régulation fine de cette fonction est nécessaire à la survie de l’animal. Ainsi, plus de 30 ans après sa découverte, p53 ne cesse de nous surprendre par l’étendue de ses fonctions, et par la variété des conséquences de sa dérégulation. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Toledo
F
,
Wahl
GM
. Regulating the p53 pathway : in vitro hypotheses, in vivo veritas . Nat Rev Cancer.
2006; ; 6 : :909.–923. 2.
DP Lane . Cancer. p53, guardian of the genome . Nature.
1992; ; 358 : :15.–16. 3.
Foord
OS
,
Bhattacharya
P
,
Reich
Z
,
Rotter
V
. A DNA binding domain is contained in the C-terminus of wild type p53 protein . Nucleic Acids Res.
1991; ; 19 : :5191.–5198. 4.
Simeonova
I
,
Jaber
S
,
Draskovic
I
, et al.
Mutant mice lacking the p53 C-terminal domain model telomere syndromes . Cell Rep.
2013; ; 3 : :2046.–2058. 5.
Hoareau-Aveilla
C
,
Henry
Y
,
Leblanc
T
. La dyskératose congénitale . Med Sci (Paris).
2008; ; 24 : :390.–398. 6.
Le Guen
T
,
Jullien
L
,
Schertzer
M
, et al.
RTEL1 (regulator of telomere elongation helicase 1), une hélicase d’ADN essentielle à la stabilité du génome . Med Sci (Paris).
2013; ; 29 : :1138.–1144. 7.
Brady
CA
,
Attardi
LD
. p53 at a glance . J Cell Sci.
2010; ; 123 : :2527.–2532. 8.
Lacroix
M
,
Linares
LK
,
Le Cam
L
. Rôle du suppresseur de tumeur p53 dans le contrôle du métabolisme . Med Sci (Paris).
2013; ; 29 : :1125.–1130. 9.
Donehower
LA
,
Harvey
M
,
Slagle
BL
, et al.
Mice deficient for p53 are developmentally normal but susceptible to spontaneous tumours . Nature.
1992; ; 356 : :215.–221. 10.
Marine
JC
,
Francoz
S
,
Maetens
M
, et al.
Keeping p53 in check : essential and synergistic functions of Mdm2 and Mdm4 . Cell Death Differ.
2006; ; 13 : :927.–934. 11.
Liu
G
,
Parant
JM
,
Lang
G
, et al.
Chromosome stability, in the absence of apoptosis, is critical for suppression of tumorigenesis in Trp53 mutant mice . Nat Genet.
2004; ; 36 : :63.–68. 12.
Fang
M
,
Simeonova
I
,
Bardot
B
, et al.
Mdm4 loss in mice expressing a p53 hypomorph alters tumor spectrum without improving survival . Oncogene. , 2013 ; doi : 10.1038/onc.2013.62.2013.
13.
García-Cao
I
,
García-Cao
M
,
Martín-Caballero
J
. et al.
EMBO J.
2002; ; 21 : :6225.–6235. 14.
Tyner
SD
,
Venkatachalam
S
,
Choi
J
, et al.
p53 mutant mice that display early ageing-associated phenotypes . Nature.
2002; ; 415 : :45.–53. |