| |
| Med Sci (Paris). 2013 November; 29(11): 949–950. Published online 2013 November 20. doi: 10.1051/medsci/20132911006.
Pseudomonas aeruginosa prise en flagrant délit de casse ! Claudie Lemercier1,2,3* and Sylvie Elsen1,4,5,6 1Université Grenoble-Alpes, 38000Grenoble, France 2CEA, Institut de recherches en technologies et sciences pour le vivant (iRTSV), biologie à grande échelle, 38054Grenoble, France 3Inserm U1038, 17, rue des Martyrs, Bâtiment 40-20, 38054Grenoble Cedex 9, France 4CEA, iRTSV, biologie du cancer et de l’infection, 38054Grenoble, France 5Inserm, UMR-S 1036, 38054Grenoble, France 6CNRS, ERL 5261, 38054Grenoble, France MeSH keywords: Animaux, Toxines bactériennes, pharmacologie, Altération de l'ADN, Histone, métabolisme, Humains, Mutation, Phosphorylation, Infections à Pseudomonas, génétique, Pseudomonas aeruginosa |
Des armes qui attaquent le génome eucaryote de façon encore mystérieuse
Pseudomonas aeruginosa est une bactérie pathogène opportuniste infectant principalement les individus aux défenses immunitaires affaiblies, les patients dont la barrière cutanée est rompue (chirurgie, brûlures, etc.) ou subissant un geste invasif (pose d’une sonde ou d’un cathéter) [
1]. D’autres sujets sont particulièrement à risque : ainsi 80 % des personnes atteintes de mucoviscidose sont chroniquement infectées par cette bactérie. Les infections à P. aeruginosa sont le plus souvent contractées en milieu hospitalier, et elles demeurent un défi pour le corps médical en raison de la multirésistance des souches aux antibiotiques [
2]. La pathogénicité liée aux infections aiguës ou chroniques à P. aeruginosa est multifactorielle [
3]. L’un des systèmes de virulence majeurs associé aux infections aiguës est le système de sécrétion de type 3 (SST3) [
4]. Il est constitué d’une aiguille creuse érigée à la surface de la bactérie qui s’insère dans la membrane plasmique de la cellule hôte et permet l’injection de toxines bactériennes (ExoY, ExoT et ExoS ou ExoU) dans le cytoplasme de la cellule infectée. Nous avons recherché les dommages potentiels causés par P. aeruginosa au patrimoine génétique de la cellule hôte. Pour la première fois, nos travaux montrent que le SST3 est associé à des cassures double-brin de l’ADN - lésions très dangereuses pour le génome -, et à une réaction de la cellule hôte qui va tenter de réparer les dégâts [
5]. |
Des cassures double-brin de l’ADN induites par P. aeruginosa
Un marqueur caractéristique des dommages précoces de l’ADN est la phosphorylation de l’histone H2AX, alors appelée γH2AX. Cet évènement intervient à la suite de cassures double-brin résultant, par exemple, d’une irradiation (thérapeutique ou accidentelle), d’une chimiothérapie ou encore par l’intermédiaire de signaux de stress intracellulaires [
6]. De nombreuses molécules de γH2AX s’accumulent ainsi sur les sites de cassures double-brin, formant des foyers détectables à l’aide d’un anticorps spécifique. Ces foyers nucléaires permettent l’assemblage de complexes protéiques de réparation. Nous avons montré que différentes souches de P. aeruginosa induisaient la phosphorylation de l’histone H2AX dans les noyaux des cellules infectées [5]. Ce signal est détectable bien avant tout signe d’apoptose ou de mort cellulaire. Un test Comet (single cell gel electrophoresis assay) a confirmé que P. aeruginosa induisait des cassures de l’ADN (Figure 1A). De façon très intéressante, des foyers protéiques d’histone γH2AX se forment et colocalisent avec les foyers formés par la p53 binding protein 1 (53BP1), impliquée dans la signalisation et la réparation des cassures de l’ADN (Figure 1B). Cette séquence d’évènements induite par P. aeruginosa est en partie comparable à celle décrite en cas de radiations ionisantes [6].
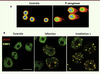 | Figure 1.
P. aeruginosa casse l’ADN des cellules infectées. A. Test Comet. Les cellules sont déposées dans un gel fin d’agarose, puis leur ADN est soumis à un champ électrique. L’ADN intact reste compact (à gauche, contrôle) tandis que l’ADN cassé migre en laissant une traînée en forme de comète (à droite, cellules infectées). B. Formation de foyers protéiques nucléaires γH2AX/53BP1 lors d’une infection par P. aeruginosa (1h30 de contact avec la bactérie, milieu) ou d’une irradiation γ (deux grays, droite). À gauche, des cellules contrôles. L’histone γH2AX est en rouge ; 53BP1 est en vert ; le comarquage est en jaune. Échelle = 10 µm. |
L’utilisation de mutants de P. aeruginosa dépourvus de SST3 fonctionnel, ou privés de l’une ou l’autre de ses deux toxines principales, ExoS et ExoT, a mis en évidence le rôle déterminant de ExoS, dont l’activité ADP-ribosyltransférase s’est révélée cruciale pour l’induction de l’histone γH2AX. La recherche des kinases impliquées dans la phosphorylation de l’histone H2AX induite par P. aeruginosa a établi le rôle majeur joué par la kinase Ataxia telangiectasia mutated (ATM), bien connue pour son rôle de « gardien du génome » [6]. De plus, la bactérie déclenche l’activation d’ATM par un mécanisme d’autophosphorylation, un phénomène lui aussi dépendant de la toxine ExoS [5]. D’autres mécanismes pourraient entrer en ligne de compte. Une étude récente a montré que la synthèse de la protéine de réparation de l’ADN OGG1 (8-oxoguanine ADN glycosylase) était activée lors d’une infection à P. aeruginosa. OGG1, un composant de la voie de réparation par excision de bases, est impliquée dans la reconnaissance et l’élimination de la 8-oxoguanine, un produit potentiellement mutagène résultant de dommages oxydatifs [
7]. L’ensemble de ces données indiquent que P. aeruginosa induit plusieurs types de cassures à l’ADN, simple-brin ou double-brin, qui suscitent plusieurs types de réponse cellulaire pour réparer les lésions. |
De nouvelles hypothèses sur le devenir des cellules infectées par P. aeruginosa
Si les dommages à l’ADN sont trop importants, la cellule s’arrête de proliférer, puis meurt. Une alternative à la mort cellulaire est envisageable si la cellule peut réparer son ADN de façon viable, notamment dans le cas d’une infection mineure associée à une antibiothérapie efficace. Cette possibilité ne constitue qu’une hypothèse à l’heure actuelle. Néanmoins, si la cellule répare son ADN et survit, comme c’est le cas dans d’autres infections (voir cidessous), des questions clefs surgissent : l’intégrité du génome est-elle préservée ? Des anomalies génétiques apparaissent elles ? D’autres bactéries dont les actions dans ce domaine sont mieux caractérisées, notamment Helicobacter pylori et Escherichia coli, pourraient nous montrer la voie. |
Un mécanisme commun à plusieurs bactéries pathogènes ? Il est maintenant admis que l’inflammation chronique causée par H. pylori est responsable d’un grand nombre de cancers gastriques. Plusieurs études ont rapporté que l’infection par H. pylori altérait la réparation des mésappariements de l’ADN dans les cellules gastriques, et qu’elle était également associée à une instabilité génomique et à des mutations de l’ADN [
8]. Trente ans après la découverte de la bactérie, il est établi que H. pylori induit des cassures double-brin de l’ADN et la formation de foyers de réparation contenant 53BP1, l’histone γH2AX et MDC1 (mediator of DNA damage checkpoint protein 1) [
9]. L’infection prolongée saturerait les capacités de réparation des cellules, favorisant ainsi les cancers observés suite à une infection chronique par H. pylori. La très célèbre E. coli, une bactérie de la flore commensale de notre tube digestif, n’est pas en reste dans le domaine des dommages à l’ADN. Des travaux ont montré pour la première fois en 2006 que des souches pathogènes de E. coli, possédant un îlot pks codant pour la toxine colibactine, génèrent des cassures double-brin dans le génome des cellules infectées [
10]. Cinq ans plus tard, les auteurs découvrent que l’infection par ces souches pathogènes induit une instabilité chromosomique et un taux de mutation plus élevé sur les gènes testés [
11]. Enfin, des travaux très récents indiquent que l’inflammation de l’intestin favorisait sa colonisation par des souches génotoxiques d’E. coli produisant la colibactine, puis la progression vers des cancers colorectaux chez la souris [
12]. Les mêmes souches génotoxiques de E. coli ont été retrouvées chez des patients souffrant d’inflammation de l’intestin, suggérant une évolution possible vers des pathologies similaires chez l’homme. Les données sur la génotoxicité associée à E. coli et à H. pylori soulèvent de nombreuses questions sur la façon dont la bactérie P. aeruginosa attaque le génome et, surtout, sur les conséquences à long terme liées aux cassures double-brin et à leur éventuelle réparation. Un champ d’investigation tout nouveau se profile à l’horizon. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Mesaros
N
,
Nordmann
P
,
Plésiat
P
, et al.
Pseudomonas aeruginosa: resistance and therapeutic options at the turn of the new millennium . Clin Microbiol Infect.
2007; ; 13 : :560.–578. 2.
Barbier
F
,
Wolff
M
. Multirésistance chez Pseudomonas aeruginosa. Vers l’impasse thérateutique ?
Med Sci (Paris).
2010; ; 26 : :960.–968.
3.
Balasubramanian
D
,
Schneper
L
,
Kumari
H
,
Mathee
K
. A dynamic and intricate regulatory network determines Pseudomonas aeruginosa virulence . Nucleic Acids Res.
2013; ; 41 : :1.–20. 4.
Hauser
AR
. The type III secretion system of Pseudomonas aeruginosa: infection by injection . Nat Rev Microbiol.
2009; ; 7 : :654.–665. 5.
Elsen
S
,
Collin-Faure
V
,
Gidrol
X
,
Lemercier
C
. The opportunistic pathogen Pseudomonas aeruginosa activates the DNA double-strand break signaling and repair pathway in infected cells . Cell Mol Life Sci.
2013; ; 70 : :4385.–4397. 6.
Ciccia
A
,
Elledge
SJ
. The DNA damage response: making it safe to play with knives . Mol Cell.
2010; ; 40 : :179.–204. 7.
Wu
M
,
Huang
H
,
Zhang
W
, et al.
Host DNA repair proteins in response to Pseudomonas aeruginosa in lung epithelial cells and in mice . Infect Immun.
2011; ; 79 : :75.–87. 8.
Touati
E
. When bacteria become mutagenic and carcinogenic: lessons from H. pylori . Mutat Res.
2010; ; 703 : :66.–70. 9.
Toller
IM
,
Neelsen
KJ
,
Steger
M
, et al.
Carcinogenic bacterial pathogen Helicobacter pylori triggers DNA double-strand breaks and a DNA damage response in its host cells . Proc Natl Acad Sci USA.
108 ; :14944.–14949. 10.
Nougayrède
JP
,
Homburg
S
,
Taieb
F
, et al.
Escherichia coli induces DNA double-strand breaks in eukaryotic cells . Science.
2006; ; 313 : :848.–851. 11.
Cuevas-Ramos
G
,
Petit
CR
,
Marcq
I
, et al.
Escherichia coli induces DNA damage in vivo and triggers genomic instability in mammalian cells . Proc Natl Acad Sci USA.
2010; ; 107 : :11537.–11542. 12.
Arthur
JC
,
Perez-Chanona
E
,
Mühlbauer
M
, et al.
Intestinal inflammation targets cancer-inducing activity of the microbiota . Science.
2012; ; 338 : :120.–123. |


