| |
| Med Sci (Paris). 2013 November; 29(11): 937–940. Published online 2013 November 20. doi: 10.1051/medsci/20132911002.Diversification post-traductionnelle de la spécificité des immunoglobulines Cyril Planchais,1 Nimesh Gupta,1 Srinivas V. Kaveri,1 Sébastien Lacroix-Desmazes,1 and Jordan D. Dimitrov1* 1Centre de recherche des Cordeliers, Université Pierre et Marie Curie (UPMC), Université Paris Descartes, UMR-S 872, Inserm U872, 15, rue de l’École de médecine, 75006Paris, France MeSH keywords: Diversité des anticorps, génétique, immunologie, Spécificité des anticorps, Hème, physiologie, Humains, Immunoglobulines, Maturation post-traductionnelle des protéines |
Mécanismes de diversification du répertoire immunitaire Le système immunitaire est constitué de plusieurs populations cellulaires et de molécules qui confèrent à l’organisme un moyen de se défendre contre tous les facteurs exogènes qui pourraient porter atteinte à son intégrité [
1]. Il participe aussi au maintien de l’homéostasie de l’organisme en éliminant les cellules sénescentes et les cellules transformées, et en participant à la régulation des processus métaboliques. Le fonctionnement du système immunitaire repose sur un échange permanent de signaux. La perception de ces signaux fait intervenir de multiples récepteurs exprimés à la surface des cellules du système immunitaire [1]. Pour exercer ses fonctions de surveillance, le système immunitaire doit, à tout moment, être capable de reconnaître et discriminer un large spectre de déterminants moléculaires du soi et du non-soi. Cette propriété du système immunitaire fait intervenir des récepteurs particuliers exprimés à la surface des lymphocytes B et T, qui sont caractérisés par leur extraordinaire diversité de spécificités antigéniques. La diversité des récepteurs des lymphocytes B (BcR) et des anticorps (Ac) - homologues solubles des récepteurs - résulte de nombreux mécanismes aléatoires de recombinaison génique, d’addition ou de délétion de nucléotides, ainsi que de mutations somatiques qui apparaissent au cours de l’ontogénie des lymphocytes B ou après leur stimulation par l’antigène [
2]. Cependant, la diversité dérivant uniquement de ces mécanismes est limitée et ne permet pas de faire face à l’hétérogénéité, théoriquement infinie, des antigènes potentiels présents dans la nature ou générés de manière synthétique. Cette limitation est compensée par la dégénérescence de la spécificité de certains récepteurs immunitaires, qui peut être considérée comme un deuxième niveau de diversification du répertoire immunitaire [
3,
4]. Ainsi, certaines immunoglobulines (Ig) membranaires et solubles sont capables de s’adapter à de nombreux antigènes structurellement différents. Ces immunoglobulines sont dites polyréactives [4]. Un grand nombre de travaux suggèrent que la capacité des anticorps polyréactifs à se lier à de multiples déterminants antigéniques est due à la plasticité conformationnelle de leurs domaines de liaison à l’antigène, qui leur permet de s’adapter à de nombreuses structures et séquences antigéniques différentes [3, 4]. Dès lors, un répertoire normal d’immunoglobulines possède un continuum de réactivités antigéniques, allant d’une spécificité antigénique très restreinte (monoréactivité), à la capacité de reconnaître des antigènes structurellement différents (polyréactivité) [4]. Ces deux types de reconnaissance antigénique jouent un rôle important dans la « complétion » du répertoire immunitaire. Les anticorps solubles et membranaires monoréactifs sont ainsi responsables de la fidélité des réactivités antigéniques, alors que les anticorps polyréactifs confèrent au répertoire immunitaire une certaine plasticité de réactivités. |
Induction d’une polyréactivité des Ig : un nouveau mécanisme de diversité du répertoire des anticorps En plus des mécanismes génétiques (recombinaison V/D/J et hypermutations somatiques) et conformationnels de génération de la diversité du répertoire des anticorps, des études récentes ont montré l’existence d’un mécanisme supplémentaire de génération de cette diversité. Dans la circulation sanguine de tous les individus sains, on trouve des anticorps circulants monoréactifs qui sont capables de devenir polyréactifs. L’acquisition de cette polyréactivité survient de manière post-traductionnelle, après exposition des anticorps à des molécules de bas poids moléculaire, telles que l’hème ou les ions ferreux que l’on retrouve dans différentes conditions physiopathologiques [
5]. Plusieurs équipes de recherche, dont la nôtre, ont démontré que l’exposition à l’hème d’Ig humaines de donneurs sains augmentait drastiquement la capacité de ces Ig à lier (KD de l’ordre du nanomolaire) différents antigènes du soi ou exogènes (bactéries et virus) [5]. Ainsi, environ 20 % des immunoglobulines circulantes d’un individu sain possèdent cette polyréactivité inductible qui peut être révélée après interaction avec l’hème. Dans nos conditions expérimentales, l’induction de polyréactivité des anticorps n’apparaît qu’après une interaction directe de l’hème avec les immunoglobulines. La liaison de cofacteurs aux Ig est un phénomène qui avait été décrit par le passé. Il était en effet connu depuis longtemps que le répertoire des immunoglobulines d’un individu sain contient des anticorps ayant la capacité de se lier, avec une forte affinité, à de nombreuses molécules hétérocycliques et aromatiques de bas poids moléculaire, ainsi qu’à des ions métalliques [
6,
7]. Ainsi avait-t-il été montré qu’une proportion considérable d’anticorps circulants chez les individus sains est capable de lier différents cofacteurs biologiques, tels que la riboflavine et ses dérivés, mais aussi certaines molécules xénobiotiques comme le 2,4-dinitrophénol. L’interaction de la riboflavine et de ses dérivés avec les anticorps est caractérisée par une affinité supérieure à celle qui est observée dans le cadre de l’interaction de ces cofacteurs avec l’albumine présente dans le sérum humain (connue comme participant largement au transport des molécules hétérocycliques dans le plasma). Il est possible que l’hème se lie à cette même fraction d’anticorps chez tous les individus sains. |
Anticorps polyréactifs inductibles par l’hème : importance en tant que première ligne de défense immunitaire ? Parmi tous les cofacteurs qui interagissent avec les immunoglobulines, l’hème semble être le seul à pouvoir modifier les propriétés du site de liaison à l’antigène. L’hème est un cofacteur macrocyclique contenant un atome de fer. Il est utilisé par de nombreuses protéines pour catalyser des réactions d’oxydoréduction, et participe au transport de gaz (hémoglobine et myoglobine). Les propriétés physicochimiques uniques de l’hème en font une molécule aux interactions multiples. En effet, hormis sa liaison classique aux hémoprotéines, l’hème est connu pour interagir avec de nombreuses autres protéines intracellulaires et extracellulaires [
8]. Sur la base de ces observations et de nos résultats, nous proposons un modèle (Figure 1) dans lequel la capacité intrinsèque de la liaison « promiscuitaire » de l’hème est exploitée par les anticorps pour acquérir de nouvelles spécificités antigéniques. Les anticorps qui sont capables de lier l’hème libre de manière appropriée se servent de ce cofacteur pour étendre le potentiel de réactivités antigéniques au-delà de celles qui sont initialement « inscrites » dans les chaînes polypeptidiques. Les bases moléculaires permettant de distinguer les immunoglobulines sensibles ou non à l’induction de polyréactivité par l’hème restent cependant inconnues.
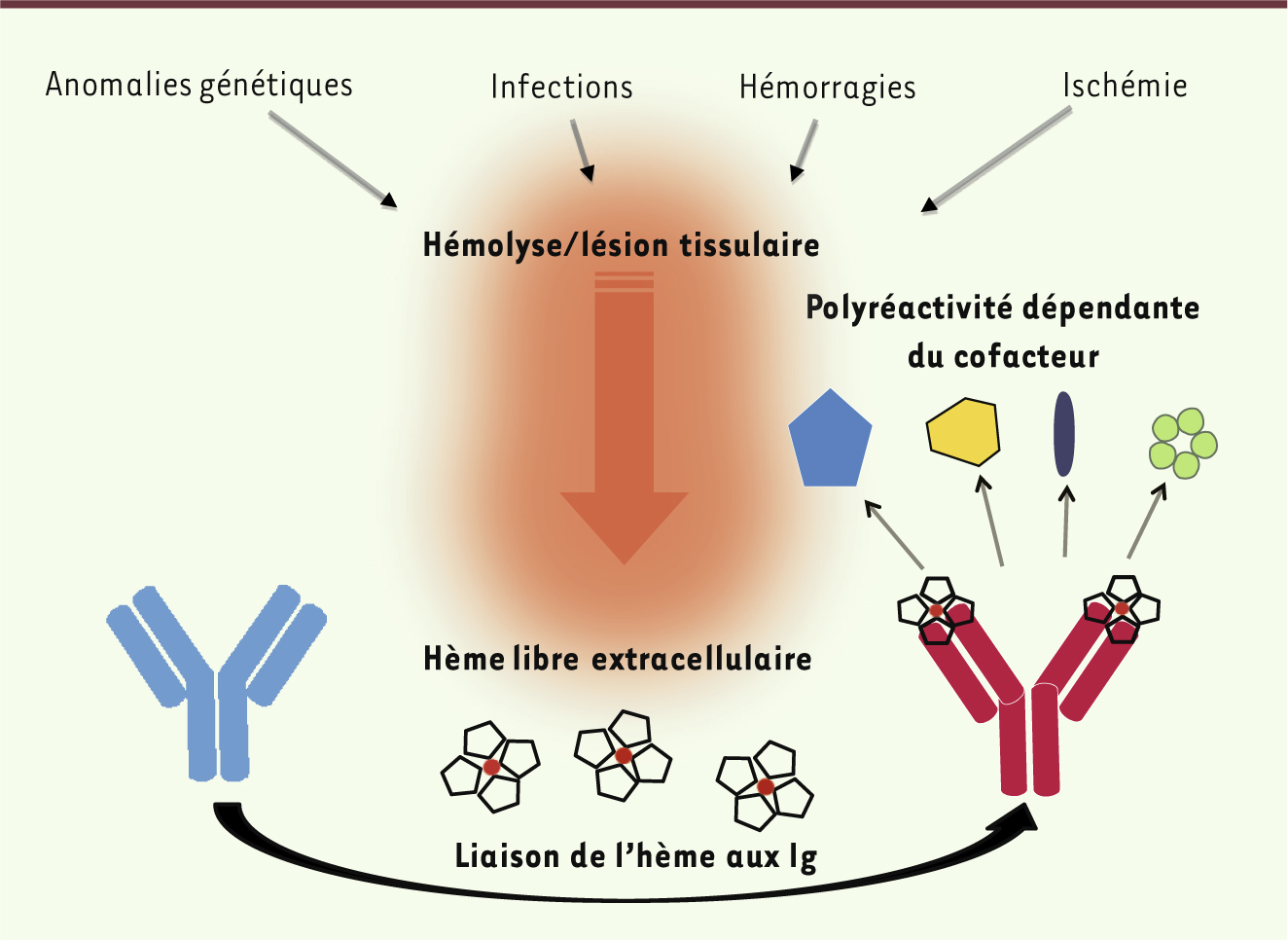
 | Figure 1.
Polyréactivité des anticorps dépendante de cofacteurs. Une grande quantité d’hème peut être libérée dans la circulation sanguine dans différentes conditions pathologiques. Dans ces conditions, certaines immunoglobulines (Ig) circulantes se lient à l’hème libre. Ces anticorps utilisent l’empreinte moléculaire de l’hème pour lier de nouvelles structures antigéniques. Selon notre modèle, l’hème agit comme un signal de danger pour « alerter » le répertoire des immunoglobulines de la situation de stress. L’hème agit aussi comme médiateur moléculaire de la polyréactivité. |
Les anticorps polyréactifs induits par un cofacteur peuvent avoir un rôle important en physiopathologie. Dans des conditions normales, l’hème est étroitement lié aux hémoprotéines et retenu à l’intérieur des cellules. Cependant, au cours de différents processus pathologiques associés à des épisodes d’hémolyse et de lésion tissulaire, comme par exemple le paludisme, la drépanocytose, la thalassémie, les hémorragies, l’ischémie- reperfusion, certaines infections bactériennes, etc., l’hème peut être libéré de ses protéines chaperones et atteindre une forte concentration extracellulaire locale ou systémique [
9]. En particulier, la concentration extracellulaire d’hème libre requise pour accroître in vitro la réactivité des immunoglobulines est atteinte in vivo dans certaines conditions pathologiques. Il est donc probable que les modifications post-traductionnelles à l’origine de l’induction de la polyréactivité des anticorps constituent un mécanisme supplémentaire de diversification du répertoire des immunoglobulines in vivo. Ce recrutement rapide de nouvelles spécificités antigéniques ne serait alors possible que dans certaines conditions pathologiques associées à des destructions tissulaires et en présence d’hème libre. Les anticorps naturellement polyréactifs ont été décrits comme constituant une première ligne de défense contre les organismes pathogènes, et comme molécules immunorégulatrices [4]. La plupart des anticorps polyréactifs sont, par ailleurs, éliminés du répertoire immunitaire suite aux mécanismes de sélection négative des lymphocytes B au cours de leur ontogénie [
10]. De plus, il est probable que les anticorps polyréactifs ont une demi-vie relativement courte en raison de leurs interactions avec de nombreuses molécules endogènes. Il est tentant d’imaginer que l’existence des anticorps polyréactifs inductibles est une stratégie développée par l’organisme pour corriger l’impact préjudiciable de la sélection négative des anticorps fortement polyréactifs qui survient lors de l’ontogénie des lymphocytes B en conditions physiologiques. Ainsi, le caractère monoréactif de ces anticorps polyréactifs inductibles permettrait de retenir dans la circulation des anticorps (et des lymphocytes B) capables de devenir polyréactifs dans certaines conditions particulières (Figure 2). Par ailleurs, ce phénomène serait limité dans l’espace puisque seuls les anticorps polyréactifs inductibles présents à proximité des sites de libération de l’hème libre verraient leur profil de réactivité antigénique augmenter. Le phénomène de polyréactivité induite par un cofacteur pourrait jouer un rôle important dans les étapes précoces de défense immunitaire, alors que les anticorps spécifiques du pathogène et issus de la mise en place de la réponse immunitaire adaptative ne sont pas encore apparus.
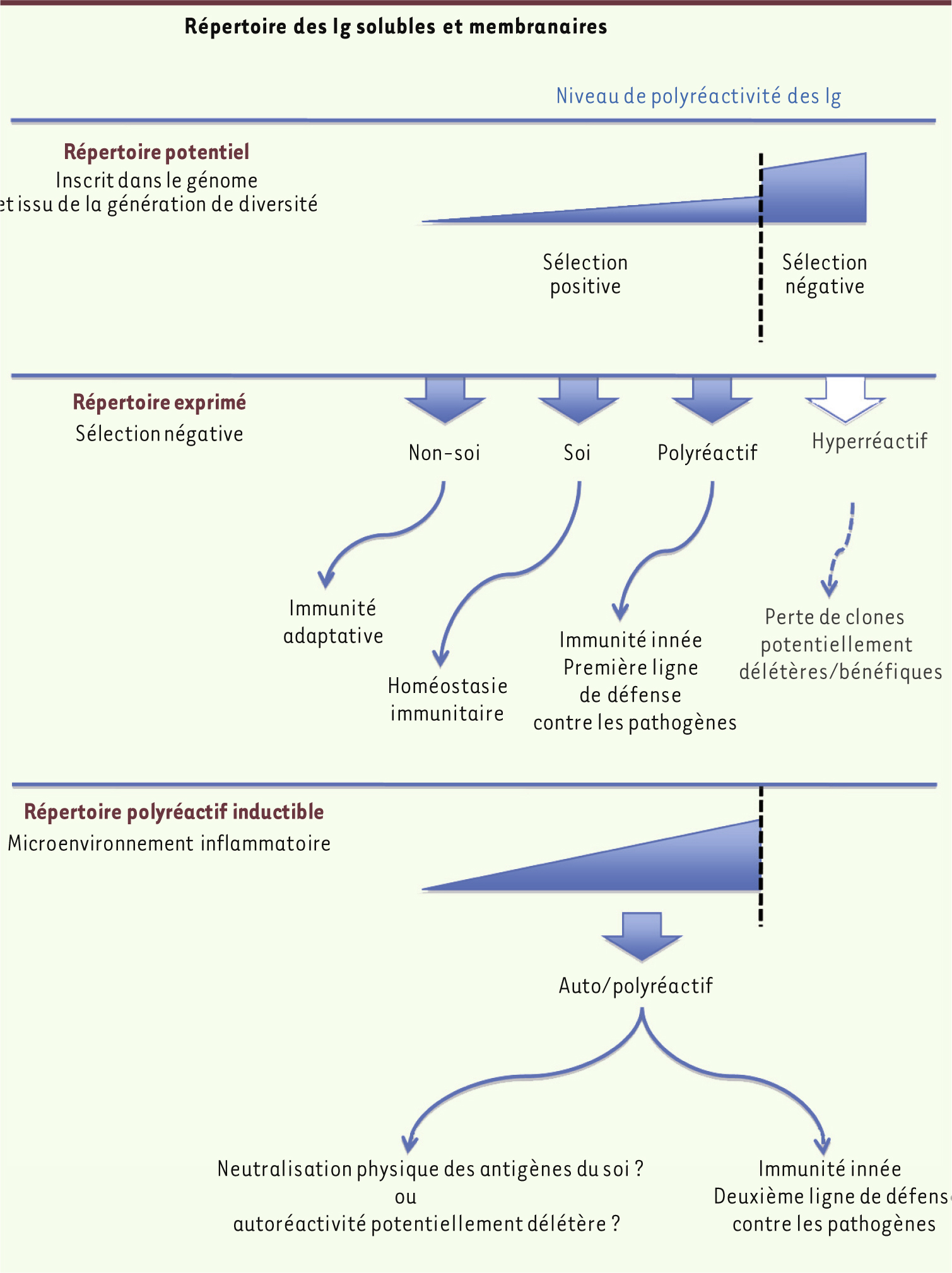
 | Figure 2.
Répertoire de réactivité des immunoglobulines solubles et membranaires. Le répertoire de réactivité des lymphocytes B peut être classifié en trois groupes qui, globalement, suivent le développement des lymphocytes B dans la moelle osseuse et en périphérie. Le répertoire potentiel des immunoglobulines (Ig) circulantes et des récepteurs de lymphocytes B (BcR) résulte de la diversité des gènes V(D)J codant pour les domaines variables des immunoglobulines. Cette diversité repose sur des mécanismes aléatoires d’insertion/délétion de nucléotides mis en place au cours du réarrangement des gènes, sur l’association aléatoire des chaînes lourdes et légères des immunoglobulines et, plus tard au cours de la réponse immunitaire, sur l’accumulation de mutations somatiques qui participent à la maturation d’affinité dans le cadre de réponses thymo-dépendantes. Ce répertoire potentiel est essentiellement autoréactif, avec une prédominance d’immunoglobulines auto/polyréactives. Les clones fortement auto/polyréactifs sont éliminés, conduisant ainsi à la mise en place du répertoire exprimé des lymphocytes B et des immunoglobulines circulantes en périphérie. Le répertoire exprimé de spécificités antigéniques comprend des immunoglobulines solubles et des BcR (1) capables de se lier à des antigènes du non-soi qui participent à la réponse immunitaire adaptative, (2) capables de se lier à des antigènes du soi, qui ont été décrits comme essentiels à l’homéostasie du système immunitaire, et (3) qui sont polyréactifs et qui constituent une première ligne de défense contre les pathogènes, participant ainsi aux mécanismes de défense de l’immunité innée. De plus, l’ensemble des anticorps solubles et des récepteurs polyréactifs comprennent des immunoglobulines autoréactives qui, dans les conditions physiologiques, sont éliminées de la circulation après leur rencontre avec leurs auto-antigènes cibles. L’exposition des lymphocytes B et des immunoglobulines circulants au microenvironnement riche en molécules réactives de l’oxygène induit l’apparition de nouvelles (auto)réactivités sur une fraction des immunoglobulines circulantes et des BcR, qui peuvent agir comme une deuxième ligne de défense contre les pathogènes, neutraliser les médiateurs pro-inflammatoires ou, à l’inverse, être potentiellement délétères. |
|
Conclusions et perspectives Nous proposons que les anticorps polyréactifs inductibles par un cofacteur représentent un troisième niveau de diversification de la spécificité antigénique du répertoire immunitaire. Ce mécanisme induit par des signaux de danger pourrait jouer un rôle important dans la protection de l’organisme et la régulation de son homéostasie. De nombreuses études sont cependant nécessaires pour confirmer ces hypothèses et pour mieux comprendre les mécanismes moléculaires et la pertinence physiopathologique de l’induction de polyréactivité par certains cofacteurs. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ce travail a bénéficié du soutien de l’Inserm, du CNRS, de l’UPMC-Paris 6 et d’aides financières de la part du Centre de recherche des Cordeliers (Prix jeunes chercheurs 2008), du LFB Biomédicaments (Les Ulis, France) et de l’Agence nationale de la recherche (ANR-13-JSV1-0006-01).
|
1.
Paul
WE
. Fundamental immunology . Philadelphia: : Lippincott-Williams and Wilkins; , 2012.
2.
Rajewsky
K
. Clonal selection and learning in the antibody system . Nature.
1996; ; 381 : :751.–758. 3.
Manivel
V
,
Bayiroglu
F
,
Siddiqui
Z
, et al.
The primary antibody repertoire represents a linked network of degenerate antigen specificities . J Immunol.
2002; ; 169 : :888.–897. 4.
Notkins
AL
. Polyreactivity of antibody molecules . Trends Immunol.
2004; ; 25 : :174.–179. 5.
Dimitrov
JD
,
Roumenina
LT
,
Doltchinkova
VR
, et al.
Antibodies use heme as a cofactor to extend their pathogen elimination activity and to acquire new effector functions . J Biol Chem.
2007; ; 282 : :26696.–26706. 6.
Baker
H
,
Frank
O
,
Feingold
S
,
Leevy
CM
. Vitamin distribution in human plasma proteins . Nature.
1967; ; 215 : :84.–85. 7.
McEnaney
PJ
,
Parker
CG
,
Zhang
AX
,
Spiegel
DA
. Antibody-recruiting molecules: an emerging paradigm for engaging immune function in treating human disease . ACS Chem Biol.
2012; ; 7 : :1139.–1151. 8.
Dimitrov
JD
,
Vassilev
TL
, Cofactor-mediated protein promiscuity . Nat Biotechnol.
2009; ; 27 : :892.. 9.
Balla
J
,
Jacob
HS
,
Balla
G
, et al.
Endothelial-cell heme uptake from heme proteins: induction of sensitization and desensitization to oxidant damage . Proc Natl Acad Sci USA.
1993; ; 90 : :9285.–9289. 10.
Wardemann
H
,
Yurasov
S
,
Schaefer
A
, et al.
Predominant autoantibody production by early human B cell precursors . Science.
2003; ; 301 : :1374.–1377. |