| |
| Med Sci (Paris). 2013 October; 29(10): 923–925. Published online 2013 October 18. doi: 10.1051/medsci/20132910023.Chroniques génomiques Un chapeau pour mon repas ? Bertrand Jordan1*† 1CoReBio PACA, case 901, parc scientifique de Luminy, 13288Marseille Cedex 9, France MeSH keywords: Recherche biomédicale, économie, tendances, Essais cliniques comme sujet, Commerce, Thérapie génétique, Hémophilie A, épidémiologie, génétique, thérapie, Humains, Hyperlipoprotéinémie de type I, Amaurose congénitale de Leber, Rétinite pigmentaire, Résultat thérapeutique |

« Tu vas pouvoir manger ton chapeau », m’avait lancé il y a quelques années Bernard Barataud, ce Président sans lequel l’AFM (Association française contre les myopathies) ne serait pas ce qu’elle est aujourd’hui. Il se référait à notre désaccord sur la thérapie génique, objet entre nous deux de discussions « cordiales mais musclées » depuis plus de vingt ans. J’ai en effet régulièrement exprimé mon scepticisme par rapport aux perspectives radieuses de cette approche thérapeutique, telles qu’on les appréhendait dans les années 1990, et ma gêne devant la manière dont l’AFM en faisait son principal cheval de bataille [
1]. Scepticisme que B. Barataud m’a souvent reproché alors que, selon lui, les recherches étaient en train de déboucher. Le fait est pourtant que, jusqu’à récemment, la seule thérapie génique ayant fait l’objet d’une autorisation de mise sur le marché était, en Chine, un procédé de traitement local des cancers de la sphère ORL. Baptisé Gendicine, il a été autorisé par la State food and drug administration (SFDA) chinoise dès 2004, et consiste en une préparation contenant le gène p53 dans un vecteur de type AAV (adenovirus-associated virus) et injectée directement dans la tumeur [
2]. Cette thérapie a fait preuve d’une efficacité modeste, et les données la concernant ont été pour l’essentiel publiées dans des journaux chinois d’audience limitée. Des produits du même type mis au point aux États-Unis, notamment l’Advexin développée par l’entreprise Introgen Therapeutics, ne sont pas arrivés jusqu’à la phase de commercialisation malgré des essais en phase II et même III [1], tandis qu’en Chine, l’Oncorine, produit assez similaire, recevait l’accord de la SFDA en 2005. |
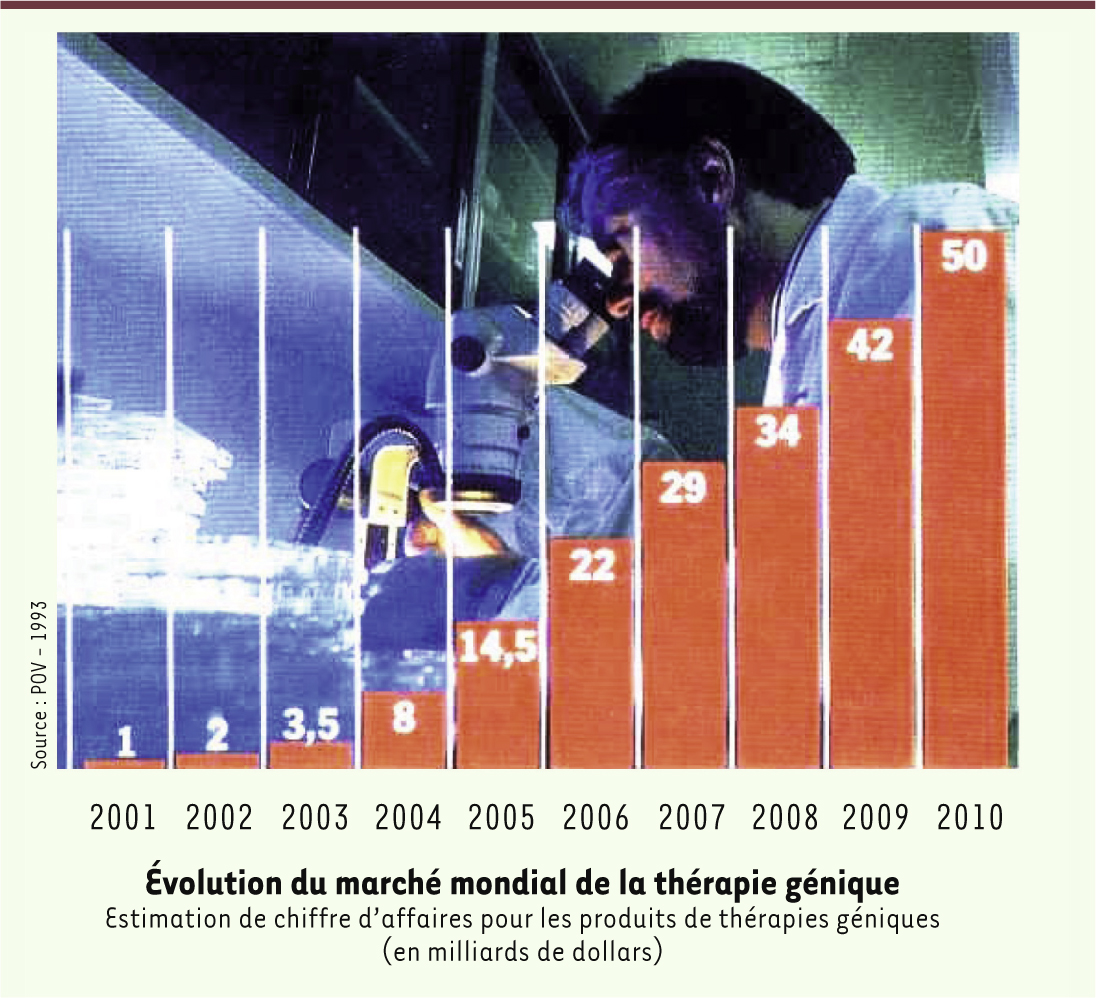
Des péripéties parfois dramatiques, un espoir persistant L’engouement, dans les années 1990, pour cette approche thérapeutique apparemment prometteuse (Figure 1), a suscité le passage prématuré à de nombreux essais cliniques (près de deux mille !) dont quasiment aucun n’a démontré une quelconque efficacité. Comme l’écrivait récemment le New York Times, la thérapie génique est « une technique qui a presque systématiquement échoué pendant vingt ans »1.
 | Figure 1.
Graphique paru dans la revue « Usine Nouvelle » en 1994, prévoyant un marché mondial de cinquante milliards de dollars pour la thérapie génique en 2010. Le marché effectif en 2013 peut être évalué à quelques millions… (© Usine Nouvelle, 1994). |
Notons que beaucoup de ces tentatives s’apparentaient plutôt à des expérimentations médicales portant sur un tout petit nombre de patients et ne constituaient pas des essais en bonne et due forme. Rétrospectivement, il est clair que des impératifs médiatiques et commerciaux on joué un grand rôle dans cette précipitation néfaste. La mort en 1999 d’un jeune patient, Jesse Gelsinger, due à une réaction immunitaire massive contre le vecteur adénoviral employé à forte dose, a donné un coup d’arrêt à tout le domaine. En 2000, pourtant, le succès d’Alain Fisher et Marina Cavazzana-Calvo dans le traitement du SCID-X [
3] a marqué un tournant et a constitué le premier vrai succès de la thérapie génique, en dépit des difficultés dues à la mutagenèse d’insertion constatée chez quelques patients. Depuis, de nombreuses équipes se sont obstinées malgré les difficultés. Il est vrai que, concernant les très nombreuses maladies mendéliennes rares dont le gène est maintenant connu (sans doute plus de trois mille), la thérapie génique porte l’espoir d’une approche « générique ». On pourrait en principe miser sur les thérapies classiques, « déduites de la connaissance du gène » : étudier la fonction de la protéine qui est défectueuse chez les malades, chercher des stratégies médicamenteuses susceptibles de la réactiver ou de la remplacer… mais cette approche suppose de très longues et coûteuses mises au point qu’il est chimérique d’envisager pour chacune de ces affections, compte tenu du faible nombre de malades concernés. En revanche, les délicats problèmes techniques posés par la thérapie génique (mise au point de vecteurs performants et sûrs, transformation efficace des cellules cibles, spécificité de l’insertion du gène-médicament, maîtrise des éventuelles réactions immunitaires, etc.) restent les mêmes (ou presque) pour toutes ces maladies. On peut donc espérer que tout progrès ait des conséquences dans d’autres affections. Et effectivement, on constate que, depuis quelques années, des succès significatifs sont enregistrés lors des essais cliniques sur l’homme, succès qui commencent à se traduire tant au niveau clinique qu’industriel. Je vais en évoquer brièvement trois exemples. |
Il ne s’agit pas là d’une maladie orpheline, compte tenu de sa fréquence, et elle est d’ailleurs depuis le début la cible de tentatives de thérapie génique. Elle peut certes être correctement traitée par des facteurs de coagulation injectables, mais à un coût qui est de l’ordre de 200 000 € par année. De nombreuses tentatives se sont révélées infructueuses, aboutissant à une production trop faible du facteur, à l’extinction rapide du gène introduit, ou à l’apparition d’anticorps neutralisants. Le succès a finalement été obtenu fin 2011 pour l’hémophilie B (déficience en facteur IX2) : une injection unique d’un vecteur dérivé d’un virus adéno-associé (AAV) portant le gène provoque une production durable (au niveau du foie) du facteur de coagulation, en quantité suffisante pour avoir un effet thérapeutique [
4,
5]. Notons que cette réussite n’est pas due à une quelconque révolution technique, mais à la patiente mise au point de tous les aspects du procédé, depuis la construction du vecteur jusqu’à l’inhibition des réactions immunitaires : cela montre bien qu’il n’y a pas d’impossibilité technique, simplement des difficultés considérables mais que l’on peut arriver à surmonter. |
Glybera et la déficience en lipoprotéine lipase Cette fois, il s’agit d’une véritable maladie monogénique rare (la prévalence est de l’ordre d’un pour un million), qui correspond à une mutation entraînant l’absence de la lipoprotéine lipase, d’où une incapacité à digérer les graisses qui provoque pancréatite, diabète et complications cardiovasculaires. Il n’existe aucun traitement, à part des régimes très sévères et modérément efficaces. La thérapie génique introduit, grâce à un vecteur de type AAV, le gène de la lipoprotéine lipase au moyen d’injections intramusculaires au niveau des jambes. Ce produit, mis au point par une entreprise néerlandaise, Amsterdam Molecular Therapeutics et commercialisé par UniQure
3, a démontré son efficacité, et constitue en fait la première thérapie génique ayant reçu, en novembre 2012, une autorisation de mise sur le marché en Europe. Malgré un coût estimé à plus d’un million d’euros par patient, Glybera est donc devenu le tout premier produit de thérapie génique à recevoir une telle autorisation dans le monde occidental [
6]. |
L’amaurose de Leber et la rétinite pigmentaire Le troisième exemple concerne des maladies héréditaires affectant la rétine. Ce tissu constitue un cas favorable pour la thérapie génique, du fait du petit nombre de cellules concernées (réduisant les doses à employer) et de l’isolement immunitaire de l’œil, qui limite les réactions provoquées par les produits introduits. Après de nombreuses études chez l’animal, les premiers essais cliniques chez des patients atteints de rétinite pigmentaire (utilisant, une fois encore, des constructions à base de AAV) ont montré une absence d’effets secondaires et une efficacité notable. Des résultats tout aussi encourageants ont été obtenus pour le traitement de l’amaurose de Leber [
7]. Une jeune entreprise française, Gensight Biologics
4, se spécialise dans ce domaine et vient de procéder à une levée de fonds record de 32 millions d’euros. |
Les financiers reprennent confiance Car effectivement, après l’engouement des débuts puis une période noire où le seul mot de « thérapie génique » suffisait à faire fuir les investisseurs, ce secteur redevient capable d’attirer les fonds sans lesquels toute mise au point d’un traitement est impossible. Selon une étude réalisée par le cabinet spécialisé5,
Research And Markets (et vendue au modique tarif de 4 228 euros pour la version papier), il existerait actuellement 181 entreprises mettant au point des produits de thérapie génique - le chiffre est sûrement surévalué en raison d’une certaine confusion entre thérapie génique et médecine régénérative (cellules souches) - mais il témoigne d’un intérêt certain. Et d’autres firmes actives dans le domaine, comme par exemple Bluebird Bio
6
(Figure 2) en Californie, ont récemment reçu des financements conséquents.
 | Figure 2.
Aperçu du site Internet de Bluebird Bio. Le traitement de la β-thalassémie (répandue dans les populations d’origine africaine) est le produit phare de l’entreprise. |
|
Je ne pense pas devoir déguster mon couvre-chef7, : n’ayant jamais émis de condamnation absolue à l’égard de la thérapie génique, je ne peux que me réjouir du fait qu’elle rencontre enfin des succès. Je serais fort étonné qu’elle atteigne un jour les niveaux stratosphériques imprudemment pronostiqués il y a vingt ans (Figure 1), mais elle va effectivement prendre sa place dans l’arsenal thérapeutique et apporter à des patients à court d’options thérapeutiques l’espoir réel d’un traitement efficace. Cette réussite, même tardive et partielle (mais n’est-ce pas le cas de la plupart des approches thérapeutiques ?), justifie a posteriori les efforts de l’AFM qui, d’ailleurs, contrairement aux apparences, ne s’est pas exclusivement focalisée sur ce thème : les fonds du Téléthon vont à 50 % à l’aide aux malades, et seul le quart environ finance les recherches sur la thérapie génique [1]. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Jordan
B
. Thérapie génique, espoir ou illusion ?
Paris: : Odile Jacob; , 2007.
2.
Wilson
JM
. Gendicine: the first commercial gene therapy product . Hum Gene Ther.
2005; ; 16 : :1014.–1015. 3.
Cavazzana-Calvo
M
,
Hacein-Bey
S
,
de Saint Basile
G
, et al.
Gene therapy of human severe combined immunodeficiency (SCID)-X1 disease . Science.
2000; ; 288 : :669.–672. 4.
Ponder
KP
. Merry Christmas for patients with hemophilia B . N Engl J Med.
2011; ; 365 : :2424.–2425. 5.
Nathwani
AC
,
Tuddenham
EG
,
Rangarajan
S
, et al.
Adenovirus-associated virus vector-mediated gene transfer in hemophilia B . N Engl J Med.
2011; ; 365 : :2357.–2365. 6.
Kastelein
JJ
,
Ross
CJ
,
Hayden
MR
. From mutation identification to therapy: discovery and origins of the first approved gene therapy in the Western world . Hum Gene Ther.
2013; ; 24 : :472.–478. 7.
Colella
P
,
Auricchio
A
. Gene therapy of inherited retinopathies: a long and successful road from viral vectors to patients . Hum Gene Ther.
2012; ; 23 : :796.–807. |