| |
| Med Sci (Paris). 2013 October; 29(10): 868–874. Published online 2013 October 18. doi: 10.1051/medsci/20132910014.« Le monde selon YAP » Un dialogue perpétuel entre les voies Wnt et Hippo Hélène Gilgenkrantz1* 1Institut Cochin, Inserm U1016, CNRS UMR 8104, université Paris-Descartes, 24, rue du Faubourg Saint-Jacques, 75005Paris, France |

Les voies Wnt/β-caténine et, plus récemment, Hippo/YAP (yes associated protein) ont fait leurs premiers pas chez les « drosophilistes ». Le mutant wingless, comme son nom l’indique, est dépourvu d’ailes, le gène muté Wg étant impliqué dans la polarité segmentaire de la mouche. Quelques années plus tard, l’étude des gènes ciblés par le virus MMTV (mouse mammary tumor virus) dans le développement tumoral mammaire chez la souris a permis d’identifier Int-1 (integration-1) qui n’est autre que l’orthologue de Wg chez les mammifères. La fusion des deux noms Wg et Int a ainsi donné le sobriquet Wnt. Depuis, cette voie de signalisation n’a cessé de faire parler d’elle, qu’il s’agisse de prolifération, d’identité ou de destin cellulaires. De plus, une réactivation aberrante de la voie Wnt a été impliquée dans un grand nombre de cancers, au premier rang desquels le cancer colorectal (CCR) et le carcinome hépatocellulaire (CHC). Les différents membres de la cascade de kinases évoluant dans la voie de signalisation Hippo contrôlent, quant à eux, la taille de la mouche. En effet, les pertes de fonction des gènes Warts ou Hippo, de la molécule adaptatrice Sav ou de Mats (Mob as tumor suppressor) aboutissent toutes à une augmentation de la taille des organes chez la drosophile [
1]. Tous ces gènes trouvent leurs homologues, parfois dupliqués, chez les mammifères. Ainsi, Hippo est appelé Mst1/2 (macrophage-stimulating protein 1/2) chez la souris et le médiateur Yki a deux équivalents chez l’homme : YAP et TAZ (transcriptional coactivateur PDZ-binding motif) qui présentent 57 % d’homologie entre eux. La délétion de Mst1/2 induit, au même titre que la surexpression forcée de YAP1, une hyperplasie hépatique et la formation de carcinomes hépatocellulaires et d’adénomes du côlon chez la souris [
2]. Sur l’échiquier physiopathologique, les deux voies Wnt et Hippo semblent donc jouer le rôle de deux adversaires d’une même partie. |
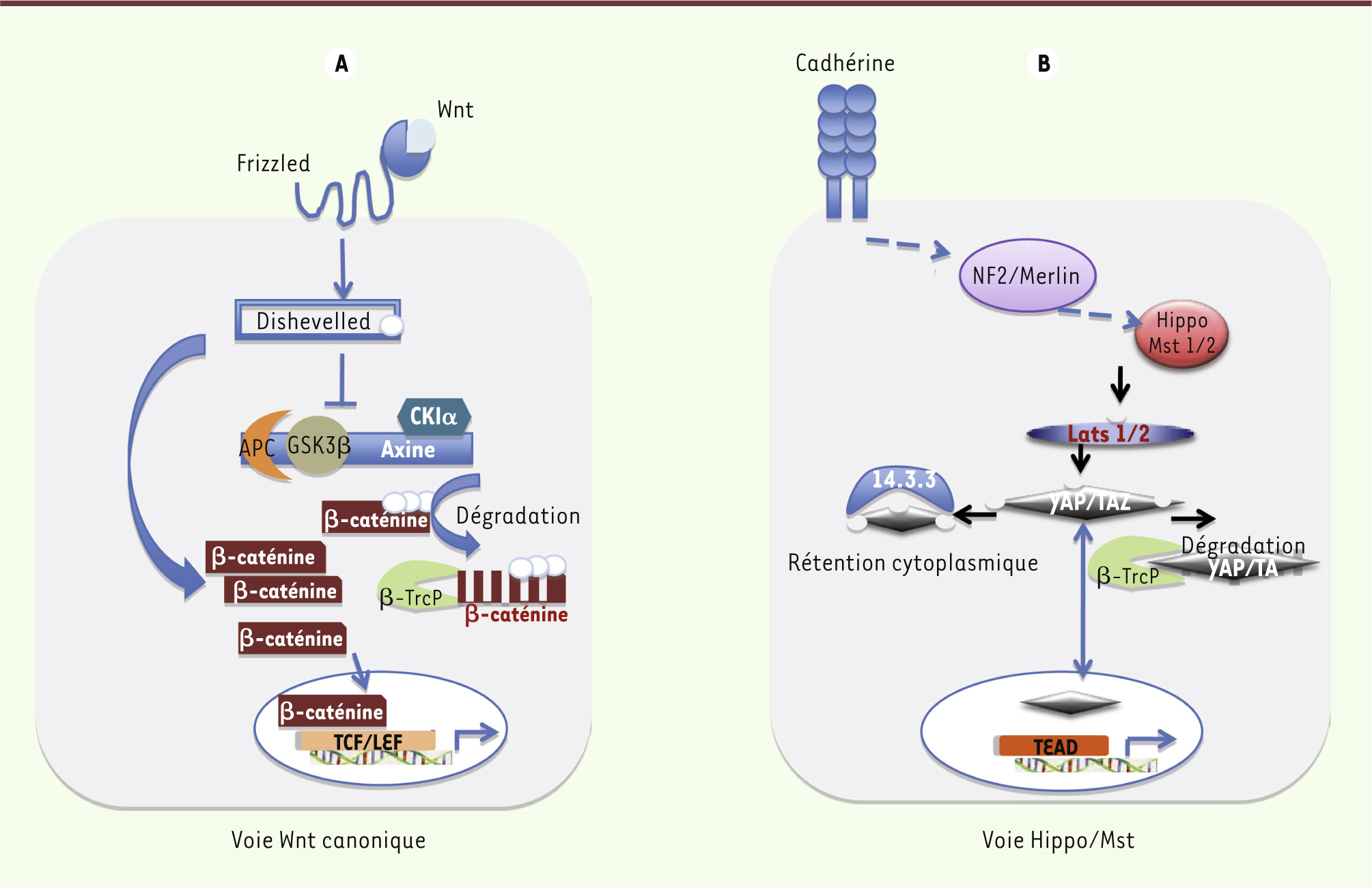
Wnt/β-caténine et Hippo/YAP : deux voies parallèles mais intimement liées Sur le plan mécanistique, les deux cascades de signalisation Wnt et Hippo ont également de nombreux points communs : elles utilisent les mêmes processus de contrôle moléculaire, très conservés au cours de l’évolution, via un ou des seconds messagers, essentiellement YAP dans la voie Hippo et β-caténine pour la voie Wnt. Ceux-ci sont, soit retenus dans le cytoplasme où ils sont dégradés par la même voie ubiquitine-ligase, soit transloqués dans le noyau où ils activeront leurs gènes cibles par l’intermédiaire de cofacteurs, car ils sont incapables de lier eux-mêmes l’ADN. Cependant, si l’activation de la voie Wnt aboutit à l’activation des cibles de la β-caténine, l’activation de la voie Hippo, au contraire, retient YAP dans le cytoplasme l’empêchant d’activer ses cibles. Ces éléments suffisent-ils à faire de ces deux voies des partenaires de choc, et des protéines YAP/TAZ et β-caténine des éléments d’interaction directe ? La littérature récente semble répondre favorablement à cette question légitime. Les premières publications indiquaient que la voie Hippo freinait la voie Wnt. Des travaux plus récents illustrent les relations plus complexes entre ces deux voies de signalisation avec les conséquences que l’on peut entrevoir en oncologie. La littérature récente prend comme modèles le foie et l’intestin : cette revue sera focalisée sur ces deux organes digestifs. Mais revenons aux bases : la voie canonique Wnt a comme principal relais la β−caténine. En absence du ligand, cette dernière reste cytoplasmique, associée à un complexe multiprotéique comprenant les protéines APC (adenomatous polyposis coli), axine 1 ou 2 (axis inhibition protein 1/2), CK1α (casein kinase 1α) et GSK3β (glycogène synthase kinase 3β). CK1α et GSK3β phosphorylent la β-caténine qui est alors ubiquitinée et dégradée par le protéasome. La liaison du ligand Wnt à son récepteur Frizzled (Fzd) et corécepteur LRP5/6 (low-density lipoprotein receptor-related protein 5/6) permet de recruter la protéine dishevelled (Dvl). L’hyperphosphorylation de Dvl inhibe le complexe multiprotéique de dégradation, devenu alors incapable de phosphoryler la β-caténine. Ainsi, au lieu d’être fauchée par le complexe E3 ubiquitine ligase-β-TrcP (β-transducin repeat-containing protein), la β-caténine va pénétrer dans le noyau et activer ses cibles via le complexe LEF-TCF(T cell-specific factor) (Figure 1A).
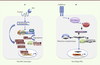 | Figure 1.
Voies de signalisation Wnt canonique et Hippo/Mst. Les deux voies utilisent une cascade de phosphorylations aboutissant à la translocation nucléaire d’un second messager : β-caténine dans le cas de la voie Wnt et YAP/TAZ dans le cas de la voie Hippo. Ceux-ci, en cas de rétention dans le cytoplasme, seront phosphorylés et dégradés par la même voie ubiquitine-ligase. YAP/TAZ ou β-caténine ne fixent pas directement l’ADN, mais elles activent un programme propre impliquant une liaison aux facteurs TCF/LEF pour Wnt et TEAD pour Hippo/Mst. |
La voie Hippo fonctionne de même mais en miroir, impliquant des phosphorylations en cascade et, au passage, quelques coactivateurs essentiels. Schématiquement, Mst1/2 induit la phosphorylation et l’export nucléaire des seconds messagers YAP1 et TAZ qui seront alors dégradés dans le cytoplasme par la voie ubiquitine-ligase. Par conséquent, lorsque la voie Hippo est active, l’effecteur YAP, phosphorylé par les kinases Lats1/2, réside dans le cytoplasme et ne peut exercer ses effets prolifératifs et anti-apoptotiques. A contrario, lorsque la protéine YAP n’est pas phosphorylée, elle est nucléaire et active ses cibles transcriptionnelles via sa liaison aux facteurs de transcription TEAD1-4 (Figure 1B). Enfin, les voies β-caténine et YAP ont en commun d’être régulées par le contact entre cellules. La liaison de la E-cadhérine entre deux cellules stimule la voie de signalisation Hippo, qui freine alors la prolifération en inhibant l’activité de YAP dans le noyau (Figure 1B) [
3]. |
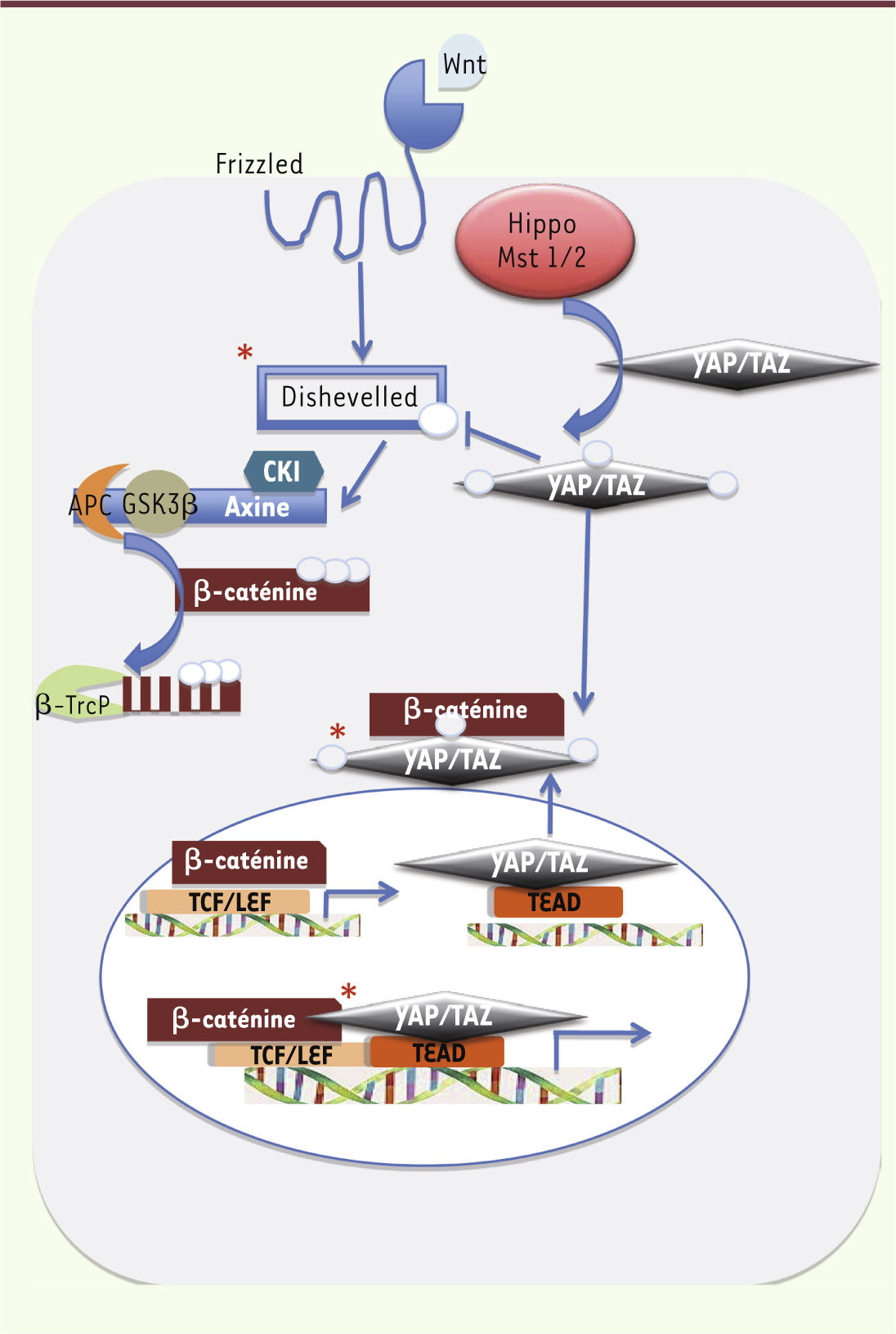
Hippo contrôle Wnt, à moins que ce ne soit le contraire Différents travaux avaient montré que la voie Hippo-Mst/YAP maintenait en respect la voie Wnt/β-caténine. À titre d’exemple, la délétion de Mst1/2 dans l’intestin augmente l’activité de la β-caténine dans ce tissu. Trois publications ont été déterminantes dans ce domaine, plaçant à deux niveaux au moins la restriction de la voie Wnt par la voie Hippo. Varelas et al. [
4] ont ainsi montré que la protéine TAZ interagissait avec Dvl et inhibait sa phosphorylation, limitant d’autant l’activation de la voie Wnt. Imajo et al. [
5] ont, quant à eux, montré que les protéines YAP et TAZ phosphorylées liaient directement la β-caténine et la séquestraient dans le cytoplasme (Figure 2). Ces deux travaux révèlent donc un rôle cytoplasmique des protéines YAP et TAZ qui limitent l’activation nucléaire de la β-caténine. Un troisième niveau d’action, synergique cette fois, a été décrit dans le cœur et les cellules cancéreuses coliques où les protéines YAP et β-caténine, une fois dans le noyau, sont recrutées sur des cibles communes comme SOX2 ou la cycline D1 [
6] (Figure 2). Il n’a pas encore été démontré, néanmoins, que la protéine YAP non phosphorylée était capable de faciliter le transport nucléaire de la β-caténine.
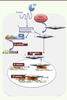 | Figure 2.
La voie Hippo contraint la voie Wnt. Représentation schématique de trois niveaux d’interaction des voies Wnt et Hippo/Mst démontrés dans la littérature (étoiles rouges). (1) L’activation de la voie Hippo induit la phosphorylation et la translocation cytoplasmique de YAP et de TAZ, empêchant alors l’activation de leurs cibles transcriptionnelles nucléaires. Au même moment, les protéines YAP et TAZ phosphorylées se lient à dishevelled et empêchent sa phosphorylation par CK1 [
10]. (2) Les protéines YAP/TAZ phosphorylées se lient à la β-caténine empêchant sa translocation nucléaire [ 5]. (3) Dans les noyaux des cardiomyocytes, YAP/TAZ se lient à la β-caténine et coopèrent pour activer des cibles communes via les facteurs de transcription TEAD et TCF/LEF. Si la voie Hippo est active, il y aura translocation cytoplasmique de YAP qui ne pourra plus activer ces cibles communes. Ainsi, l’activation de la voie Hippo supprime la signalisation Wnt/β-caténine [ 6]. |
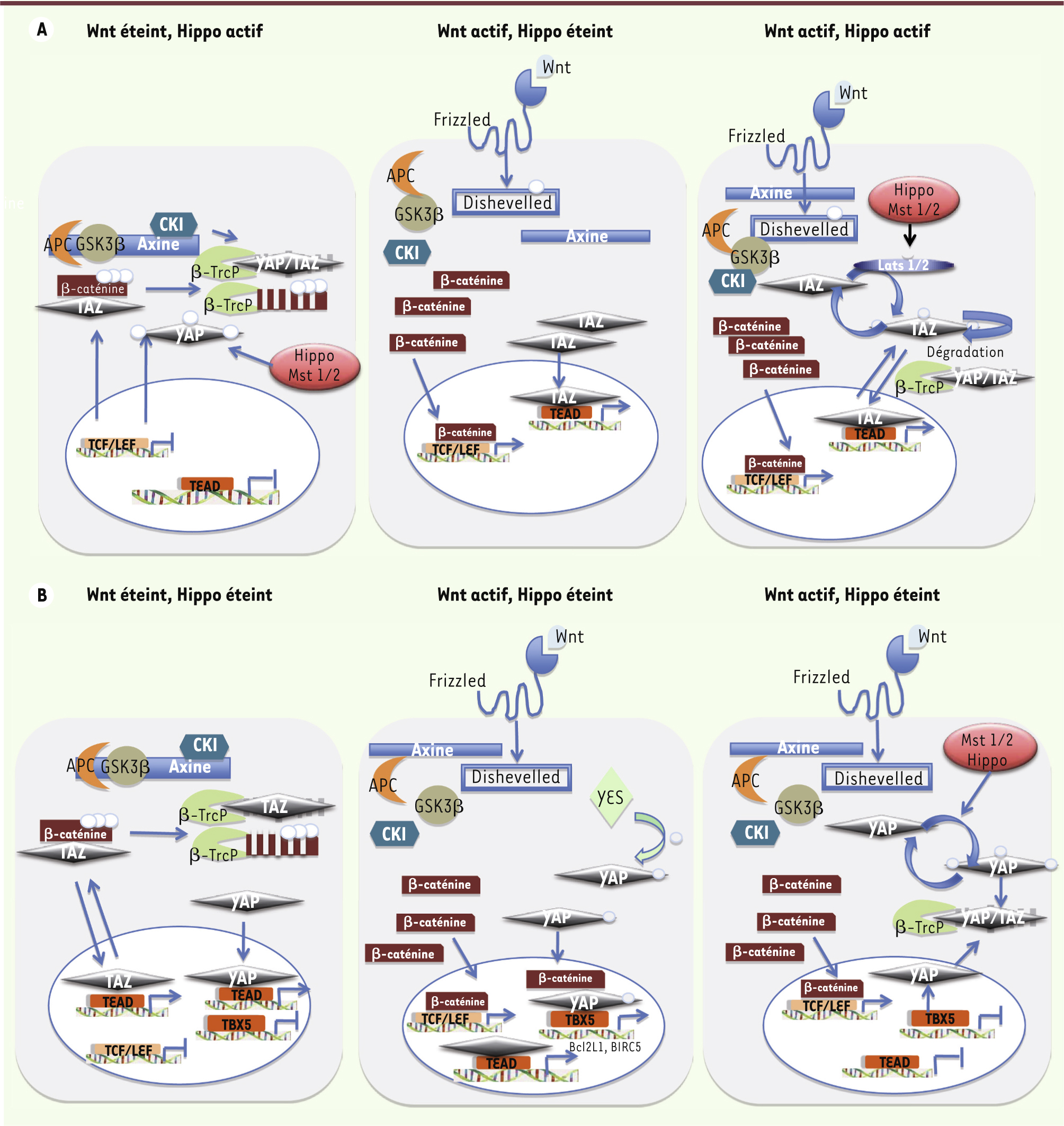
Deux travaux récents publiés dos-à-dos dans la revue Cell en décembre 2012 inversent les rôles et suggèrent que la voie Wnt contrôle à son tour la voie Hippo-Mst. L’équipe italienne de Piccolo démontre que le ligand Wnt3a induit l’accumulation de la protéine TAZ, faisant de cette protéine un second messager de la voie Wnt au même titre que la β-caténine [6]. Ces résultats rappellent des travaux antérieurs qui, par immunoprécipitation de chromatine, avaient identifié des sites de liaison du complexe β-caténine/TCF dans un intron du gène YAP dans des cellules de cancer colorectal [
8]. De plus, la dégradation de TAZ semble directement dépendante de la phosphorylation de la β-caténine par la protéine GSK3β. Ainsi, en absence d’activation de la voie Wnt, mais en présence d’une voie Hippo activée, la β-caténine restreint l’expression de TAZ et de ses cibles transcriptionnelles (Figure 3A). Lorsque la voie Wnt est activée, le complexe de dégradation de la β-caténine n’est plus actif et la β-caténine peut s’accumuler dans le noyau où elle active ses cibles par l’intermédiaire du facteur LEF/TCF. Si la voie Hippo est éteinte, TAZ échappe à la dégradation et une accumulation nucléaire concomitante de TAZ et de β-caténine a alors lieu (Figure 3A), la protéine TAZ interagissant également dans le noyau avec ses cibles respectives via TEAD. Si les deux voies sont actives, des signaux contradictoires aboutiront à une balance entre la dégradation de TAZ et sa rétention dans le noyau, où elle activera ses cibles (Figure 3A). L’ensemble de ces résultats permettent de conférer un double rôle à la β-caténine en fonction de sa localisation cytoplasmique ou nucléaire.
 | Figure 3.
Les interactions des deux voies Wnt et Hippo. A. Les interactions des voies Wnt/Hippo selon Azzolin et al. [
7]. Lorsque la voie Wnt n’est pas active, la β-caténine est dégradée dans le cytoplasme par le protéasome. Néanmoins, lorsque la voie Hippo est active, la β-caténine phosphorylée aurait un rôle de rétention et de dégradation de la protéine TAZ, freinant son action nucléaire. En présence d’un signal Wnt, le complexe de dégradation de la β-caténine n’est plus actif et la β-caténine peut s’accumuler dans le noyau où elle active ses cibles par l’intermédiaire du facteur LEF/TCF. Si la voie Hippo est éteinte, la protéine TAZ interagit également dans le noyau avec ses cibles respectives via TEAD. Lorsque les deux voies sont actives, des signaux contradictoires aboutissent à une balance entre la dégradation de TAZ ou sa rétention dans le noyau où elle active ses cibles. B. Les interactions des voies Wnt/Hippo selon Rosenbluh et al. [
9]. Lorsque les deux voies Wnt et Hippo sont éteintes, la β-caténine phosphorylée reste cytoplasmique et peut lier TAZ et induire sa destruction. Cependant, la voie Hippo étant également éteinte, les protéines TAZ et YAP pourront être retenues dans le noyau et activer leurs cibles respectives, mais YAP ne pourra pas activer les cibles dépendantes de TBX5 en l’absence de β-caténine nucléaire. Lorsque la voie Wnt est activée, la β-caténine s’accumule dans le noyau et, en l’absence de signalisation Hippo, la protéine YES phosphoryle YAP, induisant la formation du complexe nucléaire comprenant YAP phosphorylé, β-caténine et TBX5. Ce complexe active l’expression de gènes anti-apoptotiques comme Bcl2L1 ou Birc5. En cas d’activation des deux voies, c’est-à-dire en présence des signaux de régulation négative de la voie Hippo activée, YAP est retenue dans le cytoplasme et y est dégradée. Seuls les gènes cibles de la β-caténine seront alors induits. |
En criblant plus de 80 lignées cellulaires, Rosenbluh et al. [9] ont identifié YAP1, YES (une kinase Src-like) et TBX5 - un facteur de transcription à boîte T - comme des gènes requis dans la survie et la prolifération de lignées cellulaires dont la voie β-caténine est activée. Un nouveau complexe tripartite associant la β-caténine et les protéines YAP1 et TBX5 a été mis en évidence dans l’activation de gènes de survie, comme Bcl2L1 et Birc5. Ainsi, la phosphorylation de YAP1 par la tyrosine kinase YES permet la formation de ce complexe dans le noyau (Figure 3B). Lorsque YES1 est inhibée par une molécule inhibitrice, la prolifération des cellules cancéreuses présentant une activation de la β-caténine est diminuée. Ainsi, la dérégulation de la voie β-caténine pourrait conduire au cancer par deux chemins différents en fonction du complexe nucléaire formé, soit avec YAP1 et TBX, soit avec LEF-TCF. D’autres voies de signalisation, comme les voies TGF-β, et EGFR (epidermal growth factor receptor) sont également liées à la fois à la voie Wnt et à la voie Hippo, compliquant encore ces interactions [10]. |
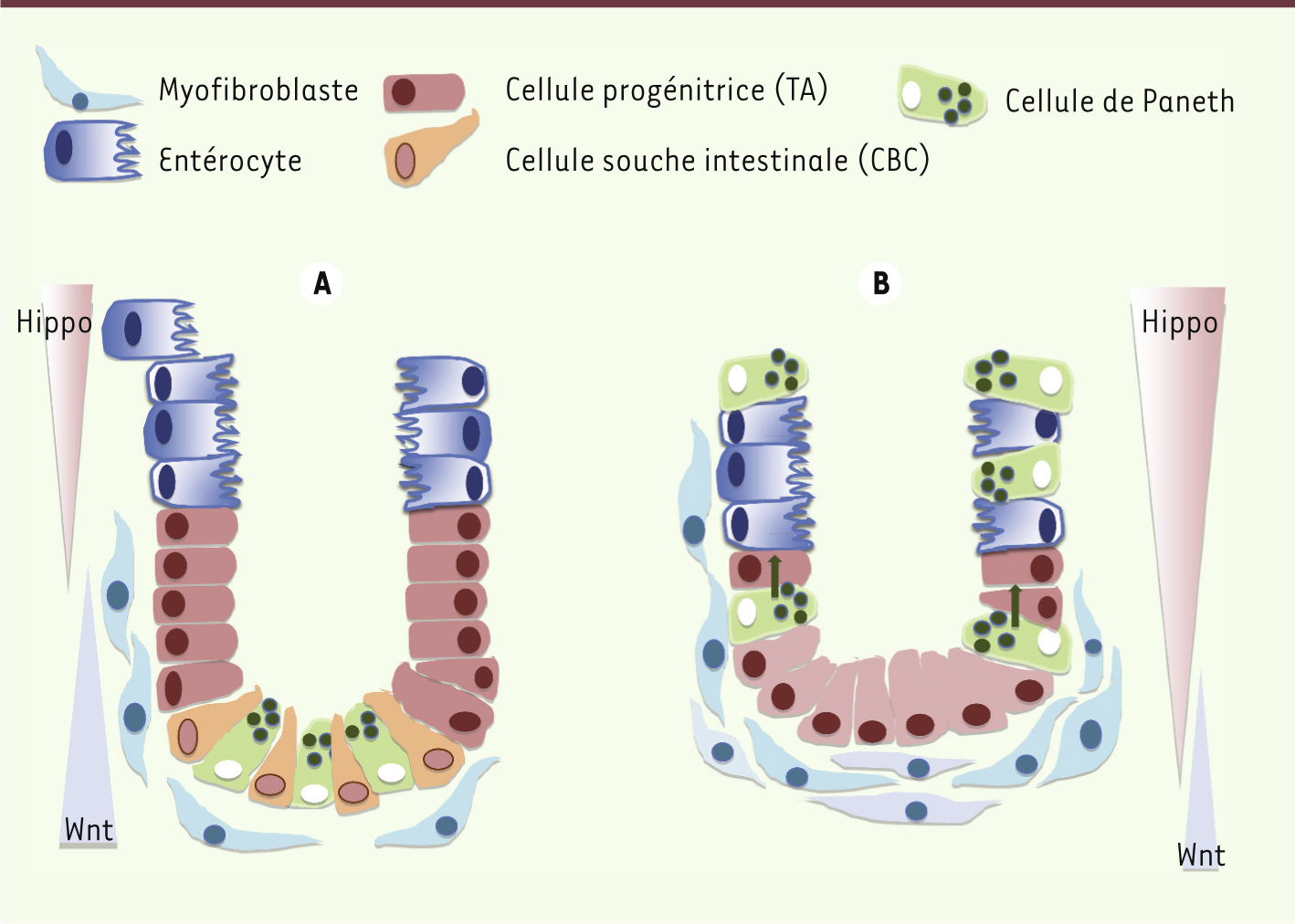
Hippo/Wnt et cellules progénitrices dans le foie et l’intestin L’extraordinaire capacité régénératrice du foie est essentiellement assurée par les hépatocytes. Néanmoins, dans un contexte où la prolifération hépatocytaire est inhibée (hépatopathie chronique ou aiguë chez l’homme, régimes spécifiques chez la souris), une population de cellules progénitrices ou de cellules dites ovales peut prendre le relais. Différents travaux concordent pour affirmer que la voie Wnt est activée dans ces cellules en conditions expérimentales chez la souris [
11–
13] ou au cours d’une hépatite aiguë nécrosante chez l’homme [
14]. La voie Wnt joue probablement un rôle important dans cette réponse régénérative spécifique puisque des souris mutantes dépourvues de β-caténine présentent une diminution significative du nombre de cellules ovales induites à proliférer par un régime ad hoc [11]. De façon troublante, on voit également une accumulation de cellules ovales dans le parenchyme hépatique lorsque différents membres de la cascade Hippo sont délétés, par conséquent en présence d’une accumulation nucléaire de YAP [
15,
16]. La voie Hippo semble donc requise pour maintenir la quiescence et restreindre la prolifération des cellules progénitrices hépatiques [
17]. Qu’en est-il de l’intestin ? YAP ne semble pas vraiment indispensable à l’homéostasie physiologique intestinale adulte. En revanche, il devient essentiel en cas d’agression et donc lorsqu’il est nécessaire de réparer rapidement l’épithélium intestinal [
18]. La perte de Mst1/2, de même que la surexpression ubiquiste d’une protéine YAP mutée, induit l’expansion d’un compartiment de cellules souches indifférenciées ainsi que la perte de cellules sécrétoires de l’intestin grêle et du côlon [
19]. Cependant, dans ce modèle, YAP est également induit dans des cellules non épithéliales et pourrait donc activer l’expression de ligands de l’EGFR (epidermal growth factor receptor) comme l’amphiréguline, nécessaire à la régénération intestinale. Pour tester cette hypothèse, l’équipe de Camargo [
20] a exprimé exclusivement dans l’épithélium intestinal la protéine YAP mutée, qui est localisée essentiellement dans le cytoplasme. Les résultats obtenus sont surprenants. Contre toute attente en effet, quelques jours après l’induction de YAP, l’intestin semble perdre des cryptes en prolifération ce que traduit une diminution de l’expression des cibles de la voie Wnt et des marqueurs de cellules souches comme Lgr5 (leucine-rich repeat-containing G protein-coupled receptor 5) ou Olfm4 (olfactomedin 4). Cette désorganisation provoque la mort de l’animal. La prolifération des cryptes est à nouveau restaurée en présence de R-spondine 1, un puissant agoniste de la voie Wnt. Tout se passe donc ici comme si l’expression de YAP dans les cellules intestinales inhibait le renouvellement des cellules souches en inhibant la voie Wnt (Figure 4). Les auteurs suggèrent que cet effet de YAP sur Wnt ne passe, ni par la séquestration de la β-caténine, ni par l’inhibition de la GSK3β, comme nous l’avons décrit dans le paragraphe précédent. Il s’agirait plutôt d’un nouveau mécanisme par lequel la protéine YAP cytoplasmique inhiberait la translocation nucléaire de la protéine dishevelled (Dvl). Les protéines Dvl relaient en effet le signal Wnt, non seulement au niveau cytoplasmique, mais également en agissant comme coactivateurs dans le noyau [
21] (Figure 3).
 | Figure 4.
Signalisation Wnt et Hippo et cellules souches de la crypte intestinale. A. En conditions normales, les signalisations YAP/TAZ et Wnt sont équilibrées. Les cellules souches intestinales reçoivent une signalisation Wnt, provenant notamment des cellules de Paneth. Les cellules souches prolifèrent et progressent du fond de la crypte vers son sommet tout en se différenciant. YAP est enrichie dans le noyau des cellules souches du fond de la crypte ( crypt base columnar stem cells) et dans le cytoplasme des cellules progénitrices TA ( transit amplifying cells). La protéine YAP est donc plutôt nucléaire dans les zones où la signalisation Wnt est active. B. Si YAP est surexprimée dans le cytoplasme ou si la voie Hippo est induite, la signalisation Wnt est réprimée, la niche des cellules souches intestinales est détruite et les cellules de Paneth migrent vers le sommet de la crypte. Ces perturbations aboutissent finalement à la dégénérescence de l’épithélium intestinal et à la mort de l’animal. A contrario, la perte de YAP induit une hyperplasie et une expansion des cellules intestinales souches avec formation de cryptes ectopiques et de microadénomes (non montrés sur cette figure). (modèle présenté d’après [ 17]). |
|
Hippo et Wnt en cancérologie digestive De l’induction de la prolifération et de l’expansion de cellules souches à l’oncogenèse, il n’y a qu’un pas. L’activation de la voie Wnt par inactivation d’APC (adenomatous polyposis coli) est retrouvée dans environ 80 % des cancers colorectaux (CCR), et une signature Wnt est mise en évidence dans environ un tiers des carcinomes hépatocellulaires (CHC). Par ailleurs, même si des mutations des membres de la cascade Hippo sont rarement retrouvées dans les cancers digestifs chez l’homme, ceux-ci présentent fréquemment une dérégulation de la voie, et la protéine YAP est nucléaire dans environ 80 % des CCR et plus de la moitié des CHC. Dans ce dernier cas, celle-ci est même considérée comme un marqueur indépendant de mauvais pronostic [
22]. Enfin, une duplication de la région 11q22 qui contient le gène YAP est fréquemment retrouvée dans différents cancers, dont le CHC [
23]. Chez le rongeur, rappelons que la délétion de Mst1/2 ou de Merlin/NF2 (neurofibromin 2), située en amont de la cascade chez la drosophile, de même que la surexpression de YAP, sont suffisantes pour induire la tumorigenèse hépatique [
24]. Les mécanismes par lesquels YAP exerce ces propriétés oncogéniques dans le foie ne sont pas encore parfaitement compris. Une hypothèse récente suggère que YAP augmenterait l’expression de Jag-1, activant la voie Notch dans les hépatocytes et les lignées tumorales de CHC, mais de façon indépendante de la β-caténine [
25]. Un mécanisme similaire est également décrit dans l’intestin, puisqu’un inhibiteur de Notch restreint la dysplasie intestinale induite par YAP [18]. Deux publications récentes [
26,
27] montrent qu’un shRNA (short hairpin RNA) dirigé contre YAP dans une panoplie de lignées de CCR inhibe la formation de colonies et la croissance tumorale lorsque ces cellules sont injectées sous la peau. L’administration de petites molécules inhibitrices interrompant l’association YAP/TEAD diminue la tumorigenèse hépatique de souris qui surexpriment YAP ou qui présentent une invalidation de NF2 [27]. Enfin, le travail de Rosenbluh suggère que le complexe β-caténine/YAP1/TBX5 promeut la survie de cellules cancéreuses coliques et contribue à la transformation tumorale. Toute cette littérature souligne donc le potentiel oncogénique de YAP dans l’intestin ou le foie. L’équipe de Camargo fait à nouveau office de trublion, parvenant à la conclusion inverse, à savoir que YAP se comporte dans le côlon comme un gène suppresseur de tumeur [20]. Dans environ 10 % des cancers colorectaux, l’expression de YAP est abolie, ce qui est corrélé à un pronostic plus sombre. Par ailleurs, la surexpression de YAP inhibe la croissance tumorale sous-cutanée de la lignée de cancer colorectal DLD-1. Dans certaines conditions, YAP pourrait-il être un gène suppresseur de tumeur ? Comment réconcilier ces résultats contradictoires ? L’hypothèse évoquée est que tout dépend de la localisation subcellulaire de YAP. Dans le noyau, cette protéine fonctionnerait comme un oncogène en promouvant la prolifération et l’expression de protéines anti-apoptotiques. A contrario, dans le cytoplasme, YAP pourrait restreindre l’activation de la voie Wnt, avec des conséquences antitumorales [
29]. Si une telle proposition était démontrée, YAP deviendrait une cible thérapeutique particulièrement intéressante mais à double tranchant. Comment, en effet, inhiber sélectivement les propriétés oncogéniques de YAP tout en favorisant son effet suppresseur de tumeurs ? Une première réponse a été apportée par l’utilisation d’une petite molécule inhibitrice des kinases de la famille Src, le dasatinib qui agit en inhibant la protéine YES, donc en empêchant la formation du complexe β-caténine/YAP1/TBX5. Il inhibe également la croissance de cancers qui dépendent de l’activation de la β-caténine à la fois dans des lignées cellulaires et des modèles murins [9]. Ce type d’approche sera-t-il également efficace dans des carcinomes épithéliaux présentant une dérégulation de la voie Hippo ? Une autre piste intéressante vient d’être proposée : la protéine Set 7, une lysine méthyl-transférase, interagit avec Yap, induisant sa méthylation qui semble responsable de sa rétention dans le cytoplasme (→).
(→) Voir m/s n° 10, vol. 29, octobre 2013, page 851
Cette protéine pourrait donc être une cible thérapeutique potentielle pour moduler la localisation subcellulaire de Yap [
30]. Les voies Hippo/YAP et Wnt sont tellement intriquées que les publications relatant leur dialogue sont souvent discordantes, obérant le message final. Pour y voir plus clair, il faut prendre en compte le niveau d’activation, le type cellulaire impliqué, la localisation subcellulaire des protéines YAP ou β-caténine et le contexte physiopathologique, ainsi que la participation d’autres molécules interagissant avec les deux voies telles que EGFR, TGF-β (transforming growth factor β) ou Notch. Décidément, comme celui de Garp, le monde selon YAP est peuplé d’acteurs aux multiples facettes ! |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Zeng
Q
,
Hong
W
. The emerging role of Hippo pathway in cell contact inhibition, organ size control, and cancer development in mammals . Cancer Cell.
2008; ; 13 : :188.–192.
2.
Gilgenkrantz
H
. Voie Hippo-YAP et foie : bien plus qu’un simple contrôle de la taille . Med Sci (Paris).
2011; ; 27 : :479.–481.
3.
Kim
NG
,
Koh
E
,
Chen
X
,
Gumbiner
BM
. E cadherin mediates contact inhibition of proliferation through Hippo signaling-pathway component . Proc Natl Acad Sci USA.
2011; ; 108 : :11930.–11935. 4.
Varelas
X
,
Miller
BW
,
Sopko
R
, et al.
The Hippo pathway regulates Wnt/beta-catenin signaling . Dev Cell.
2010; ; 18 : :579.–591. 5.
Imajo
M
,
Miyatake
K
,
Iimura
A
, et al.
A molecular mechanism that links Hippo signalling to the inhibition of Wnt/beta-catenin signalling . EMBO J.
2012; ; 31 : :1109.–1122. 6.
Heallen
T
,
Zhang
M
,
Wang
J
, et al.
Hippo pathway inhibits Wnt signaling to restrain cardiomyocyte proliferation and heart size . Science.
2011; ; 332 : :458.–461. 7.
Azzolin
L
,
Zanconato
F
,
Bresolin
S
, et al.
Role of TAZ as mediator of Wnt signaling . Cell.
2012; ; 151 : :1443.–1456. 8.
Bottomly
D
,
Kyler
SL
,
McWeeney
SK
,
Yochum
GS
. Identification of beta-catenin binding regions in colon cancer cells using ChIP-Seq . Nucleic Acids Res.
2010; ; 38 : :5735.–5745. 9.
Rosenbluh
J
,
Nijhawan
D
,
Cox
AG
, et al.
beta-Catenin-driven cancers require a YAP1 transcriptional complex for survival and tumorigenesis . Cell.
2012; ; 151 : :1457.–1473. 10.
Varelas
X
,
Wrana
JL
. Coordinating developmental signaling: novel roles for the Hippo pathway . Trends Cell Biol.
2012; ; 22 : :88.–96. 11.
Apte
U
,
Thompson
MD
,
Cui
S
, et al.
Wnt/beta-catenin signaling mediates oval cell response in rodents . Hepatology.
2008; ; 47 : :288.–295. 12.
Yang
W
,
Yan
HX
,
Chen
L
, et al.
Wnt/beta-catenin signaling contributes to activation of normal and tumorigenic liver progenitor cells . Cancer Res.
2008; ; 68 : :4287.–4295. 13.
Hu
M
,
Kurobe
M
,
Jeong
YJ
, et al.
Wnt/beta-catenin signaling in murine hepatic transit amplifying progenitor cells . Gastroenterology.
2007; ; 133 : :1579.–1591. 14.
Spee
B
,
Carpino
G
,
Schotanus
BA
, et al.
Characterisation of the liver progenitor cell niche in liver diseases: potential involvement of Wnt and Notch signalling . Gut.
2010; ; 59 : :247.–257. 15.
Song
H
,
Mak
KK
,
Topol
L
, et al.
Mammalian Mst1 and Mst2 kinases play essential roles in organ size control and tumor suppression . Proc Natl Acad Sci USA.
2010; ; 107 : :1431.–1436. 16.
Lee
KP
,
Lee
JH
,
Kim
TS
, et al.
The Hippo-Salvador pathway restrains hepatic oval cell proliferation, liver size, and liver tumorigenesis . Proc Natl Acad Sci USA.
2010; ; 107 : :8248.–8253. 17.
Barry
ER
,
Camargo
FD
. The Hippo superhighway: signaling crossroads converging on the Hippo/Yap pathway in stem cells and development . Curr Opin Cell Biol.
2013; ; 25 : :247.–253. 18.
Cai
J
,
Zhang
N
,
Zheng
Y
, et al.
The Hippo signaling pathway restricts the oncogenic potential of an intestinal regeneration program . Genes Dev.
2010; ; 24 : :2383.–2388. 19.
Camargo
FD
,
Gokhale
S
,
Johnnidis
JB
, et al.
YAP1 increases organ size and expands undifferentiated progenitor cells . Curr Biol.
2007; ; 17 : :2054.–2060. 20.
Barry
ER
,
Morikawa
T
,
Butler
BL
, et al.
Restriction of intestinal stem cell expansion and the regenerative response by YAP . Nature.
2013; ; 493 : :106.–110. 21.
Itoh
K
,
Brott
BK
,
Bae
GU
, et al.
Nuclear localization is required for Dishevelled function in Wnt/beta-catenin signaling . J Biol.
2005; ; 4 : :3.. 22.
Xu
MZ
,
Yao
TJ
,
Lee
NP
, et al.
Yes-associated protein is an independent prognostic marker in hepatocellular carcinoma . Cancer.
2009; ; 115 : :4576.–4585. 23.
Zender
L
,
Spector
MS
,
Xue
W
, et al.
Identification and validation of oncogenes in liver cancer using an integrative oncogenomic approach . Cell.
2006; ; 125 : :1253.–1267. 24.
Benhamouche
S
,
Curto
M
,
Saotome
I
, et al.
Nf2/Merlin controls progenitor homeostasis and tumorigenesis in the liver . Genes Dev.
2010; ; 24 : :1718.–1730. 25.
Tschaharganeh
DJ
,
Chen
X
,
Latzko
P
, et al.
Yes-associated protein upregulates jagged-1 and activates the Notch pathway in human hepatocellular carcinoma . Gastroenterology.
2013; ; 144 : :1530.–1542. 26.
Zhou
D
,
Zhang
Y
,
Wu
H
, et al.
Mst1 and Mst2 protein kinases restrain intestinal stem cell proliferation and colonic tumorigenesis by inhibition of Yes-associated protein (Yap) overabundance . Proc Natl Acad Sci USA.
2011; ; 108 : :E1312.–E1320. 27.
Konsavage
WM, Jr
,
Kyler
SL
,
Rennoll
SA
, et al.
Wnt/beta-catenin signaling regulates Yes-associated protein (YAP) gene expression in colorectal carcinoma cells . J Biol Chem.
2012; ; 287 : :11730.–11739. 28.
Liu-Chittenden
Y
,
Huang
B
,
Shim
JS
, et al.
Genetic and pharmacological disruption of the TEAD-YAP complex suppresses the oncogenic activity of YAP . Genes Dev.
2012; ; 26 : :1300.–1305. 29.
Vermeulen
L
. Keeping stem cells in check: a hippo balancing act . Cell Stem Cell.
2013; ; 12 : :3.–5. 30.
Oudhoff
J
,
Freeman
SA
,
Couzens
AL
, et al.
Control of the Hippo pathway by Set7-dependent methylation of Yap . Dev Cell.
2013; ; 26 : :188.–194. |