| |
| Med Sci (Paris). 2013 October; 29(10): 839–842. Published online 2013 October 18. doi: 10.1051/medsci/20132910009.Régulation de l’autophagie par la leucine Sur la piste de la glutamate déshydrogénase Séverine Lorin1* 1EA4530, faculté de pharmacie, université Paris-Sud, 5, rue Jean-Baptiste Clément, 92290Châtenay-Malabry, France MeSH keywords: Autophagie, physiologie, Glutamate dehydrogenase, métabolisme, Glutamine, Humains, Leucine, Modèles biologiques, Complexes multiprotéiques, Tumeurs, Espèces réactives de l'oxygène, Transduction du signal, Sérine-thréonine kinases TOR |
Aperçu du rôle de l’autophagie et de sa régulation La (macro)autophagie est la voie principale de dégradation du matériel cytoplasmique intracellulaire [
1]. Ce processus, sous le contrôle des gènes de la famille ATG (autophagy-related gene), conduit à la formation de vacuoles appelées autophagosomes qui séquestrent du matériel cytoplasmique, puis fusionnent avec les lysosomes pour dégrader leur contenu et le recycler (Figure 1). Au niveau basal, l’autophagie est un mécanisme clé qui permet la dégradation de protéines et d’organites excédentaires ou endommagés, afin d’assurer un contrôle de qualité du cytoplasme et de contribuer à l’homéostasie cellulaire. Mais l’autophagie peut aussi être stimulée en conditions de stress métabolique pour fournir les nutriments et l’énergie nécessaires à la survie cellulaire.
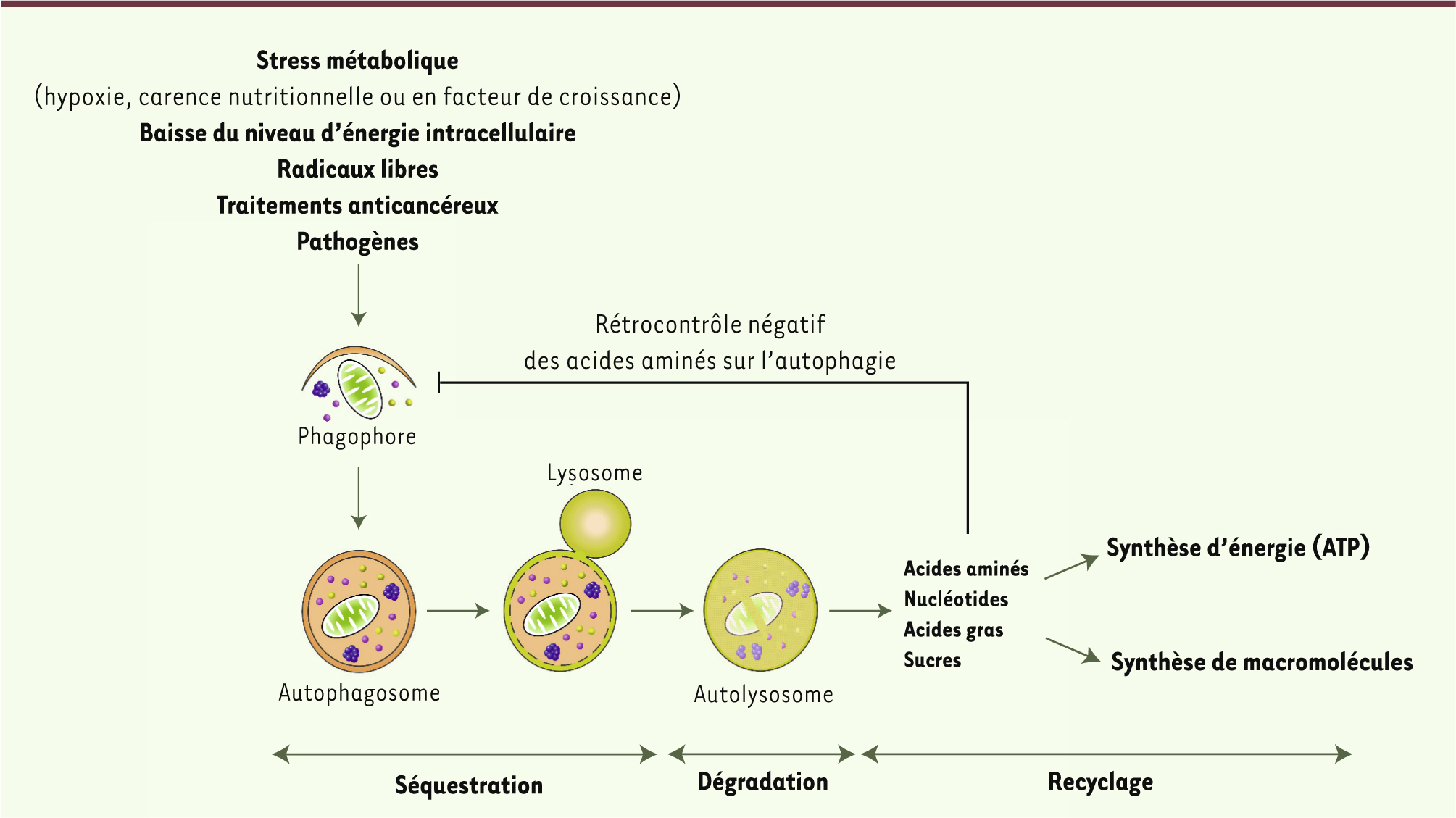
 | Figure 1.
Schéma simplifié du processus d’autophagie. L’autophagie (ou plus précisément la macroautophagie) existe dans l’ensemble des cellules à un niveau basal, permettant ainsi de maintenir l’homéostasie cellulaire. Mais l’autophagie peut aussi être induite par de multiples stimulus comme un stress métabolique, une baisse du niveau d’énergie intracellulaire, les radicaux libres, les traitements anticancéreux, la présence de pathogènes, etc. La première étape du processus d’autophagie est la formation d’une petite membrane dans le cytosol, appelée phagophore. Cette membrane s’allonge, séquestre le matériel cytoplasmique à dégrader (macromolécules, agrégats protéiques, organites cellulaires), puis se referme pour former une vésicule à double membrane : l’autophagosome. Après fusion avec le lysosome, le contenu de l’autophagosome est dégradé par les hydrolases lysosomales. Les produits de dégradation résultants (acides aminés, nucléotides, acides gras, sucres) sont exportés dans le cytosol où ils sont utilisés pour la synthèse d’énergie sous forme d’ATP et/ou pour la synthèse de nouvelles macromolécules. Tout ceci permet à la cellule de s’adapter et de survivre en conditions de stress, comme la carence nutrionnelle. Les acides aminés résultant de la protéolyse autophagique exercent un rétrocontrôle négatif sur l’autophagie, afin d’éviter tout emballement incontrôlé de ce processus qui serait potentiellement dangereux. |
Ainsi, en conditions de carence nutritionnelle, les acides aminés produits par la protéolyse autophagique sont recyclés, permettant la production d’ATP afin d’assurer la survie cellulaire. Mais ces acides aminés exercent aussi un rétrocontrôle négatif sur l’autophagie, évitant tout emballement délétère de la machinerie autophagique. Outre les acides aminés, l’autophagie est régulée par différents paramètres cellulaires comme le niveau d’énergie, de facteurs de croissance ou de radicaux libres. La plupart de ces signaux convergent vers un acteur central de la régulation de l’autophagie, le complexe MTORC1 (mechanistic target of rapamycin complex 1), constitué de la kinase à sérine thréonine MTOR et de divers partenaires protéiques. Pour être actif, ce complexe doit se localiser à la surface du lysosome où se trouve son coactivateur Rheb (Ras homolog enriched in brain)-GTP, et ce processus est étroitement régulé par les GTPases Rag (Ras-related GTPases) (Figure 2). Une fois activé, le complexe MTORC1 inhibe l’autophagie et augmente la synthèse protéique et la croissance cellulaire.
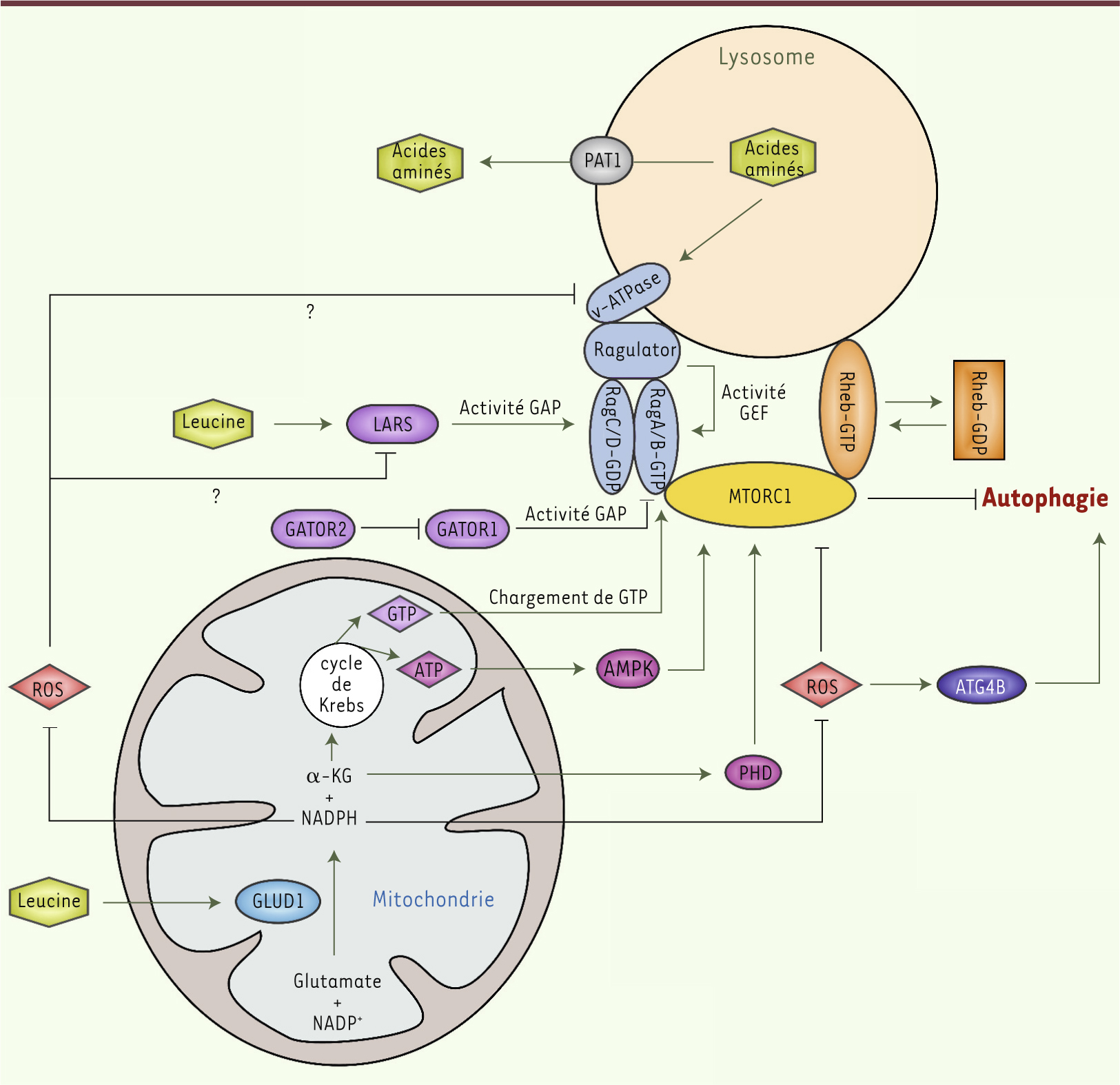
 | Figure 2.
Mécanismes de régulation de l’autophagie par la leucine. Les acides aminés, et en particulier la leucine, contrôlent étroitement l’autophagie. Parmi les senseurs moléculaires capables d’évaluer le taux de leucine intracellulaire et d’inhiber l’autophagie, la glutamate déshydrogénase (GLUD1) pourrait jouer un rôle central. La réaction catalysée par cette enzyme mitochondriale activée par la leucine génère deux produits qui semblent contribuer à l’inhibition de l’autophagie. Le premier, l’α-KG, régule l’autophagie en activant MTORC1 de façons multiples. Tout d’abord, l’α-KG stimule le chargement du GTP sur l’une des sous-unités de Rag (GTP qui pourrait être produit suite à la « métabolisation » de l’α-KG par le cycle de Krebs). Les GTPases de la famille Rag sont des hétérodimères constitués de deux sous-unités RagA/B et RagC/D, où la sous-unité RagA/B doit être liée au GTP et la sous-unité RagC/D doit être liée au GDP pour que le dimère soit actif. Rag contrôle le recrutement du complexe MTORC1 à la surface lysosomale, à proximité de son co-activateur Rheb-GTP. Cette étape est indispensable pour permettre l’activation de MTORC1 et l’inhibition de l’autophagie. Le GTP issu de la transformation de l’α-KG pourrait aussi être utilisé pour favoriser la liaison de Rheb au GTP, ce qui induit un changement de sa conformation et permet son ancrage dans la membrane lysosomale. Par ailleurs, l’α-KG métabolisé par le cycle de Krebs pourrait augmenter le taux d’ATP intracellulaire, ce qui inhibe l’AMPK et active MTORC1. Enfin, l’α-KG stimule MTORC1 via l’activation des prolyl-hydroxylases (PHD). Le NADPH produit par la réaction catalysée par GLUD1 pourrait aussi contribuer à l’inhibition de l’autophagie. En effet, les radicaux libres (ROS) sont des activateurs bien connus de l’autophagie. Ils agissent de façon dépendante ou indépendante de MTORC1 (via l’oxydation d’ATG4B). Le NADPH étant un puissant anti-oxydant, il pourrait contribuer à diminuer le taux de ROS intracellulaires et ainsi inhiber l’autophagie. Une hypothèse intéressante pour expliquer le contrôle de l’autophagie par les ROS de manière dépendante de MTORC1 est d’envisager que la leucyl-ARNt synthétase (LARS) et/ou la v-ATPase soient régulées par les ROS. Ces deux protéines inhibent l’autophagie via MTORC1 en réponse, respectivement, au taux de leucine intracellulaire et au taux d’acides aminés intralysosomal. Lorsqu’elle se lie à la leucine, la LARS devient une GAP (GTPase activating protein) vis-à-vis de la sous-unité RagC/D, ce qui permet à Rag d’acquérir sa conformation active. En présence d’une forte concentration en acides aminés dans la lumière lysosomale, la v-ATPase change de conformation et recrute Ragulator. Ragulator permet à la fois l’ancrage de Rag à la surface du lysosome et son activation en jouant le rôle de GEF (GTP exchange factor) envers la sous-unité RagA/B. Si la LARS et la v-ATPase sont régulées par les ROS, ceci placerait GLUD1 est amont de ces deux mécanismes d’inhibition de l’autophagie en réponse au taux d’acides aminés et de leucine intracellulaire. Cependant, ces différents partenaires pourraient aussi agir en parallèle les uns des autres. Très récemment, il a été montré que l’activité de Rag est aussi contrôlée par deux complexes, GATOR1 et GATOR2. En absence d’acides aminés, GATOR1 agit comme une GAP envers RagA/B et permet l’hydrolyse du GTP, ce qui rend Rag inactif et induit l’autophagie. GATOR1 est lui-même inhibé par GATOR2. Cependant, le mécanisme précis de régulation de ces complexes par les acides aminés reste inconnu à ce jour. |
|
À la recherche du senseur intracellulaire des acides aminés régulant l’autophagie : la glutamate déshydrogénase Depuis la découverte du contrôle de l’autophagie par les acides aminés dans les années 1980, la nature du senseur intracellulaire responsable de cette régulation est restée une énigme. Parmi l’ensemble des acides aminés, la leucine (et non la valine et l’isoleucine, autres acides aminés branchés) semble avoir une place particulière puisque c’est elle qui inhibe le plus efficacement l’autophagie, notamment via l’activation de MTORC1. Par ailleurs, des analogues non métabolisables sont capables de reproduire ses effets, suggérant que la leucine n’a pas besoin d’être métabolisée pour inhiber l’autophagie. Tout mécanisme envisagé dans la recherche de ce fameux senseur intracellulaire devait donc prendre en compte cette haute spécificité de la leucine dans la régulation de l’autophagie par les acides aminés. Plusieurs arguments nous ont conduits à envisager l’implication de la glutamate déshydrogénase GLUD1 dans ce mécanisme. GLUD1 est une enzyme centrale du métabolisme des acides aminés, responsable de la déshydrogénation du glutamate en α-cétoglutarate (α-KG) dans la mitochondrie. De façon intéressante, la leucine est un activateur allostérique de cette enzyme [
2]. Par ailleurs, l’ajout de glutamine (un donneur de glutamate) et de leucine conduit à l’augmentation du flux métabolique à travers la réaction catalysée par GLUD1, à l’activation de MTORC1 et à l’inhibition de l’autophagie [
3]. Sur la base de ces observations, nous avons décidé d’étudier plus avant le rôle de GLUD1. Nous avons ainsi montré que GLUD1 constitue bien ce senseur moléculaire du taux de leucine intracellulaire régulant l’autophagie, GLUD1 étant indispensable pour inhiber l’autophagie en présence de leucine [
4]. Les mécanismes moléculaires mis en jeu dans cette régulation sont de deux types (Figure 2). D’une part, GLUD1 contrôle le taux de radicaux libres (ROS), des activateurs bien connus de l’autophagie. Produits majoritairement au niveau de la chaîne respiratoire mitochondriale, ils permettent l’induction de l’autophagie par la carence nutritionnelle en augmentant l’état d’oxydoréduction d’ATG4B, une protéine impliquée dans la formation des autophagosomes [
5]. Lors de la déshydrogénation du glutamate en α-KG, GLUD1 génère un puissant anti-oxydant, le NADPH, qui pourrait être utilisé pour diminuer le taux de ROS via le système glutathion/glutathion réductase et/ou limiter la production de ROS au niveau du complexe I de la chaîne respiratoire mitochondriale (via la Nnt [nicotinamide nucleotide transhydrogenase]) [
6]. D’autre part, GLUD1 contrôle l’autophagie en activant MTORC1 par divers mécanismes impliquant l’α-KG (Figure 2). En effet, après « métabolisation » par le cycle de Krebs, l’α-KG libère du GTP et de l’ATP. Le GTP est utilisé pour activer Rag [
7], mais il est aussi utilisé pour activer Rheb, tandis que l’ATP inhibe l’AMPK (AMP kinase). L’α-KG stimule aussi MTORC1 par l’activation des prolyl hydroxylases (PHD) [
8]. |
Autres mécanismes mis en évidence Parallèlement à ce travail, deux autres mécanismes permettant de réguler l’autophagie en réponse au taux d’acides aminés disponibles ont été mis en évidence. Le premier met en jeu la v-ATPase du lysosome, organite où s’effectue l’étape ultime de la protéolyse autophagique [
9]. Impliquée dans le pompage des protons H+ à travers la membrane lysosomale, cette enzyme agit comme un senseur de la concentration intralysosomale en acides aminés et régule l’activité de MTORC1 (Figure 2). En effet, suite à l’augmentation de la concentration en acides aminés dans la lumière du lysosome, la v-ATPase change de conformation et recrute Ragulator à la surface du lysosome. Cette protéine, en jouant le rôle de GEF (GTP exchange factor) envers l’une des sous-unités de la GTPase Rag, permet son ancrage au lysosome, le recrutement consécutif de MTORC1 et l’inhibition de l’autophagie. Le second mécanisme implique la leucyl-ARNt synthétase (LARS) (Figure 2) [
10]. Connue pour être impliquée dans le chargement de la leucine sur l’ARNt correspondant, cette enzyme peut aussi jouer le rôle de senseur du taux de leucine cytosolique. En effet, la liaison de la leucine à LARS lui confère une nouvelle propriété : elle devient une GAP (GTPase activating protein) de la GTPase Rag, permettant l’hydrolyse du GTP sur l’une de ses sous-unités et son activation. Comme précédemment, Rag conduit à l’activation du complexe MTORC1 et à l’inhibition de l’autophagie. |
À l’heure actuelle, trois mécanismes ont été identifiés comme impliqués dans la régulation de l’autophagie en réponse au taux d’acides aminés intracellulaires : tous trois conduisent à l’activation de MTORC1 et deux d’entre eux ciblent spécifiquement la leucine. L’une des questions intéressantes à explorer est maintenant de déterminer comment ces différents mécanismes s’organisent les uns par rapport aux autres : sont-ils indépendants ou bien sont-ils reliés ? Il est notamment possible d’envisager que la v-ATPase et/ou LARS soient inhibées par les ROS, ce qui situerait GLUD1 en amont de ces deux voies de régulation, le NAPDH produit par GLUD1 (après exportation de la mitochondrie par la navette isocitrate/α-KG) pouvant diminuer leur taux d’oxydation (Figure 2). Tous ces travaux mettent en évidence un lien étroit entre métabolisme cellulaire et signalisation, et ouvrent la porte à de nouvelles perspectives thérapeutiques. En effet, MTORC1 est surexprimé dans de nombreux cancers, et les cellules cancéreuses sont extrêmement dépendantes de la glutamine, bien au-delà de leurs besoins énergétiques. Dans les cellules cancéreuses, la glutamine (transformée en glutamate, puis en α-KG et NADPH par la glutaminolyse) permettrait une activation optimale de MTORC1 dans le but d’assurer une croissance tumorale soutenue. En parallèle, l’inhibition de l’autophagie par MTORC1 éviterait toute surproduction inutile d’énergie [8]. Ainsi, cibler l’inhibition de MTORC1 par la rapamycine et/ou la glutaminolyse pourrait être une stratégie anticancéreuse prometteuse. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ce travail a été soutenu financièrement par l’Inserm. Je tiens tout particulièrement à remercier P. Codogno et A.J. Meijer, à qui revient la paternité de ce projet, pour leur soutien et leurs conseils tout au long de ce travail.
|
1.
Meijer
AJ
,
Codogno
P
. Autophagy: regulation and role in disease . Crit Rev Clin Lab Sci.
2009; ; 46 : :210.–240.
2.
Fahien
LA
,
Teller
JK
,
Macdonald
MJ
, et al.
Regulation of glutamate dehydrogenase by Mg2+ and magnification of leucine activation by Mg2+
. Mol Pharmacol.
1990; ; 37 : :943.–949. 3.
Caro
LH
,
Plomp
PJ
,
Leverve
XM
, et al.
A combination of intracellular leucine with either glutamate or aspartate inhibits autophagic proteolysis in isolated rat hepatocytes . Eur J Biochem.
1989; ; 181 : :717.–720.
4.
Lorin
S
,
Tol
MJ
,
Bauvy
C
, et al.
Glutamate dehydrogenase contributes to leucine sensing in the regulation of autophagy . Autophagy.
2013; ; 9 : :850.–860. 5.
Scherz-Shouval
R
,
Shvets
E
,
Fass
E
, et al.
Reactive oxygen species are essential for autophagy and specifically regulate the activity of Atg4 . EMBO J.
2007; ; 26 : :1749.–1760. 6.
Albracht
SP
,
Meijer
AJ
,
Rydstrom
J
. Mammalian NADH:ubiquinone oxidoreductase (complex I) and nicotinamide nucleotide transhydrogenase (Nnt) together regulate the mitochondrial production of HO-implications for their role in disease, especially cancer . J Bioenerg Biomembr.
2011; ; 43 : :541.–564. 7.
Duran
RV
,
Oppliger
W
,
Robitaille
AM
, et al.
Glutaminolysis activates Rag-mTORC1 signaling . Mol Cell.
2012; ; 47 : :349.–358. 8.
Duran
RV
,
Hall
MN
. Glutaminolysis feeds mTORC1 . Cell Cycle.
2012; ; 11 : :1.–2. 9.
Zoncu
R
,
Bar-Peled
L
,
Efeyan
A
,
Wang
S
, et al.
mTORC1 senses lysosomal amino acids through an inside-out mechanism that requires the vacuolar H-ATPase . Science.
2011; ; 334 : :678.–683.
10.
Han
JM
,
Jeong
SJ
,
Park
MC
, et al.
Leucyl-tRNA Synthetase is an intracellular leucine sensor for the mTORC1-signaling pathway . Cell.
2012; ; 149 : :410.–424.
|