| |
| Med Sci (Paris). 2013 October; 29(10): 831–833. Published online 2013 October 18. doi: 10.1051/medsci/20132910006.Le déséquilibre élastase/α1-antitrypsine Un nouvel acteur dans le processus d’obésité et de son syndrome métabolique Virginie Mansuy-Aubert1* 1University of Texas, Southwestern medical center, 5323 Harry Hines Blvd, Dallas, TX75390, États-Unis MeSH keywords: Animaux, Régime athérogène, Matières grasses alimentaires, pharmacologie, Humains, Leukocyte elastase, sang, métabolisme, Syndrome métabolique X, génétique, Souris, Souris obèse, Souris transgéniques, Obésité, alpha-1-Antitrypsine |
Syndrome métabolique et trouble de l’inflammation adipocytaire Aux États-Unis, mais aussi maintenant en Europe, les nombres d’adultes et d’enfants obèses augmentent considérablement chaque année. Cette obésité entraîne une pathologie multifactorielle appelée syndrome métabolique. Ce dernier est défini par la présence d’un diabète de type 2, d’une vulnérabilité cardiovasculaire, d’un risque augmenté d’accident vasculaire cérébral, de dépression, et probablement de cancers [
1–
3]1. De plus, les personnes atteintes sont plus sensibles aux allergies et ont des troubles de la fertilité. L’obésité est sans aucun doute un problème de santé publique d’enjeu mondial [
14], qui invite le chercheur et le médecin à mieux comprendre son mécanisme pour mieux la combattre et surtout la prévenir. Ces dernières années, nombres d’études ont pointé du doigt une association entre syndrome métabolique et processus inflammatoire [
4–
7]. En effet, la prise de poids s’accompagne d’une inflammation des tissus et, plus particulièrement, du tissu adipeux blanc [
6,
8–
10,
15]. Cette inflammation entraîne une production importante de facteurs pro-inflammatoires comme le TNF-α (tumor necrosis factor-α), le MCP1 (monocyte chemotactic protein 1) et une diminution des adipokines anti-inflammatoires, par exemple l’adiponectine. Cette inflammation se manifeste aussi par une infiltration de ce tissu par des polynucléaires neutrophiles, des macrophages et des lymphocytes [
11,
12]. Toutefois, bien que son importance dans le processus d’obésité ne fasse plus aucun doute, les mécanismes de mise en place de cette inflammation restent encore mal définis. |
Variation des taux sanguins d’élastase et d’α1-antitrypsine au cours de l’obésité Dans une étude publiée dans Cell Metabolism [
13], nous avons mis en évidence qu’un déséquilibre entre l’élastase, une enzyme pro-inflammatoire sécrétée par les neutrophiles, et son inhibiteur physiologique l’α1-antitrypsine (A1AT), pourrait être responsable de la prise de poids et des états d’inflammation et de résistance à l’insuline chez des souris, mais aussi chez l’homme. Cette étude débute par la comparaison à grande échelle des protéines contenues dans le sérum de souris rendues génétiquement obèses (souris Ob/Ob) et de souris normales. De façon surprenante, le taux d’α1-antitrypsine dans le sang des souris obèses est six fois inférieur à la normale. Cette enzyme est un inhibiteur de protéases produite et sécrétée par le foie, dont le rôle est de protéger les tissus de l’action protéolytique de l’élastase lors du processus d’inflammation. En effet, lors d’une infection bactérienne, l’élastase dégrade l’élastine des membranes bactériennes, mais aussi celle des tissus de l’organisme si son activité n’est pas régulée par l’α1-antitrypsine. Trouver le complexe A1AT/élastase impliqué dans le processus d’obésité chez la souris est quelque peu surprenant. Et le fait que ce même déséquilibre A1AT/élastase soit observé dans des échantillons de sang de patients obèses a suscité un intérêt certain. En effet, la concentration d’α1-antitrypsine se trouve être proportionnelle à l’indice de masse corporelle, et l’inverse est observé pour l’activité de l’élastase chez l’homme. Afin de valider et mieux comprendre cette curieuse relation entre élastase/A1AT et obésité, deux modèles murins ont été utilisés : la souris Ela-/-
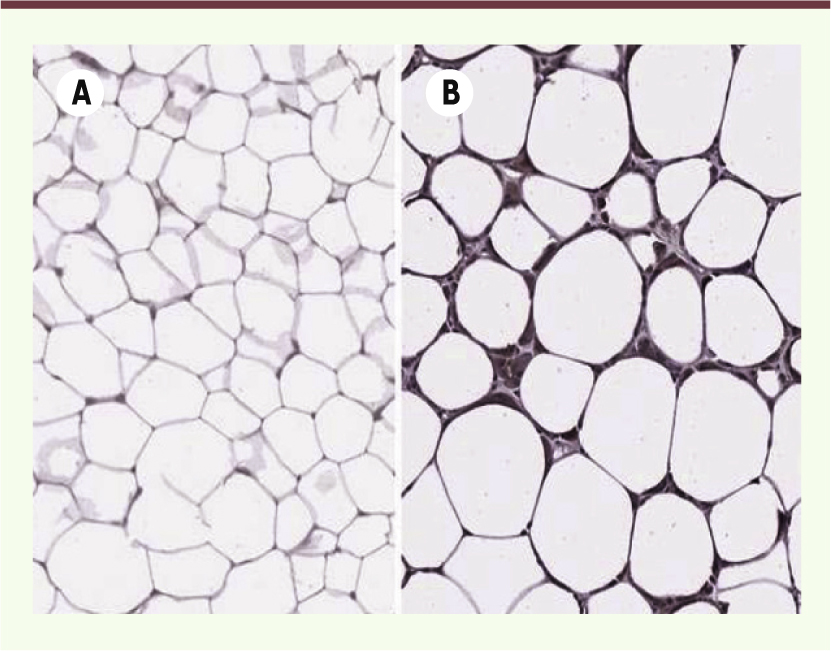
n’exprimant pas l’élastase et la souris transgénique surexprimant A1AT. Ces deux modèles de souris se sont avérés être insensibles à tout type de régime riche en graisse. De plus, ces souris ne développent ni insulinorésistance ni stéatose hépatique comme le font les souris contrôles nourries avec le même régime riche en graisse, et leur tissu adipeux est peu enflammé (Figure 1). Cette observation valide nos conclusions sur le rôle du duo élastase/A1AT dans l’obésité.
 | Figure 1.
Détection de l’élastase dans le tissu adipeux de souris contrôle et obèse. A. Tissu adipeux d’une souris contrôle (mince) chez laquelle le rapport plasmatique élastase/α1-antitrypsine est équilibré. B. Tissu adipeux d’une souris obèse chez laquelle le rapport plasmatique élastase/α1-antitrypsine est affecté. Les zones violacées représentent un marquage de l’élastase et des macrophages. |
|
Diminution du taux d’α1-antitrypsine au cours d’un régime riche en graisse Dans cette étude, la régulation du gène codant pour l’α1-antitrypsine a été caractérisée in vivo et in vitro en utilisant des cultures primaires d’hépatocytes. Nous avons mis en évidence que la leptine, une cytokine sécrétée par le tissu adipeux, régule l’expression de l’α1-antitrypsine. Cette découverte explique l’augmentation de l’activité de l’élastase chez des patients obèses résistants, par définition, à la leptine. D’autres hypothèses sont en voie d’investigation dans différents laboratoires. |
Mécanisme d’action de l’élastase et l’α1-antitrypsine sur la prise de poids et le métabolisme Les mécanismes d’action intimes de l’élastase et de l’α1-antitrypsine commencent à être décryptés. En effet, la caractérisation des deux modèles de souris - Ela-/-
et transgéniques pour l’α1-antitrypsine - montre que leur dépense énergétique est supérieure à celle de souris contrôles. L’étude détaillée des tissus de ces souris a permis de montrer que l’absence d’élastase ne s’accompagnait d’aucun processus d’inflammation dans les tissus adipeux blanc et brun. Aussi, bloquer l’augmentation de l’activité de l’élastase (qui survient normalement durant un régime riche en graisse) préserve l’activité de facteurs métaboliques clés, y compris l’adiponectine, l’AMPK (AMP kinase) et diverses protéines impliquées dans l’oxydation des acides gras. Le résultat global pour l’organisme est une dépense énergétique accrue favorisant l’élimination des excès de graisse par thermogenèse. En conclusion, l’ensemble des résultats de cette étude ont identifié un rôle dans l’obésité pour deux enzymes, l’élastase et l’α1-antitrypsine, facilement accessibles puisque circulantes, et qui pourraient représenter de nouvelles cibles dans la lutte contre l’obésité et le syndrome métabolique qui lui est associé. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Davis
TM
,
Ee
CK
. Obesity and the metabolic syndrome in children and adolescents . N Engl J Med.
2004; ; 351 : :1146.–1148.
2.
Prasad
H
,
Ryan
DA
,
Celzo
MF
,
Stapleton
D
. Metabolic syndrome: definition and therapeutic implications . Postgrad Med.
2012; ; 124 : :21.–30. 3.
Grundy
SM
,
Brewer
HB, Jr
,
Cleeman
JI
, et al.
Definition of metabolic syndrome: report of the National heart, lung, and blood institute/American heart association conference on scientific issues related to definition . Arterioscler Thromb Vasc Biol.
2004; ; 24 : :e13.–e18. 4.
Johnson
AM
,
Olefsky
JM
. The origins and drivers of insulin resistance . Cell.
2013; ; 152 : :673.–684. 5.
Glass
CK
,
Olefsky
JM
. Inflammation and lipid signaling in the etiology of insulin resistance . Cell Metab.
2012; ; 15 : :635.–645. 6.
Olefsky
JM
,
Glass
CK
. Macrophages, inflammation, and insulin resistance . Ann Rev Physiol.
2010; ; 72 : :219.–246. 7.
Lu
M
,
Patsouris
D
,
Li
P
, et al.
A new antidiabetic compound attenuates inflammation and insulin resistance in Zucker diabetic fatty rats . Am J Physiol Endocrinol Metab.
2010; ; 298 : :E1036.–E1048. 8.
Jiao
J
,
Bae
EJ
,
Bandyopadhyay
G
, et al.
Restoration of euglycemia after duodenal bypass surgery is reliant on central and peripheral inputs in Zucker fa/fa rats . Diabetes.
2013; ; 62 : :1074.–1083. 9.
Oh
DY
,
Morinaga
H
,
Talukdar
S
, et al.
Increased macrophage migration into adipose tissue in obese mice . Diabetes.
2012; ; 61 : :346.–354. 10.
Osborn
O
,
Sears
DD
,
Olefsky
JM
. Fat-induced inflammation unchecked . Cell Metab.
2010; ; 12 : :553.–554. 11.
Chatzigeorgiou
A
,
Karalis
KP
,
Bornstein
SR
,
Chavakis
T
. Lymphocytes in obesity-related adipose tissue inflammation . Diabetologia.
2012; ; 55 : :2583.–2592. 12.
Luciani
A
,
Dechoux
S
,
Deveaux
V
, et al.
Adipose tissue macrophages: MR tracking to monitor obesity-associated inflammation . Radiology.
2012; ; 263 : :786.–793. 13.
Mansuy-Aubert
V
,
Zhou
QL
,
Xie
X
, et al.
Imbalance between neutrophil elastase and its inhibitor alpha1-antitrypsin in obesity alters insulin sensitivity, inflammation, and energy expenditure . Cell Metab.
2013; ; 17 : :534.–548. 14.
Franc
C
. Le diabète : des chiffres alarmants . Med Sci (Paris).
2013; ; 29 : :711.–714. 15.
Carrière
A
,
Jeanson
Y
.,
Cousin
B
.,
Arnaud
E
.,
Casteilla
L
. Le recrutement et l’activation d’adipocytes bruns et/ou BRITE : une perspective réelle pour le traitement des maladies métaboliques ?
Med Sci (Paris).
2013; ; 29 : :729.–735.
|