| |
| Med Sci (Paris). 2013 October; 29(10): 823–825. Published online 2013 October 18. doi: 10.1051/medsci/20132910003.Inflammation et dysplasie bronchopulmonaire Emmanuel Lopez1* and Pierre-Henri Jarreau1 1Service de médecine et réanimation néonatales de Port-Royal, Hôpital Cochin, 53, avenue de l’Observatoire, 75014Paris, France; Inserm U767, Fondation PremUP, Paris, France MeSH keywords: Animaux, Dysplasie bronchopulmonaire, complications, étiologie, immunologie, microbiologie, Chorioamniotite, métabolisme, Femelle, Humains, Nouveau-né, Maladies du prématuré, Inflammation, épidémiologie, Poumon, embryologie, croissance et développement, Méta-analyse comme sujet, Grossesse, Infections à Ureaplasma, Ureaplasma urealyticum, isolement et purification |
La dysplasie bronchopulmonaire (DBP) est la conséquence d’agressions pulmonaires multiples sur un poumon en développement [
1,
2] (→).
(→) Voir les Nouvelles de A. Hadchouel et C. Delacourt, E. Zana-Taïeb et P.H. Jarreau, pages 821 et 826 de ce numéro
La présence d’une réponse inflammatoire dans les voies aériennes est constante au cours de la DBP et apparaît comme une voie finale commune aux différents facteurs de risque [
3–
6]. En anténatal, une chorioamniotite (CA) - qui est une inflammation du placenta et des membranes généralement due à une infection et fréquemment en cause dans les naissances prématurées - puis, en postnatal, la toxicité de l’oxygène, la ventilation mécanique et l’infection, entraînent une réponse inflammatoire pulmonaire responsable d’une inhibition de l’alvéolisation et de l’angiogenèse dans le poumon immature du nouveau-né prématuré (Figure 1).
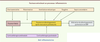 | Figure 1.
Événements pro-inflammatoires et anti-inflammatoires influençant le développement pulmonaire (d’après [ 6]). |
|
Effets de l’inflammation anténatale sur le développement pulmonaire De nombreuses études ont recherché une association entre chorioamniotite et DBP, mais les résultats sont contradictoires. Des modèles animaux de chorioamniotite ont permis d’étudier les effets d’une inflammation anténatale sur le poumon fœtal. L’injection intraamniotique de lipopolysaccharide (LPS) d’Escherichia coli chez la brebis gestante entraîne un afflux de cellules inflammatoires et une production de cytokines pro-inflammatoires dans le chorion et le liquide amniotique, caractérisant la chorioamniotite. Cette réponse inflammatoire est également présente dans le poumon fœtal ; elle y est associée à une diminution de la septation alvéolaire (qui aboutit à la production de nouvelles alvéoles) et de la microvascularisation pulmonaire qui est intimement liée à l’alvéolisation [6]. De manière apparemment paradoxale, il existe une accélération de la maturation pulmonaire précoce indiquée par une augmentation de la sécrétion du surfactant pulmonaire [
7]. On retrouve ce double effet de la chorioamniotite chez la souris gestante : l’injection intraamniotique de LPS induit une activation des macrophages alvéolaires qui inhibent le développement pulmonaire fœtal [
8], mais il existe une accélération de la maturation des pneumocytes de type II [
9]. Ainsi, dans ces modèles animaux, une chorioamniotite accélère la maturation des pneumocytes II, favorisant l’adaptation à la vie aérienne, mais a pour conséquences de compromettre l’alvéolisation ultérieure. Chez le nouveau-né prématuré humain, une méta-analyse récente [
10] regroupant 59 études et 15 295 patients a étudié l’association entre chorioamniotite et DBP. Chorioamniotite et DBP étaient significativement associées, mais avec une hétérogénéité substantielle qu’expliquent : (1) les différences de définition clinique ou histologique de la chorioamniotite dans les études utilisées pour la méta-analyse ; (2) l’influence de l’âge gestationnel et du poids de naissance, les enfants exposés à une chorioamniotite étant d’âge gestationnel plus faible et de plus petit poids. Après ajustement sur ces facteurs, l’OR (odds ratio) était de 1,58 [95 % IC 1,11 à 2,24]. |
Effets de l’inflammation postnatale sur le développement pulmonaire En période postnatale, plusieurs facteurs contribuent à la genèse d’une inflammation du poumon du prématuré, en particulier : la ventilation, l’oxygène et l’infection. Dans les modèles expérimentaux, chacun de ces facteurs est susceptible de créer localement une inflammation et de compromettre l’alvéolisation. Chez le nouveau-né prématuré humain ces facteurs sont constamment présents. Chez l’agneau prématuré, la ventilation mécanique induit le recrutement et l’activation de cellules inflammatoires et l’augmentation de l’expression de cytokines pro-inflammatoires (IL[interleukine]-1β, IL-6 et IL-8), malgré une optimisation de la prise en charge respiratoire visant à limiter l’agression pulmonaire [
11]. En cas d’exposition à une chorioamniotite, le poumon du nouveau-né humain est déjà le siège d’une réponse inflammatoire, qui est amplifiée par la ventilation mécanique. Il en résulte une production accrue de cytokines pro-inflammatoires qui sont libérées dans la circulation systémique. Enfin, l’analyse des aspirations trachéales d’enfants prématurés ventilés révèle une augmentation des leucocytes, de cytokines pro-inflammatoires (TNF [tumour necrosis factor]-α, IL-1 et IL-6), de leucotriènes et d’autres médiateurs de l’inflammation [
5], et les enfants dont les aspirations trachéales présentent des indicateurs d’inflammation élevés évoluent vers une DBP. L’hyperoxie constitue également un stimulus pro-inflammatoire (afflux de polynucléaires neutrophiles dans les alvéoles pulmonaires) et est responsable d’un arrêt du développement alvéolaire chez l’homme et dans des modèles animaux [
12,
13]. Le rôle délétère direct de l’infection sur le développement alvéolaire a été démontré expérimentalement. Chez le raton nouveau-né, l’administration intratrachéale de LPS induit l’afflux intra-alvéolaire de cellules inflammatoires et une diminution significative du volume pulmonaire et de la surface alvéolaire [
14]. La colonisation pulmonaire par des germes faiblement pathogènes comme l’Ureaplasma urealyticum, dont le rôle dans le déclenchement d’une prématurité est probablement important, peut également perturber le développement pulmonaire. Cependant, le rôle potentiel de ce germe dans le développement d’une DBP est encore discuté [
15]. La colonisation par U. urealyticum est associée à une DBP dans certaines espèces animales mais pas dans d’autres. Chez l’homme, une méta-analyse de 23 études incluant 751 enfants a montré une association significative entre une colonisation par U. urealyticum et une DBP [
16]. Cependant, les études incluses dans cette méta-analyse étaient très hétérogènes et les résultats les plus significatifs étaient obtenus avec les plus petits effectifs. De plus, aucune étude n’a pu prouver qu’un traitement post-natal visant à éliminer U. urealyticum permettait de prévenir l’évolution vers une DBP. |
Le rôle central de l’inflammation dans le développement d’une DBP est actuellement bien prouvé expérimentalement et cliniquement. Le clinicien possède peu d’armes thérapeutiques anti-inflammatoires dans la prévention de la DBP. En effet, les corticoïdes postnataux sont très efficaces sur l’inflammation pulmonaire mais présentent des effets délétères sur le développement neurologique limitant leur utilisation en pratique clinique [
17]. Les modèles expérimentaux, qui permettent une meilleure compréhension des cascades inflammatoires du poumon en développement soumis à une agression, devraient permettre de définir de nouvelles cibles thérapeutiques et améliorer la prise en charge de la DBP et de sa composante inflammatoire. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Hadchouel
A
,
Delacourt
C
. Dysplasie bronchopulmonaire et génétique . Med Sci (Paris).
2013; ; 29 : :821.–823.
2.
Zana-Taïeb
E
,
Jarreau
PH
. Retard de croissance intra-utérin et dysplasie broncho-pulmonaire . Med Sci (Paris).
2013; ; 29 : :826.–828.
3.
Viscardi
RM
. Perinatal inflammation and lung injury . Semin Fetal Neonatal Med.
2011.
4.
Wright
CJ
,
Kirpalani
H
. Targeting inflammation to prevent bronchopulmonary dysplasia: can new insights be translated into therapies?
Pediatrics.
2011; ; 128 : :111.–126. 5.
Speer
CP
. Inflammation and bronchopulmonary dysplasia: a continuing story . Semin Fetal Neonatal Med.
2006; ; 11 : :354.–362. 6.
Kallapur
SG
,
Jobe
AH
. Contribution of inflammation to lung injury and development . Arch Dis Child Fetal Neonatal Ed.
2006; ; 91 : :F132.–F135. 7.
Jobe
AH
,
Newnham
JP
,
Willet
KE
, et al.
Endotoxin-induced lung maturation in preterm lambs is not mediated by cortisol . Am J Respir Crit Care Med.
2000; ; 162 : :1656.–1661. 8.
Blackwell
TS
,
Hipps
AN
,
Yamamoto
Y
, et al.
NF-kappaB signaling in fetal lung macrophages disrupts airway morphogenesis . J Immunol.
2011; ; 187 : :2740.–2747. 9.
Prince
LS
,
Okoh
VO
,
Moninger
TO
,
Matalon
S
. Lipopolysaccharide increases alveolar type II cell number in fetal mouse lungs through Toll-like receptor 4 and NF-kappaB . Am J Physiol Lung Cell Mol Physiol.
2004; ; 287 : :L999.–1006. 10.
Hartling
L
,
Liang
Y
,
Lacaze-Masmonteil
T
. Chorioamnionitis as a risk factor for bronchopulmonary dysplasia: a systematic review and meta-analysis . Arch Dis Child Fetal Neonatal Ed.
2011; ; 97 : :F8.–F17. 11.
Naik
AS
,
Kallapur
SG
,
Bachurski
CJ
, et al.
Effects of ventilation with different positive end-expiratory pressures on cytokine expression in the preterm lamb lung . Am J Respir Crit Care Med.
2001; ; 164 : :494.–498. 12.
Lopez
E
,
Boucherat
O
,
Franco-Montoya
ML
, et al.
Nitric oxide donor restores lung growth factor and receptor expression in hyperoxia-exposed rat pups . Am J Respir Cell Mol Biol.
2006; ; 34 : :738.–745. 13.
Méhats
C
,
Franco-Montoya
ML
,
Boucherat
O
, et al.
Effects of phosphodiesterase 4 inhibition on alveolarization and hyperoxia toxicity in newborn rats . PLoS One.
2008; ; 3 : :e3445.. 14.
Franco
ML
,
Waszak
P
,
Banalec
G
, et al.
LPS-induced lung injury in neonatal rats: changes in gelatinase activities and consequences on lung growth . Am J Physiol Lung Cell Mol Physiol.
2002; ; 282 : :L491.–L500. 15.
Viscardi
RM
. Ureaplasma species: role in diseases of prematurity . Clin Perinatol.
2010; ; 37 : :393.–409. 16.
Schelonka
RL
,
Katz
B
,
Waites
KB
,
Benjamin
DK, Jr
. Critical appraisal of the role of Ureaplasma in the development of bronchopulmonary dysplasia with metaanalytic techniques . Pediatr Infect Dis J.
2005; ; 24 : :1033.–1039. 17.
Baud
O
,
Gressens
P
. Voie de signalisation Sonic Hedgehog et impact des glucocorticoïdes sur le cerveau en développement . Med Sci (Paris).
2009; ; 25 : :713.–718. |