| |
| Med Sci (Paris). 2013 August; 29(8-9): 772–777. Published online 2013 September 5. doi: 10.1051/medsci/2013298017.Horloges circadiennes et métabolisme : intégration des signaux métaboliques et environnementaux
Hélène Duez,1,2,3,4* Yasmine Sebti,1,2,3,4 and Bart Staels1,2,3,4** 1Institut Pasteur de Lille, 1, rue du Professeur Calmette, 59019Lille, France 2Inserm UMR 1011, récepteurs nucléaires, maladies cardiovasculaires et diabète, Lille, France 3Université Lille 2, faculté des sciences pharmaceutiques et biologiques, faculté de médecine, 59006Lille, France 4European Genomic Institute for Diabetes (EGID), FR 3508, 59000Lille, France |
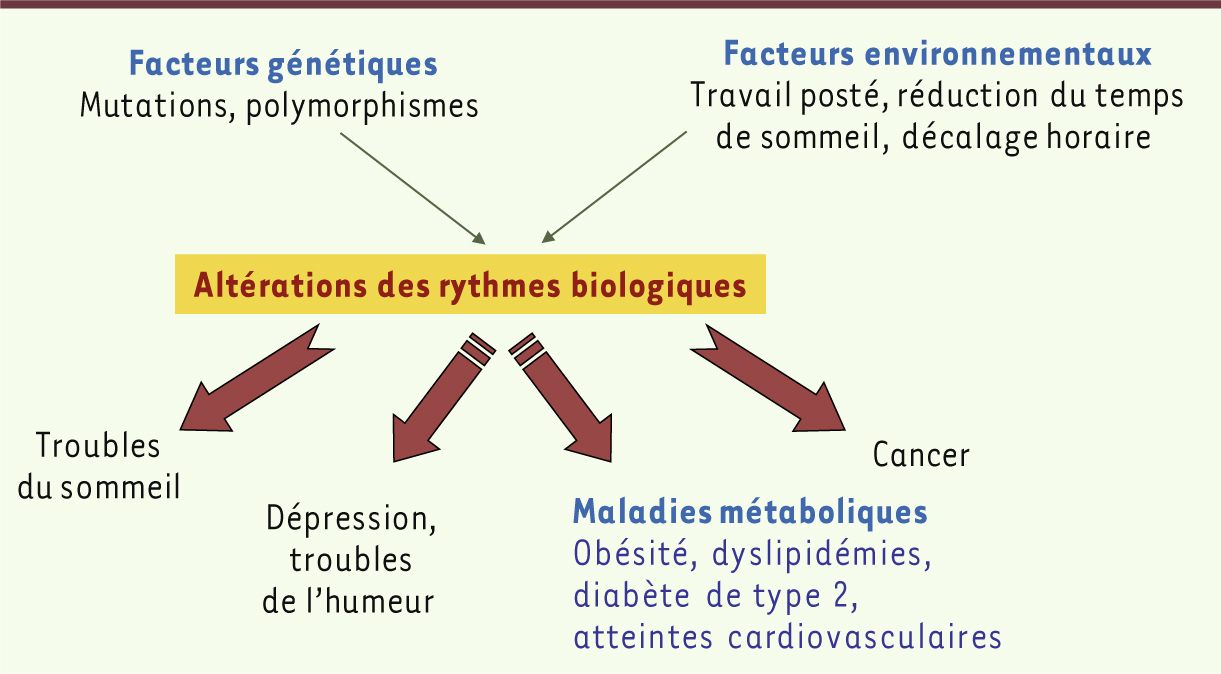
La plupart des processus physiologiques suivent un rythme circadien (du latin circa diem, environ un jour). Ces rythmes, générés par une horloge moléculaire présente au sein de chacune de nos cellules, sont chaque jour ré-entraînés grâce à la lumière qui module l’activité de notre horloge dite centrale via l’axe rétino-hypothalamique. Cette horloge, située dans les noyaux suprachiasmatiques de l’hypothalamus, synchronise des comportements tels que l’alternance veille/sommeil sur l’alternance jour/nuit. En chef d’orchestre, elle coordonne les horloges cellulaires dites périphériques présentes dans tous les organes, tels que le foie, le pancréas, le tissu adipeux ou le muscle squelettique. Celles-ci intègrent également les signaux relatant l’état énergétique de la cellule et, en retour, régulent de nombreuses voies métaboliques permettant ainsi d’optimiser l’utilisation des substrats énergétiques, d’anticiper les périodes de jeûne (pendant le sommeil) ou les prises des repas, et de séparer dans le temps des processus physiologiques et biochimiques mutuellement exclusifs (tels que la lipogenèse et l’oxydation des acides gras dans le foie). Ainsi, la physiologie est en résonance avec les changements journaliers qui s’opèrent avec la rotation de la Terre sur son axe. Pourtant, la pression sociétale et économique (travail de nuit, en 3 × 8) et les progrès technologiques (lumière artificielle, multiplication d’écrans et autres tablettes) perturbent notre horloge interne, non sans conséquences sur notre santé. Des études menées chez l’homme et chez la souris montrent en effet que des désordres de l’horloge, qu’ils soient dus à une mutation génétique ou à des modifications environnementales, sont liés à une augmentation significative du risque de développer une obésité, un diabète de type 2 et des maladies cardiovasculaires, mais aussi des troubles du sommeil, des dépressions, voire même certains cancers (Figure 1). Dans cette revue, nous traiterons du lien qui existe entre l’horloge circadienne et le métabolisme pour tenter de mieux comprendre comment ces altérations du rythme peuvent contribuer à des désordres cardiométaboliques.
 | Figure 1.
Causes et conséquences d’une altération des rythmes biologiques. Nos rythmes circadiens sont générés par une horloge moléculaire et synchronisés par des signaux environnementaux comme la lumière ou l’heure des repas. Lorsque ces signaux sont modifiés, ou lorsque des mutations altèrent l’expression de gènes codant pour des protéines impliquées dans le système de l’horloge, celle-ci n’est plus capable de rythmer correctement notre physiologie. Peuvent s’ensuivre diverses pathologies, allant du trouble du sommeil à la dépression, mais aussi certains cancers, ainsi que des désordres métaboliques et hormonaux pouvant aller jusqu’au développement de l’obésité, du diabète et de complications cardiovasculaires. |
|
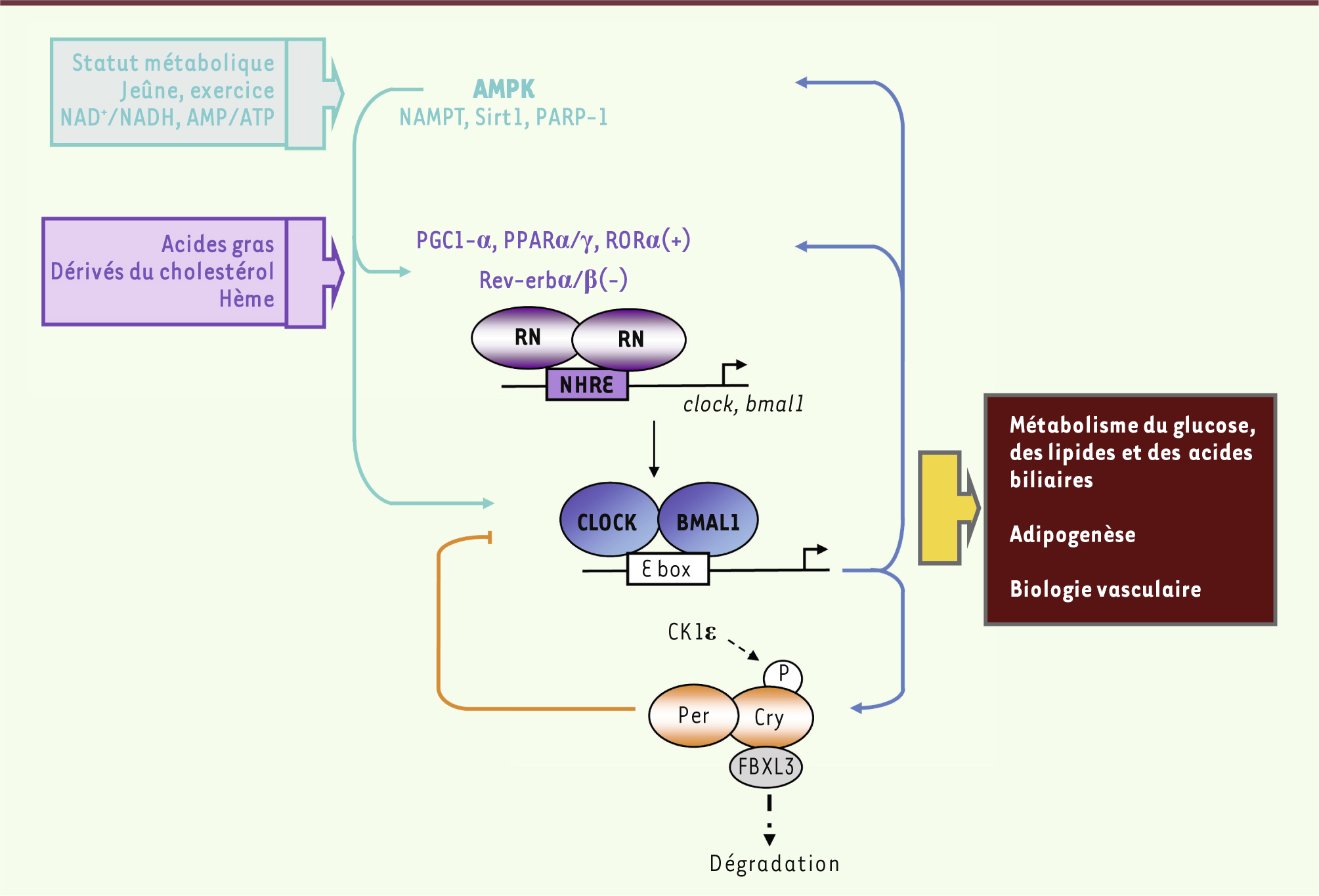
Mécanismes moléculaires de l’horloge biologique Les rythmes circadiens se caractérisent par l’adaptation de notre physiologie à l’alternance jour/nuit, permettant d’anticiper les signaux prédictibles de notre environnement (luminosité, disponibilité de la nourriture), et par la persistance de cette rythmicité en l’absence d’indicateur extérieur (horloge endogène). L’horloge se compose d’un système complexe de boucles de transcription. Celles-ci exercent des rétrocontrôles positifs et négatifs sur elles-mêmes, ce qui génère une activité transcriptionnelle cyclique (Figure 2). Une première boucle transcriptionnelle oppose les activateurs CLOCK (circadian locomotor output cycles kaput) et BMAL1 (brain and muscle ARNt like protein 1) et les répresseurs Per (period circadian protein) et Cry (cryptochromes). CLOCK et BMAL1 s’hétérodimérisent et activent la transcription de leurs gènes cibles (per et cry, Rev-erb, etc.) via leur fixation sur les boîtes E. En retour, Per et Cry entrent dans le noyau pour diminuer l’activité de CLOCK/BMAL1 via le recrutement d’un complexe PSF (pre-mRNA splicing factor)-Sin3/HDAC (histone deacetylase) et la déacétylation des histones H3 et H4, permettant de redémarrer un nouveau cycle. Une deuxième boucle se superpose à la première : CLOCK/BMAL1 active l’expression de Rev-erbα/β et ROR (retinoic acid related orphan receptor) qui, à leur tour, régulent l’expression de BMAL1 en la diminuant ou en l’augmentant, respectivement (Figure 2).
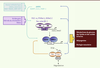 | Figure 2.
Couplage horloge et statut métabolique. Les horloges centrale et périphériques intègrent les signaux que sont la lumière et l’heure des repas, et coordonnent les rythmes biologiques. Au niveau moléculaire, les activateurs CLOCK et BMAL1 augmentent l’expression des répresseurs Per et Cry qui, lorsqu’ils sont en quantité suffisante, entrent dans le noyau pour réprimer CLOCK/BMAL1. Une deuxième boucle transcriptionnelle se surperpose à la première : CLOCK/BMAL1 active l’expression de Rev-erbα et ROR qui, à leur tour, régulent CLOCK et BMAL1. Les signaux métaboliques sont transmis à l’horloge au travers de nombreuses modifications post-traductionnelles modifiant la stabilité et l’action de ces protéines, permettant ainsi d’ajuster la période du cycle. RN : récepteur nucléaire ; NHRE : élément de réponse à un récepteur nucléaire ; NAMPT : nicotinamide phosphoribosyltransferase. |
En plus de ces boucles transcriptionnelles, il existe des modifications post-traductionnelles (phosphorylation, ubiquitination, acétylation/désacétylation, etc.) qui, en modulant la stabilité de ces diverses protéines, jouent sur la période du cycle généré et permettent de l’ajuster à 24 h ([
1] pour une revue récente). Récemment, il a été mis en évidence un niveau de contrôle supplémentaire sur l’horloge par les miARN. Par exemple, le miARN122, qui est sous le contrôle direct de Rev-erbα, présente une expression rythmique dans le foie de souris où il régule en retour de nombreux gènes impliqués dans le métabolisme [
2,
3]. Des modifications épigénétiques interviennent également dans le couplage de l’horloge aux signaux métaboliques. Plusieurs histones désacétylases comme Sirt1 (sirtuine 1) et HDAC3, présentes dans le complexe Rev-erbα/NcoR (nuclear receptor co-repressor protein), permettent ainsi l’intégration de ces signaux. La délétion de HDAC3 entraîne des désordres métaboliques, ainsi qu’un dérèglement de l’horloge [
4]. D’autres modifications, telles que la méthylation et le remodelage de la chromatine, jouent un rôle à part entière dans le contrôle circadien du métabolisme (voir [
5] pour revue). |
Couplage de l’horloge moléculaire avec le statut métabolique De nombreuses études menées chez les rongeurs ont mis en évidence ce dialogue horloge-métabolisme. En effet, une prise de nourriture à un temps circadien inapproprié, c’est-à-dire durant la période de sommeil, entraîne un dérèglement des horloges périphériques sans modification de l’horloge centrale, et favoriserait ainsi la survenue de l’obésité et de la résistance à l’insuline [
6]. L’administration d’un régime riche en graisses (high fat diet, HFD) entraîne lui aussi un dérèglement des horloges centrale et périphériques, et on observe un décalage de la prise de nourriture vers la période de sommeil [
7]. De plus, l’administration d’un régime HFD avec un accès à la nourriture restreint à la période de sommeil entraîne une prise de poids supérieure à celle induite chez la souris nourrie pendant la période de veille [
8]. Au contraire, la restriction du temps d’accès à la nourriture HFD durant la période de veille, sans changement du nombre de calories ingérées, diminue la prise de poids et la résistance à l’insuline chez la souris [
9], ce qui montre l’importance du temps circadien de la prise de nourriture. D’ailleurs, si la prise de nourriture influence l’horloge, la réciproque est vraie puisqu’une altération de l’horloge favorise le développement des maladies métaboliques, comme le soulignent de nombreux modèles de souris invalidés pour les gènes de l’horloge qui présentent des altérations métaboliques. En effet, la première étude publiée en 2005 montrait que les mutants de CLOCK sont hyperglycémiques et deviennent plus rapidement obèses et résistants à l’insuline lors d’un régime HFD [
10]. Au contraire, des souris déficientes pour BMAL1 (bmal1-/-
) sont plus sensibles à l’insuline, et présentent une diminution de la synthèse de novo du glucose [
11]. Pourtant, une même protéine de l’horloge peut exercer des fonctions différentes d’un organe périphérique à l’autre. En effet, une délétion de bmal1 spécifiquement dans le tissu adipeux entraîne une augmentation de la prise de nourriture au cours de la période de repos, sans modifier le profil d’activité locomotrice, et favorise le développement de l’obésité et d’une hyperglycémie [
12], tandis qu’une délétion spécifiquement dans le pancréas induit une hypo-insulinémie [
13]. Par ailleurs, une délétion de bmal1 spécifiquement dans le foie entraîne une hypoglycémie durant la phase de repos, une augmentation de la clairance du glucose et des altérations du rythme circadien des gènes du métabolisme hépatique du glucose [
14]. Une déficience pour Cry provoque, au contraire, une dérépression de la gluconéogenèse et une hyperglycémie [
15,
16]. Ces données suggèrent qu’il existe un rôle spécifique des composants de l’horloge qui dépendent de l’organe et de la phase du cycle (utilisation ou stockage contre synthèse de novo). Ceci souligne la complexité des interactions entre horloges périphériques et métabolites « locaux ». Chez l’homme, de nombreuses données confirment une telle relation entre horloge et métabolisme. En effet, des sujets sains soumis à des jours d’une durée de 20 h ou de 28 h présentent une intolérance au glucose et des taux élevés d’insuline, témoignant d’un impact métabolique négatif de la désynchronisation de l’horloge biologique [
17]. De plus, la réponse à un bolus de glucose varie au cours de la journée chez un sujet sain, et la sensibilité à l’insuline chez l’homme diminue au fil de la journée (voir [
18] pour revue). Plusieurs études ont identifié une association des polymorphismes dans les gènes de l’horloge (Clock, Bmal1, Cry, Rev-erbα) à l’obésité, l’hyperglycémie et le diabète de type 2 [
19-
22]. Par ailleurs, plusieurs études attestent de l’augmentation de la survenue de l’obésité et d’un diabète de type 2 chez les travailleurs postés [
23]. L’impact des désynchronisations plus légères, mais répétées, telles que le décalage social entre les horaires de semaine et ceux du week-end, ou le déficit chronique de sommeil n’a pas encore été évalué. Cependant, plusieurs études montrent qu’une réduction transitoire du temps de sommeil peut faire apparaître une intolérance au glucose [18]. |
Les acteurs du couplage horloge-métabolisme Couplage par les métabolites Plusieurs facteurs permettent de coupler le cœur de l’horloge au statut énergétique de la cellule. Il a été mis en évidence que la concentration intracellulaire en nicotinamide adénine dinucléotide (NAD +) synthétisé par la nicotinamide phosphoribosyltransférase (NAMPT) se trouve sous le contrôle de l’horloge et oscille de manière circadienne. En retour, le NAD + module l’activité de l’horloge via l’action de la désacétylase Sirt1, une enzyme activée par la restriction calorique et dont il est le cofacteur [
24-
26]. En désacétylant BMAL1, Sirt1 diminue son interaction avec l’ADN, tandis que CLOCK exerce une action opposée en acétylant BMAL1. Par ailleurs, la désacétylation de Per2 par Sirt1 conduit à sa dégradation par le protéasome. Le NAD + est également le cofacteur de la polyADP-ribose polymérase-1 (PARP-1), dont l’expression oscille de façon circadienne et varie en fonction de la prise de nourriture (qui module quant à elle l’activité de CLOCK) [
27]. Par ailleurs, une augmentation du rapport AMP/ATP, témoin d’un ralentissement du métabolisme se produisant en situation de jeûne et au cours de l’exercice, active l’ AMP activated protein kinase (AMPK) qui, en retour, phosphoryle Cry [
28], favorisant ainsi sa dégradation par la protéine FBXL3 ( F-box and leucine-rich repeat protein 3) et le protéasome. Ces données identifient le rapport AMP/ATP comme un acteur potentiel du contrôle circadien du métabolisme. Un autre facteur impliqué dans le dialogue entre horloge et métabolisme est la réaction de O-glycosylation qui est directement proportionnelle à la quantité de UDP-GlcNAc provenant du métabolisme du glucose, des acides gras et des acides aminés. Plusieurs études ont montré que la O-glycosylation interfère avec la phosphorylation et l’ubiquitination, et donc intervient dans la stabilité et l’activité des protéines CLOCK, Per, et Cry, aboutissant à une augmentation de la période du cycle, et à une altération de l’homéostasie glucidique [
29,
30]. Enfin, le statut d’oxydoréduction de la cellule influence le fonctionnement de l’horloge au travers du rapport NAD(P) +/NAD(P)H, dont l’augmentation se traduit par une diminution de l’interaction de CLOCK/BMAL1 avec l’ADN [
31]. Plus récemment, des oscillations circadiennes des peroxyrédoxines, protéines anti-oxydantes, ont été mises en évidence dans les globules rouges matures dépourvus de noyau, indépendamment donc de la transcription [
32]. L’état de multimérisation et d’activité de ces protéines suit un rythme circadien qui pourrait être entraîné par les variations d’ATP produit par la glycolyse. Récepteurs nucléaires et contrôle circadien du métabolisme Les récepteurs nucléaires sont des facteurs de transcription qui régulent de nombreux processus physiologiques après leur activation par de petites molécules dérivées du métabolisme (acides gras, dérivés du cholestérol, etc.) ou des hormones. Ces récepteurs sont pour la plupart soumis à l’horloge puisque leur expression, et par conséquent leur activité, oscille de façon circadienne. Le récepteur aux glucocorticoïdes participe au couplage horloge-métabolisme et, en particulier, intervient dans l’entraînement de l’horloge hépatique par la prise de nourriture [
33]. Plusieurs autres récepteurs nucléaires font partie du cœur du mécanisme de l’horloge. Rev-erbα/β et ROR-α, qui régulent et sont régulés par l’hétérodimère CLOCK/BMAL1, interagissent également avec Per2 et Cry [ 15,
34,
50,
51]. Rev-erbα et Rev-erbβ corégulent les gènes de la lipogenèse de façon circadienne permettant d’assurer l’homéostasie lipidique. Leur délétion spécifiquement dans le foie conduit à l’apparition d’une stéatose hépatique [
35,
36]. Rev-erbα intervient aussi dans le développement du tissu adipeux et la synthèse des acides biliaires et du glucose [
37]. Le traitement de souris avec des ligands synthétiques de Rev-erbα/β induit une perte de poids et l’amélioration de la sensibilité à l’insuline [
38]. RORα régule le métabolisme des lipides et la synthèse des acides biliaires parallèlement à son action sur Bmal1 [
39]. D’autres récepteurs nucléaires interviennent dans ce couplage, soit directement en régulant ou en interagissant avec certaines protéines de l’horloge, soit indirectement via une régulation circadienne de leur expression [
40]. En retour, ils régulent leurs gènes cibles métaboliques en fonction de leurs concentrations, ainsi que de celles de leurs ligands. PGC1-α ( PPARgamma coactivator-1), par exemple, agirait comme un cofacteur facilitant l’activation de Bmal1 par RORα [
41], et la délétion de PGC1-α se traduit par des altérations de l’expression circadienne des gènes de l’horloge. Les PPAR ( peroxisome proliferator-activated receptor) sont impliqués dans la régulation de l’oxydation des acides gras dans le foie, la différenciation des adipocytes et la sensibilité à l’insuline, ainsi que dans la réponse inflammatoire. Ils permettraient aussi le couplage à l’horloge en régulant Bmal1 [
42] et en interagissant avec Per2 [ 34]. Des souris déficientes pour PPARγ spécifiquement dans la paroi vasculaire présentent des troubles dans les variations circadiennes de la pression artérielle [
43]. Autres signaux de couplage L’autophagie permet à la cellule d’éliminer les composants qui pourraient être toxiques, tels que les organites endommagés (mitochondries par exemple), les agrégats protéiques, les lipides peroxydés et certains pathogènes. L’importance de cette voie est soulignée par le fait que des perturbations du processus autophagique peuvent engendrer de nombreuses pathologies, telles que les maladies cardiométaboliques (athérosclérose, diabète de type 2), certaines myopathies, et de nombreuses maladies neurodégénératives [
44]. L’autophagie est, par ailleurs, induite en cas de carence nutritionnelle, et elle permet la survie cellulaire en dégradant des macromolécules nécessaires à la production d’intermédiaires réutilisés dans les voies de synthèse. Une étude transcriptomique a montré que le gène codant pour Bnip3 ( Bcl-2/adenovirus E1B 19kD-interacting protein 3), une protéine impliquée dans l’autophagie induite par l’hypoxie, est régulé de façon circadienne dans le foie [
45], suggérant que l’horloge peut moduler le métabolisme par l’intermédiaire de cette voie. En effet, l’autophagie pourrait intervenir pendant la phase de jeûne pour maintenir l’équilibre énergétique. Plusieurs études récentes sont venues étayer cette hypothèse, démontrant que des variations circadiennes du flux d’autophagie sont notamment observées dans le foie de souris [
46,
47]. Ainsi, la dégradation de macromolécules par cette voie pourrait permettre de maintenir le statut énergétique lors du jeûne. Cependant, l’absence de fluctuations circadiennes de l’autophagie au cours d’un jeûne prolongé soulève la question d’une régulation directe de ce processus par l’horloge ou d’un entraînement de variations journalières par le cycle « prise de nourriture/période de jeûne » [
48]. Par ailleurs, la voie de l’autophagie est régulée par Rev-erbα dans le muscle de souris afin d’éliminer les mitochondries endommagées [
49]. |
Des systèmes élaborés, et parfois redondants, ont été mis en place pour connecter l’horloge circadienne aux nombreux métabolites reflétant l’état énergétique de la cellule, mais aussi aux nombreux facteurs de transcription permettant la corégulation de l’horloge et de gènes métaboliques. Pourtant, nous commençons seulement à comprendre le rôle respectif des gènes de l’horloge dans chacun des organes métaboliques clés. Ce travail est rendu difficile par les phénomènes de compensation observés entre les facteurs de l’horloge, et par la difficulté à dissocier les actions dépendantes de l’horloge de celles purement métaboliques. L’utilisation de modèles génétiquement modifiés au niveau de tissus spécifiques, et l’arrivée de molécules modulant l’activité de certains composants de l’horloge, devraient permettre de mieux comprendre les mécanismes par lesquels les composants de l’horloge orientent les voies métaboliques vers une utilisation optimale des substrats énergétiques. Par ailleurs, l’impact des modifications épigénétiques dans le contrôle circadien du métabolisme doit être approfondi et nous obligera à reconsidérer les interactions entre horloge et métabolisme. De nombreuses études montrent que les perturbations de nos horloges (travail posté, manque de sommeil) ont des conséquences néfastes sur notre santé [
52] (→).
(→) Voir également la synthèse de A. Karamitri et al., page 778 de ce numéro
Des composés pharmacologiques visant Rev-erbα/β ont récemment montré les bénéfices d’un ré-entraînement de l’horloge sur la réduction de l’obésité et la résistance à l’insuline chez la souris. Même si l’utilisation thérapeutique de tels composés chez l’homme n’est pas encore d’actualité, ces résultats ouvrent de nombreuses perspectives sur les possibilités d’interventions sur l’horloge afin de traiter les désordres métaboliques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nos travaux sur les rythmes circadiens sont soutenus par des fonds provenant de la communauté européenne (Marie Curie international reintegration grant IRG (FP7) et European commission (FP7) consortium Eurhythdia, European genomic institute for diabetes (EGID, ANR-10-LABX-46), la Région Nord Pas-de-Calais, FEDER, ITMO/Astra Zeneca, la Société francophone du diabète (SFD) conjointement avec MSD, et la European foundation for the study of diabetes (EFSD). Bart Staels est membre senior de l’Institut universitaire de France.
|
|
AMPK
|
AMP activated protein kinase
|
|
BMAL1
|
brain and muscle ARNt like protein 1
|
|
CLOCK
|
circadian locomotor output cycles kaput
|
|
Cry
|
cryptochromes |
|
HFD
|
high fat diet
|
|
PARP-1
|
polyADP-ribose polymerase-1
|
|
Per
|
period circadian protein
|
|
PGC-1
|
PPARgamma coactivator-1
|
|
PPAR
|
peroxisome proliferator-activated receptor
|
|
ROR
|
retinoic acid related orphan receptor
|
|
Sirt1
|
sirtuine 1 |
|
|
1.
Eckel-Mahan
K
,
Sassone-Corsi
P
. Metabolism and the circadian clock converge . Physiol Rev.
2013; ; 93 : :107.–135. 2.
Gatfield
D
,
Le Martelot
G
,
Vejnar
CE
, et al.
Integration of microRNA miR-122 in hepatic circadian gene expression . Genes Dev.
2009; ; 23 : :1313.–1326. 3.
Kojima
S
,
Gatfield
D
,
Esau
CC
,
Green
CB.
, MicroRNA-122 modulates the rhythmic expression profile of the circadian deadenylase Nocturnin in mouse liver . PLoS One.
2010; ; 5 : :e11264.. 4.
Feng
D
,
Liu
T
,
Sun
Z
, et al.
A circadian rhythm orchestrated by histone deacetylase 3 controls hepatic lipid metabolism . Science.
2011; ; 331 : :1315.–1319. 5.
Feng
D
,
Lazar
MA
. Clocks, metabolism, and the epigenome . Mol Cell.
2012; ; 47 : :158.–167. 6.
Damiola
F
,
Le Minh
N
,
Preitner
N
, et al.
Restricted feeding uncouples circadian oscillators in peripheral tissues from the central pacemaker in the suprachiasmatic nucleus . Genes Dev.
2000; ; 14 : :2950.–2961. 7.
Kohsaka
A
,
Laposky
AD
,
Ramsey
KM
, et al.
High-fat diet disrupts behavioral and molecular circadian rhythms in mice . Cell Metab.
2007; ; 6 : :414.–421. 8.
Arble
DM
,
Bass
J
,
Laposky
AD
, et al.
W. Circadian timing of food intake contributes to weight gain . Obesity (Silver Spring).
2009; ; 17 : :2100.–2102. 9.
Hatori
M
,
Vollmers
C
,
Zarrinpar
A
, et al.
Time-restricted feeding without reducing caloric intake prevents metabolic diseases in mice fed a high-fat diet . Cell Metab.
2012; ; 15 : :848.–860. 10.
Turek
FW
,
Joshu
C
,
Kohsaka
A
, et al.
Obesity and metabolic syndrome in circadian clock mutant mice . Science.
2005; ; 308 : :1043.–1045. 11.
Rudic
RD
,
McNamara
P
,
Curtis
AM
, et al.
BMAL1, CLOCK, two essential components of the circadian clock, are involved in glucose homeostasis . PLoS Biol.
2004; ; 2 : :e377.. 12.
Paschos
GK
,
Ibrahim
S
,
Song
WL
, et al.
Obesity in mice with adipocyte-specific deletion of clock component Arntl . Nat Med.
2012; ; 18 : :1768.–1777. 13.
Marcheva
B
,
Ramsey
KM
,
Buhr
ED
, et al.
Disruption of the clock components CLOCK and BMAL1 leads to hypoinsulinaemia and diabetes . Nature.
2010; ; 466 : :627.–631. 14.
Lamia
KA
,
Storch
KF
,
Weitz
CJ
. Physiological significance of a peripheral tissue circadian clock . Proc Natl Acad Sci USA.
2008; ; 105 : :15172.–15177. 15.
Lamia
KA
,
Papp
SJ
,
Yu
RT
, et al.
Cryptochromes mediate rhythmic repression of the glucocorticoid receptor . Nature.
2011; ; 480 : :552.–556. 16.
Zhang
EE
,
Liu
Y
,
Dentin
R
, et al.
Cryptochrome mediates circadian regulation of cAMP signaling and hepatic gluconeogenesis . Nat Med.
2010; ; 16 : :1152.–1156. 17.
Scheer
FA
,
Hilton
MF
,
Mantzoros
CS
,
Shea
SA
. Adverse metabolic and cardiovascular consequences of circadian misalignment . Proc Natl Acad Sci USA.
2009; ; 106 : :4453.–4458. 18.
VanCauter
E
,
Polonsky
KS
,
Scheen
AJ
. Roles of circadian rhythmicity and sleep in human glucose regulation . Endocr Rev.
1997; ; 18 : :716.–738. 19.
Goumidi
L
,
Grechez
A
,
Dumont
J
, et al.
Impact of REV-ERB alpha gene polymorphisms on obesity phenotypes in adult and adolescent samples . Int J Obes (Lond).
2013; ; 37 : :666.–672. 20.
Barker
A
,
Sharp
SJ
,
Timpson
NJ
, et al.
Association of genetic loci with glucose levels in childhood and adolescence: a meta-analysis of over 6, 000 children . Diabetes.
2011; ; 60 : :1805.–1812. 21.
Scott
EM
,
Carter
AM
,
Grant
PJ
. Association between polymorphisms in the clock gene, obesity and the metabolic syndrome in man . Int J Obes (Lond).
2008; ; 32 : :658.–662. 22.
Woon
PY
,
Kaisaki
PJ
,
Braganca
J
, et al.
Aryl hydrocarbon receptor nuclear translocator-like (BMAL1) is associated with susceptibility to hypertension and type 2 diabetes . Proc Natl Acad Sci USA.
2007; ; 104 : :14412.–14417. 23.
Wang
XS
,
Armstrong
ME
,
Cairns
BJ
, et al.
Shift work and chronic disease: the epidemiological evidence . Occup Med (Lond).
2011; ; 61 : :78.–89. 24.
Ramsey
KM
,
Yoshino
J
,
Brace
CS
, et al.
Circadian clock feedback cycle through NAMPT-mediated NAD+ biosynthesis . Science.
2009; ; 324 : :651.–654. 25.
Nakahata
Y
,
Sahar
S
,
Astarita
G
, et al.
Circadian control of the NAD+ salvage pathway by CLOCK-SIRT1 . Science.
2009; ; 324 : :654.–657. 26.
Asher
G
,
Gatfield
D
,
Stratmann
M
, et al.
SIRT1 regulates circadian clock gene expression through PER2 deacetylation . Cell.
2008; ; 134 : :317.–328. 27.
Asher
G
,
Reinke
H
,
Altmeyer
M
, et al.
Poly(ADP-ribose) polymerase 1 participates in the phase entrainment of circadian clocks to feeding . Cell.
2010; ; 142 : :943.–953. 28.
Lamia
KA
,
Sachdeva
UM
,
Ditacchio
L
, et al.
AMPK regulates the circadian clock by cryptochrome phosphorylation and degradation . Science.
2009; ; 326 : :437.–440. 29.
Kaasik
K
,
Kivimae
S
,
Allen
JJ
, et al.
Glucose sensor O-GlcNAcylation coordinates with phosphorylation to regulate circadian clock . Cell Metab.
2013; ; 17 : :291.–302. 30.
Li
MD
,
Ruan
HB
,
Hughes
ME
, et al.
O-GlcNAc signaling entrains the circadian clock by inhibiting BMAL1/CLOCK ubiquitination . Cell Metab.
2013; ; 17 : :303.–310. 31.
Rutter
J
,
Reick
M
,
Wu
LC
,
McKnight
SL
. Regulation of clock and NPAS2 DNA binding by the redox state of NAD cofactors . Science.
2001; ; 293 : :510.–514. 32.
O’Neill
JS
,
Reddy
AB
. Circadian clocks in human red blood cells . Nature.
2011; ; 469 : :498.–503. 33.
Le Minh
N
,
Damiola
F
,
Tronche
F
, et al.
Glucocorticoid hormones inhibit food-induced phase-shifting of peripheral circadian oscillators . EMBO J.
2001; ; 20 : :7128.–7136. 34.
Schmutz
I
,
Ripperger
JA
,
Baeriswyl-Aebischer
S
,
Albrecht
U
. The mammalian clock component PERIOD2 coordinates circadian output by interaction with nuclear receptors . Genes Dev.
2010; ; 24 : :345.–357. 35.
Cho
H
,
Zhao
X
,
Hatori
M
, et al.
Regulation of circadian behaviour and metabolism by REV-ERB-alpha and REV-ERB-beta . Nature.
2012; ; 485 : :123.–127. 36.
Bugge
A
,
Feng
D
,
Everett
LJ
, et al.
Rev-erbalpha and Rev-erbbeta coordinately protect the circadian clock and normal metabolic function . Genes Dev.
2012; ; 26 : :657.–667. 37.
Duez
H
,
Staels
B
. Nuclear receptors linking circadian rhythms and cardiometabolic control . Arterioscler Thromb Vasc Biol.
2010; ; 30 : :1529.–1534. 38.
Solt
LA
,
Wang
Y
,
Banerjee
S
, et al.
Regulation of circadian behaviour and metabolism by synthetic REV-ERB agonists . Nature.
2012; ; 485 : :62.–68. 39.
Solt
LA
,
Burris
TP
. Action of RORs and their ligands in (patho)physiology . Trends Endocrinol Metab.
2012; ; 23 : :619.–627. 40.
Yang
X
,
Downes
M
,
Yu
RT
, et al.
Nuclear receptor expression links the circadian clock to metabolism . Cell.
2006; ; 126 : :801.–810. 41.
Liu
C
,
Li
SM
,
Liu
TH
, et al.
Transcriptional coactivator PGC-1a integrates the mammalian clock and energy metabolism . Nature.
2007; ; 447 : :477.–481. 42.
Canaple
L
,
Rambaud
J
,
Dkhissi-Benyahya
O
, et al.
Reciprocal regulation of brain and muscle Arnt-like protein 1 and peroxisome proliferator-activated receptor alpha defines a novel positive feedback loop in the rodent liver circadian clock . Mol Endocrinol.
2006; ; 20 : :1715.–1727. 43.
Wang
N
,
Yang
G
,
Jia
Z
, et al.
Vascular PPARgamma controls circadian variation in blood pressure and heart rate through Bmal1 . Cell Metab.
2008; ; 8 : :482.–491. 44.
Codogno
P
. Les gènes ATG et la macro-autophagie . Med Sci (Paris).
2004; ; 20 : :734.–736. 45.
Panda
S
,
Antoch
MP
,
Miller
BH
, et al.
Coordinated transcription of key pathways in the mouse by the circadian clock . Cell.
2002; ; 109 : :307.–320. 46.
Ma
D
,
Panda
S
,
Lin
JD
. Temporal orchestration of circadian autophagy rhythm by C/EBPbeta . EMBO J.
2011; ; 30 : :4642.–4651. 47.
Xiong
X
,
Tao
R
,
DePinho
RA
,
Dong
XC
. The autophagy-related gene 14 (Atg14) is regulated by forkhead box O transcription factors and circadian rhythms and plays a critical role in hepatic autophagy and lipid metabolism . J Biol Chem.
2012; ; 287 : :39107.–39114. 48.
Sachdeva
UM
,
Thompson
CB
. Diurnal rhythms of autophagy: implications for cell biology and human disease . Autophagy.
2008; ; 4 : :581.–589. 49.
Woldt
E
,
Sebti
Y
,
Solt
LA
, et al.
Rev-erb-a modulates skeletal muscle oxidative capacity by regulating mitochondrial biogenesis and autophagy . Nat Med.
2013; ; 19 : :1039.–1046. 50.
Delezie
J
,
Pévet
P
,
Challet
E
. Implication du gène d’horloge Reverba dans l'obésité . Med Sci (Paris).
2012; ; 28 : :687.–689. 51.
Teboul
M
,
Delaunay
F
. Les récepteurs REVERBa et REVERBb donnent le tempo . Med Sci (Paris).
2012; ; 28 : :689.–692. 52.
Karamitri
A
,
Vincens
M
,
Chen
M
,
Jockers
R
. Implication des mutations du récepteur de la mélatonine MT2 dans la survenue du diabète de type 2 . Med Sci (Paris).
2013; ; 29 : :778.–784. |