| |
| Med Sci (Paris). 2013 August; 29(8-9): 765–771. Published online 2013 September 5. doi: 10.1051/medsci/2013298016.Le facteur de transcription ChREBP
Un modulateur clé de la sensibilité à l’insuline ? Fadila Benhamed ,1,2,3 Audrey Poupeau,1,2,3 and Catherine Postic1,2,3* 1Institut Cochin, Département d’endocrinologie, métabolisme et cancer, 24, rue du Faubourg Saint Jacques, 75014Paris, France 2Inserm U1016, Paris, France 3Université Paris Descartes, Paris, France |
Chez les mammifères, le foie et le tissu adipeux blanc sont deux organes clés de l’homéostasie glucidique et lipidique. Lors d’un apport excessif en glucose, le foie convertit le glucose en acides gras via la synthèse de novo d’acides gras (la lipogenèse). Ceux-ci sont ensuite estérifiés sous forme de triglycérides, exportés sous forme de VLDL (very low density lipoprotein) puis stockés dans le tissu adipeux. Une dérégulation de ces voies métaboliques peut conduire au développement d’une stéatose hépatique, définie par une accumulation excessive d’acides gras, généralement sous forme de triglycérides [
32] (→). Ainsi, il a été montré que la voie de la lipogenèse pouvait contribuer jusqu’à 25 % des triglycérides accumulés dans le foie de patients obèses et insulino-résistants [
1]. La stéatose hépatique, considérée comme bénigne, fait cependant partie d’un large spectre d’atteintes hépatiques regroupées sous le terme de NAFLD (non alcoholic fatty liver diseases). La NAFLD est une des hépatopathies les plus fréquentes avec une prévalence de 30 % dans la population européenne. Aux États-Unis, 50 % des personnes atteintes de NAFLD sont obèses et plus de 40 % sont diabétiques de type 2 [
2].
(→) Voir l’article de M. Flamment et F. Foufelle, page 756 de ce numéro
Un des acteurs clés de la voie de la lipogenèse est le facteur de transcription ChREBP (carbohydrate response element binding protein) qui relaie les effets du glucose sur les gènes codant pour les enzymes de la lipogenèse : la fatty acid synthase (FAS), l’acetyl-CoA carboxylase (ACC) ou encore la stearoyl-CoA desaturase 1 (SCD1) (pour revue [
3]). Au laboratoire, nous avons mis en évidence l’importance de ChREBP dans l’induction des gènes de la lipogenèse en réponse au glucose par des expériences d’inhibition du facteur de transcription par ARN interférence dans des cultures primaires d’hépatocytes [
4]. ChREBP est principalement exprimé dans les tissus sensibles à l’insuline comme le foie, les tissus adipeux brun et blanc ou le muscle squelettique [
5]. L’objectif de cette revue est de discuter les travaux récents de la littérature concernant la régulation et le rôle de ChREBP dans le foie et le tissu adipeux. |
ChREBP : le médiateur transcriptionnel des effets du glucose Le gène codant pour le facteur de transcription ChREBP (aussi connu sous le nom de Mondo B ou MlxIP) a été cloné au début des années 2000 à partir d’extraits nucléaires de foie de rats nourris [
6]. ChREBP, qui appartient à la famille des facteurs de transcription de type b-HLH-LZ, a été mis en évidence par sa capacité de fixation à l’élément de réponse de type ChoRE (carbohydrate response element) de la L-pyruvate kinase (L-PK), un gène clé de la glycolyse, en réponse à des fortes concentrations de glucose. L’élément de réponse au glucose ChoRE est composé de deux boîtes E (CACGTG) séparées de 5 nucléotides. ChREBP est une protéine de 857 acides aminés qui contient plusieurs domaines hautement conservés au cours de l’évolution, les domaines MCR I à V (MCR : mondo conserved region) (Figure 1). ChREBP possède un signal de localisation nucléaire (NLS, acides aminés 158-173), deux signaux d’export nucléaire en amino-terminal (NES), un domaine b-HLH (acides aminés 660-736) permettant sa fixation à l’ADN via son hétérodimérisation avec son partenaire Mlx (max-like protein x), un facteur de transcription à domaine b-HLH-LZ membre de la famille des Myc/Max/Mad [
7]. Mlx, qui est exprimé de manière ubiquitaire dans l’organisme, n’a pas d’activité transcriptionnelle per se. En réponse au glucose, un hétérocomplexe Mlx/ChREBP se forme, se fixe sur le ChoRE et s’associe en tétramère, permettant ainsi l’activation transcriptionnelle des gènes cibles (Figure 2B).
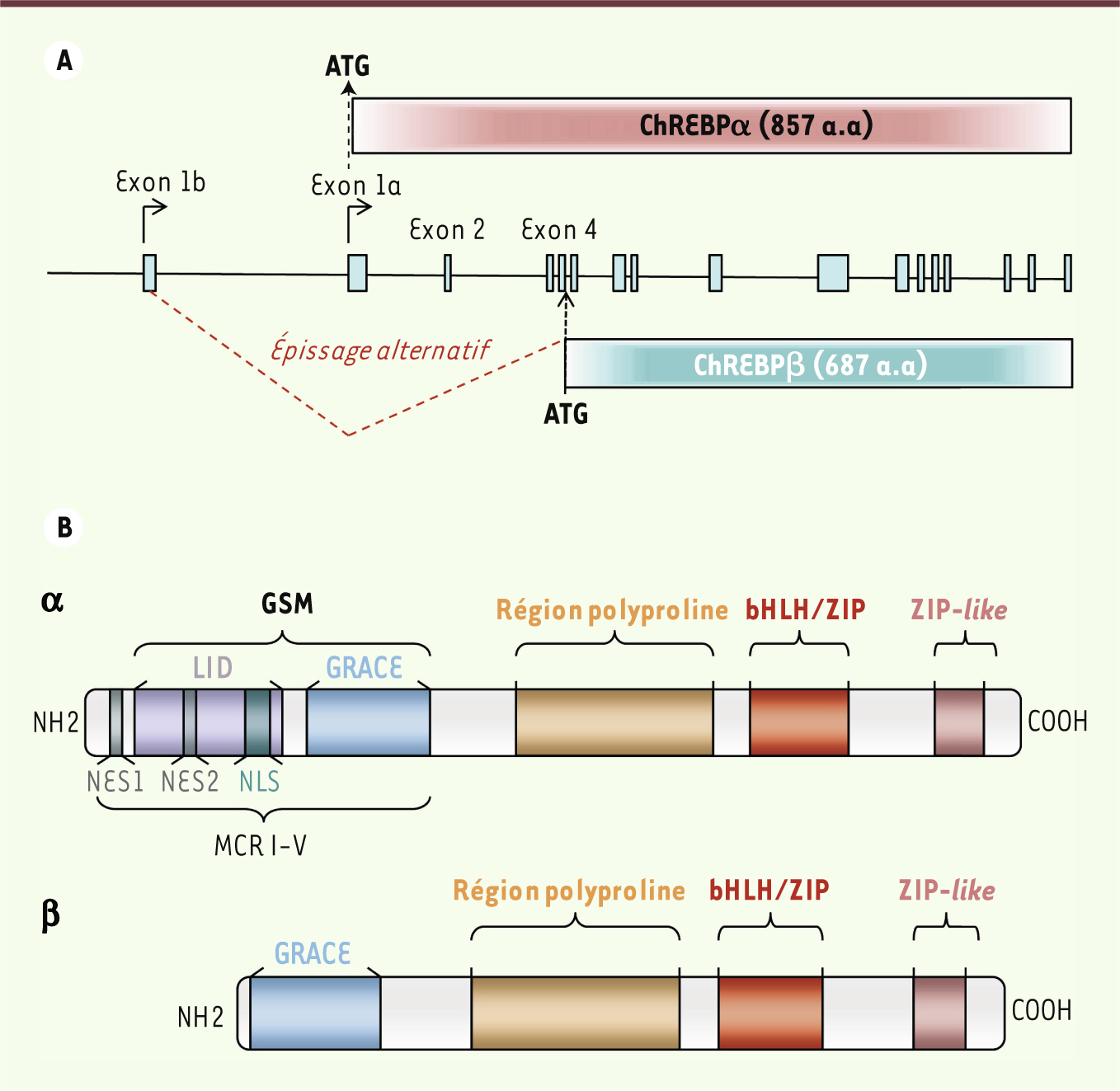
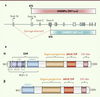 | Figure 1.
Représentations génique et protéique de ChREBP α et β. A. Epissage alternatif de ChREBPβ. ChREBPα est synthétisée à partir du site d’initiation de la traduction localisé dans l’exon 1a. ChREBPβ est transcrite à partir du promoteur situé dans l’exon 1b et par un épissage des exons 1a et 2. Le site d’initiation de la traduction est localisé dans l’exon 4 conduisant à la formation d’une protéine plus courte de 687 acides aminés. Adapté de [
23]. B. Structure des protéines ChREBP α et β. La protéine ChREBPα (857 a.a) possède différents domaines dont un signal de localisation nucléaire (NLS), deux signaux d’export nucléaire (NES1 et NES2), un domaine riche en proline, un domaine bHLH/ZIP permettant l’interaction avec son partenaire d’hétérodimérisation Mlx et un domaine leucine-zipper- like. Une région très conservée et sensible au glucose (GSM) a été identifiée par analyse structure/fonction. Cette région est comprend les domaines LID ( low-glucose inhibitory domain) et GRACE ( glucose conserved response element). Le domaine LID est absent de la protéine courte ChREBPβ. MCR : mondo conserved region. |
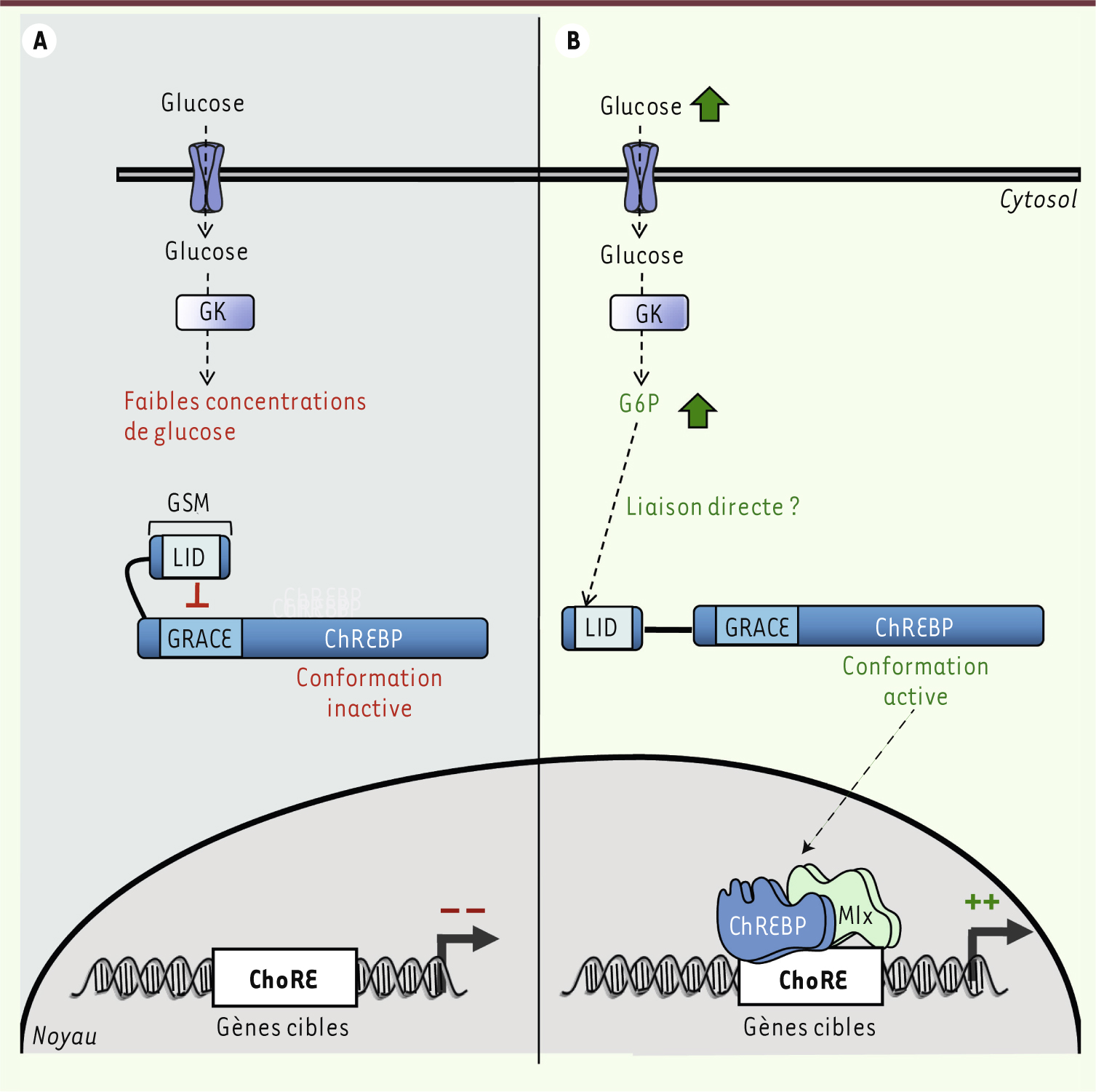
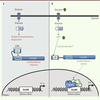 | Figure 2.
Modèle d’activation de ChREBP par les domaines LID et GRACE. A. En présence de faibles concentrations de glucose, la protéine ChREBP est cytosolique et dans une conformation inactive. Les gènes cibles de ChREBP ne sont pas induits. Le domaine LID inhibe l’activité transactivatrice de ChREBP induite par le GRACE. B. En réponse à des concentrations élevées de glucose et à l’activation du métabolisme du glucose (en particulier la synthèse de G6P), l’inhibition exercée par le LID sur le GRACE est levée. ChREBP pourrait alors changer de conformation et migrer dans le noyau. L’activation des gènes cibles de ChREBP nécessite la présence de Mlx, avec qui ChREBP forme un tétramère sur le ChoRE. GSM : glucose-sensing module ; LID : low-glucose inhibitory domain ; GRACE : glucose conserved response element ; GK : glucokinase ; G6P : glucose 6-phosphate. |
|
Régulation de l’activité de ChREBP par le glucose : mise en jeu de plusieurs mécanismes ? À ce jour, le mode exact d’activation de ChREBP en réponse au glucose reste complexe et deux théories majeures coexistent [
8,
9].
-
Le premier modèle décrit consiste en un mécanisme dynamique de phosphorylation/déphosphorylation sur deux résidus clés, la sérine 196 (Ser196) localisée à l’extrémité amino-terminale de la protéine et la thréonine 666 (Thr666) localisée dans le domaine de liaison à l’ADN. In vitro, l’incubation de la protéine ChREBP avec la protéine kinase A (PKA) en présence d’ATP conduit à la phosphorylation de ChREBP et à son export du noyau vers le cytoplasme. Ce mécanisme peut être inversé en présence de la protéine phosphatase 2A (PP2A) qui permet la déphosphorylation de ChREBP sur les deux résidus (Ser196 et Thr666) et son import dans le noyau [6]. Selon ce modèle, le métabolite signal de la translocation de ChREBP est le xylulose-5-phosphate (X5P), un intermédiaire de la voie des pentoses phosphates capable d’activer spécifiquement la PP2A [
10]. Cependant, deux études récentes révèlent qu’un autre intermédiaire du métabolisme du glucose, le glucose 6-phosphate (G6P) produit par la glucokinase (GK), serait le métabolite signal [
11,
12] (Figure 2B), remettant en cause le modèle d’activation de ChREBP dépendant du X5P et de la PP2A. En effet, la surexpression in vivo et in vitro de la G6PDH (glucose 6-phosphate deshydrogenase), enzyme limitante de la voie des pentoses phosphate, conduisant à une diminution des concentrations de G6P en faveur d’une augmentation de celles du X5P, prévient la translocation de ChREBP vers le noyau [11] ainsi que son activation transcriptionnelle [11, 12]. Cette même étude rapporte également que la translocation de ChREBP vers le noyau serait indépendante de la PP2A [11].
-
Le second modèle d’activation de ChREBP en réponse au glucose serait indépendant d’une régulation par phosphorylation/déphosphorylation (Figure 2). Des analyses structure-fonction de la protéine ChREBP ont permis d’identifier un domaine en N-terminal (acides aminés 37-298) nommé GSM (glucose sensing module) très conservé au cours de l’évolution (Figure 1B) [9,
13] Le GSM est composé de deux domaines : le LID (low-glucose inhibitory domain, acides aminés 37-192) et le GRACE (glucose response conserved element, acides aminés 197-298) [13]. En faible concentration de glucose, le LID exerce une activité inhibitrice sur le GRACE, et prévient ainsi l’activation de ChREBP. Selon ce modèle, la protéine ChREBP pourrait se trouver dans une conformation inactive (Figure 2A). En revanche, en présence de fortes concentrations de glucose, l’action inhibitrice du LID sur le GRACE est levée (via le métabolisme du glucose et en particulier le G6P) et le domaine GRACE peut induire ChREBP. De manière intéressante, la délétion des 196 premiers acides aminés de ChREBP conduit à une isoforme constitutivement active [9,
14], renforçant la validité du modèle de regulation de ChREBP par le LID et le GRACE.
|
Régulation de ChREBP par acétylation et O-GlcNAcylation Des études récentes ont également permis de montrer que l’activité de ChREBP pouvait être modulée par des modifications post-traductionnelles comme la O-GlcNAcylation ou l’acétylation [
15-
17]. En réponse au glucose, la protéine ChREBP est acétylée sur la lysine 672 (résidu localisé dans le domaine de liaison à l’ADN) par l’histone acétyltransférase p300. Cette modification augmente la capacité de liaison de ChREBP à ses éléments de réponse ChoRE et, de ce fait, son activité transcriptionnelle. La mutation de la lysine 672 en arginine entraîne une diminution de l’acétylation de ChREBP et une inhibition consécutive de sa fixation à ses ChoRE [15]. Une faible fraction (2 à 5 %) du glucose qui entre dans la cellule est orientée dans la voie des hexosamines. L’étape limitante de cette voie est catalysée par la GFAT (glutamine fructose-6-phosphate), qui transforme le fructose 6-phosphate, un intermédiaire de la glycolyse, en glucosamine 6-phosphate. La voie des hexosamines synthétise l’UDP-GlcNAc (UDP-N-acetylglucosamine) qui sert de substrat à la réaction d’O-GlcNAcylation des protéines. L’enzyme OGT (O-linked b-N-acetylglucosamine) catalyse la fixation réversible de la molécule UDP-GlcNAc sur les protéines alors que l’OGA (O-N-acetyl glucosaminidase) inverse la réaction. La O-GlcNAcylation modifie l’activité transcriptionnelle, la localisation cellulaire ou/et la stabilité de nombreuses protéines [
18]. Une augmentation de l’activité transactivatrice de ChREBP a été mise en évidence en réponse au traitement de cellules HEK (human embryonic kidney) par du PUGNAc, un inhibiteur de l’OGA. Cependant, dans cette étude, aucun lien direct entre ChREBP et la O-GlcNAcylation n’a été mis en évidence [17]. Par la suite, notre laboratoire a montré une interaction directe entre ChREBP et l’OGT dans des hépatocytes en culture primaire et dans le foie in vivo. La O-GlcNAcylation qui en résulte conduit à la stabilisation de ChREBP et à l’augmentation de son activité transcriptionnelle sur ses gènes cibles [
16]. Outre ChREBP, des régulateurs clefs du métabolisme énergétique, tels que FoxO1 [
19,
20], CRTC2 [
21] ou le coactivateur PGC1α [
22], impliqués dans le contrôle transcriptionnel de la production hépatique de glucose ont été décrits comme étant des cibles de la O-GlcNAcylation dans le foie. En situation physiopathologique de diabète, l’hyperglycémie active de façon exacerbée la voie des hexosamines amplifiant ainsi les voies de production du glucose et de synthèse des lipides via la voie de la lipogenèse. |
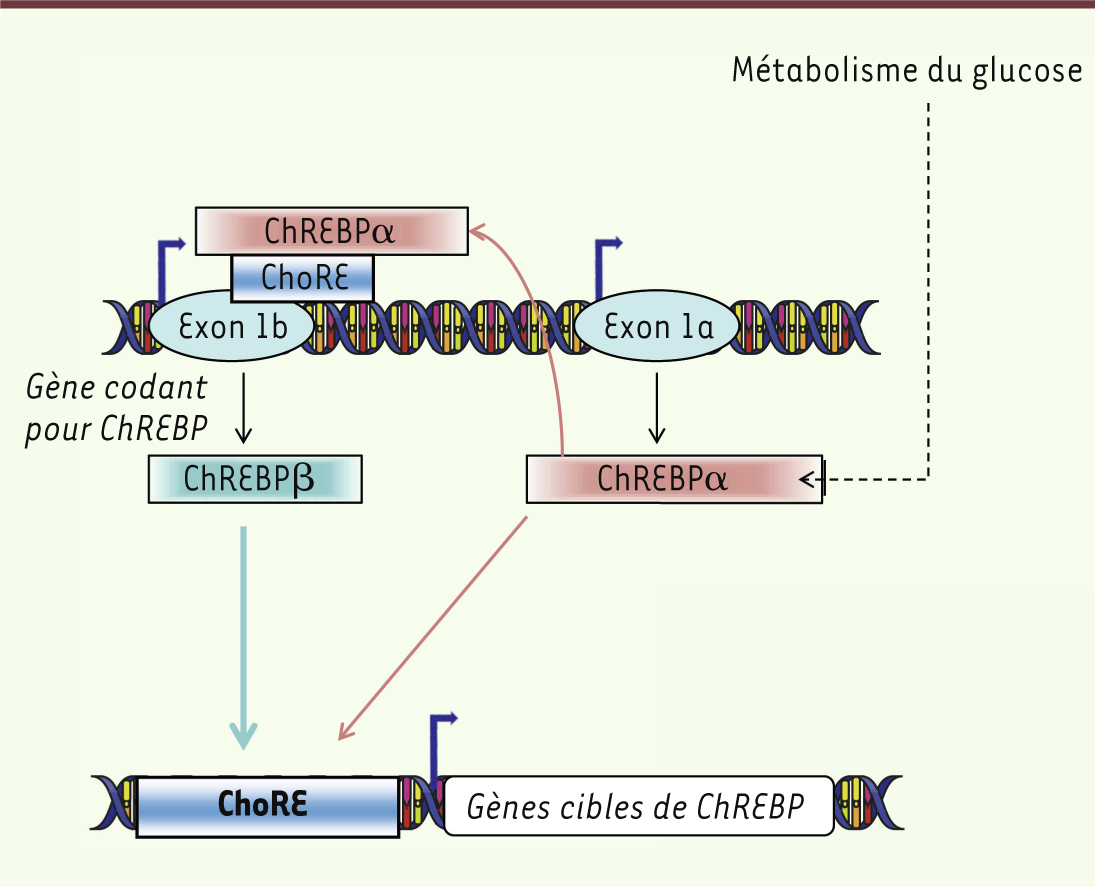
Découverte d’une nouvelle isoforme : ChREBPβ Récemment, Herman et ses collaborateurs ont identifié une nouvelle isoforme de ChREBP, ChREBPβ, dans le tissu adipeux blanc de souris [23]. Cette isoforme de 687 acides aminés est issue d’un promoteur alternatif situé dans l’exon1b du gène codant pour ChREBP (Figure 1A) [23]. ChREBPβ subit l’épissage des exons 1a et 2, et le site d’initiation de la traduction de cette isoforme débute au niveau de l’exon 4, expliquant sa taille plus courte (Figure 1). De manière intéressante, ChREBPβ est dépourvue du domaine LID qui exerce une régulation négative de l’activité de ChREBP en présence de faibles concentrations de glucose (Figure 2). Bien qu’étant moins abondante que ChREBPα (l’isoforme canonique de 857 acides aminés ChREBP rebaptisée ChREBPα par les auteurs), ChREBPβ est environ vingt fois plus active au niveau transcriptionnel et son activité est élévée quelles que soient les concentrations de glucose dans la cellule [23]. De plus, les auteurs de l’étude propose un nouveau mécanisme de régulation impliquant les deux isoformes α et β (Figure 3). ChREBPα serait dans un premier temps activée en réponse au métabolisme du glucose. Une fois active, elle se fixerait sur le ChoRE identifié dans l’exon1b, permettant ainsi l’induction de l’expression de l’isoforme très active ChREBPβ. Ce mécanisme permettrait une amplification du signal et une amplitude de réponse plus importante en réponse à des concentrations élevées de glucose (Figure 3).
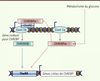 | Figure 3.
Relation physiologique entre ChREBPα et ChREBPβ dans l’adipocyte. Selon le modèle proposé par Herman et collaborateurs [ 23], ChREBPα, activée par le métabolisme du glucose, se fixe sur les ChoRE de ses gènes cibles. En parallèle, ChREBPα se lierait aussi sur le ChoRE situé dans l’exon 1b du promoteur alternatif et stimulerait l’expression de ChREBPβ. L’isoforme β de ChREBP est constitutivement active et participe à l’amplification du signal (adapté de [ 23]). |
|
ChREBP et sensibilité à l’insuline : une relation complexe ? Au cours des dernières années, des équipes se sont focalisées sur le lien complexe qui existe entre lipogenèse exacerbée, accumulation d’acides gras et modulation de la balance sensibilité versus résistance à l’insuline [
24]. La résistance à l’insuline, une des complications du syndrome métabolique, est souvent associée à la stéatose hépatique et à l’obésité sans qu’une relation causale n’ait été clairement établie. En effet, des études ont suggéré qu’une lipogenèse de novo active pouvait être associée à une meilleure sensibilité à l’insuline dans le tissu adipeux et dans le foie. |
Un rôle controversé pour ChREBP dans la sensibilité à l’insuline hépatique L’importance du facteur de transcription ChREBP dans le contrôle de l’homéostasie énergétique a été mise en évidence par la caractérisation phénotypique de plusieurs modèles animaux [5,
25-
27]. L’invalidation globale de ChREBP (souris ChREBPKO) chez la souris entraîne une diminution importante du contenu en triglycérides hépatiques, résultant de l’effondrement de l’expression des gènes clefs de la glycolyse (L-PK) et de la lipogenèse (ACC, FAS) dans le foie [5]. Les souris ChREBPKO présentent également une intolérance au glucose et une résistance à l’insuline. Ces résultats sont à mettre en parallèle avec une pathologie humaine, le syndrome Williams-Beuren [
28]. En effet, ce syndrome, qui se caractérise dans 75 % des cas par une intolérance au glucose, est lié à une microdélétion de la région (7q 11.23) du chromosome 7, région chromosomique contenant plusieurs gènes dont l’homologue humain de ChREBP [28]. Alors que l’invalidation de ChREBP chez la souris C57BL/6J (non obèse) s’accompagne d’une intolérance au glucose et d’une résistance à l’insuline [5], son inactivation dans un contexte d’obésité et d’insulino-résistance donne lieu à un phénotype plutôt bénéfique [25]. En effet, l’inhibition ciblée de ChREBP dans le foie de souris ob/ob (obèses et insulino-résistantes), par injection d’un adénovirus exprimant un ARN interférent spécifique de ChREBP, conduit à une réduction significative des triglycérides hépatiques associée à une restauration de la sensibilité à l’insuline hépatique et périphérique [25]. Contre toute attente, la surexpression de ChREBP dans le foie de souris n’entraîne pas de phénotype de résistance à l’insuline. En effet, de manière surprenante, le phénotype d’intolérance au glucose, de résistance à l’insuline et d’hyperinsulinémie développé par des souris C57BL/6J soumises à un régime riche en lipides est corrigé lorsque ChREBP est surexprimé dans le foie, et ce malgré l’exacerbation de la stéatose hépatique [27]. Comment expliquer de tels phénotypes ? Quel que soit le modèle animal, ChREBP apparaît de manière claire comme un modulateur du contenu en acides gras/triglycérides [5, 25, 27] : une diminution des concentrations de triglycérides lorsque ChREBP est inhibé et le développement d’une stéatose hépatique lorsqu’il est surexprimé. La relation entre ChREBP et sensibilité à l’insuline est, quant à elle, plus complexe et semble très dépendante du fond génétique et/ou du contexte nutritionnel. Dans le modèle de surexpression de ChREBP dans le foie [27], l’amélioration des paramètres métaboliques et physiologiques est expliquée par une modification de la composition en acides gras et donc une prévention de la lipotoxicité souvent associée au syndrome de résistance à l’insuline. En effet, ChREBP, en induisant l’expression de la SCD1, favorise la synthèse des acides gras mono-insaturés (MUFA, comme l’oléate et le palmitoléate) considérés comme bénéfiques pour la signalisation de l’insuline au détriment d’acides gras saturés (SFA) délétères comme le palmitate [
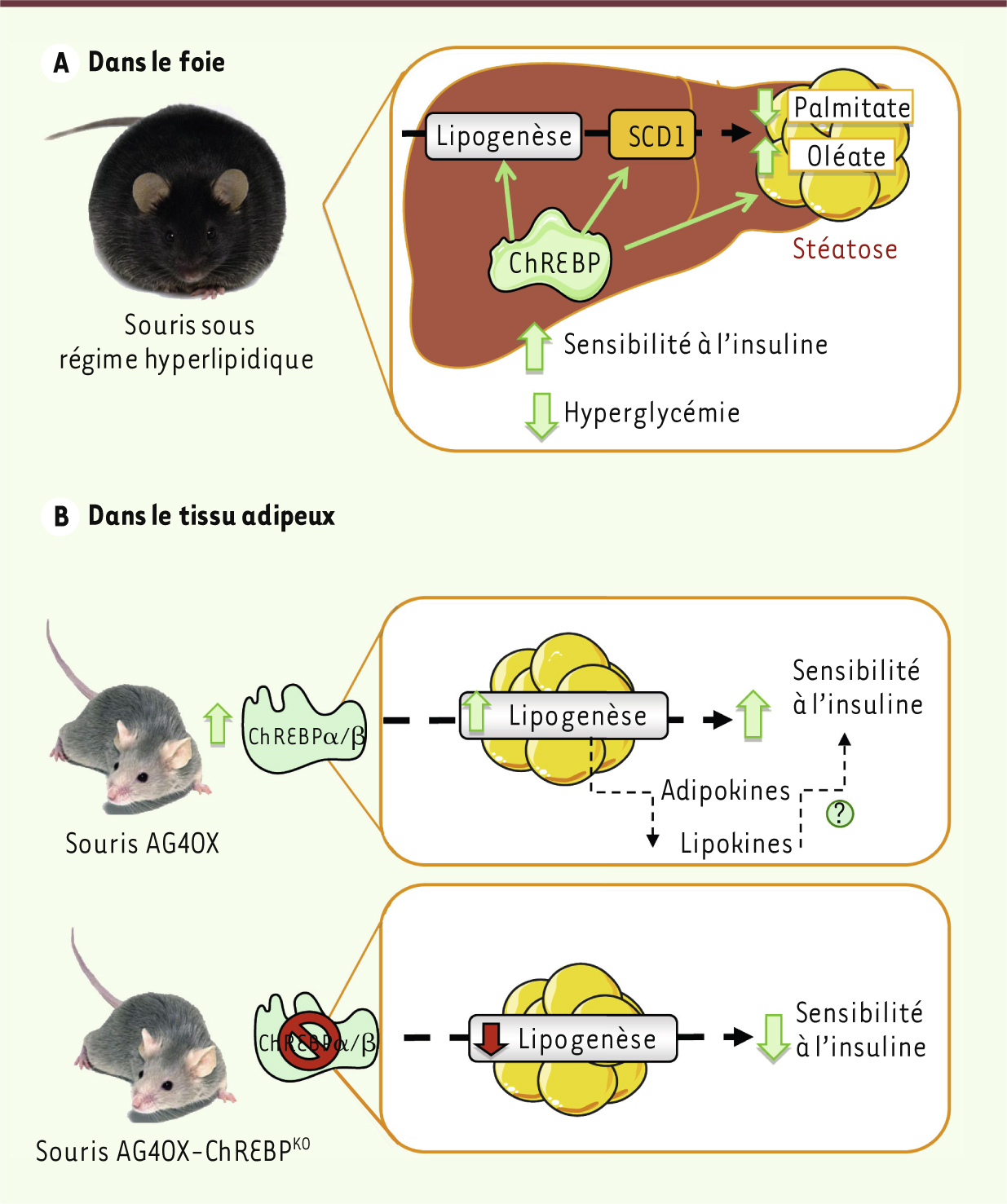
33] (→). La surexpression hépatique de ChREBP conduit également à une diminution de l’expression des gènes de la gluconéogenèse comme la phosphoénolpyruvate carboxykinase (PEPCK) et à une augmentation du pyruvate, indiquant une augmentation de la voie de la glycolyse. La modulation de ces paramètres explique la restauration de la glycémie [27] (Figure 4A).
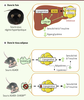 | Figure 4.
Conséquences de la modulation de l’expression de ChREBP dans le foie et le tissu adipeux. A. La surexpression de ChREBP dans le foie de souris soumises à un régime riche en lipides conduit une amélioration de la sensibilité à l’insuline. La surexpression de ChREBP induit l’expression de la SCD1 conduisant à une modification de la nature des espèces lipidiques en faveur d’une augmentation des acides gras mono-insaturés (MUFA, oléate) au détriment des acides gras saturés (SFA, palmitate). Cette modification de la balance des acides gras permet de dissocier la stéatose hépatique de la résistance à l’insuline [ 27]. B. La surexpression du transporteur de glucose GLUT4 induit l’expression de ChREBP α et β dans le tissu adipeux de souris (souris AG4OX). L’induction de la lipogenèse qui en résulte est associée à un phénotype d’insulino-sensibilité. Le croisement des souris AG4OX avec des souris invalidées pour ChREBP (ChREBP KO) abolit les effets protecteurs sur la sensibilité à l’insuline [ 23]. |
(→) Voir l’article de A.D. Mancini et V. Poitout, page 715 de ce numéro
Chez l’Homme, les résultats concernant l’association entre ChREBP hépatique (α et β) et sensibilité/résistance à l’insuline sont encore plus complexes car très dépendants de la cohorte étudiée. Dans une première étude de patients obèses (BMI [body mass index] = 47,8), l’expression de ChREBP a été corrélée positivement à l’expression des gènes de la lipogenèse et à la stéatose hépatique. Cette étude ayant été publiée avant l’identification de ChREBPβ, les auteurs ne font donc pas la distinction entre les deux isoformes et n’établissent pas non plus de corrélation entre l’expression de ChREBP et la sensibilité à l’insuline [
29]. Dans une autre cohorte de sujets obèses (BMI = 38) et insulino-résistants (classés selon trois groupes : 1-glycémie < 120 mg/dl ; 2-glycémie comprise entre 120 et 140 mg/dl ; 3-glycémie > 140 mg/dl), une corrélation positive entre l’expression de ChREBPα (mais pas de ChREBPβ) et la sévérité de la résistance à l’insuline a pu être mise en évidence [
30]. L’étude de Eissing et collaborateurs [
31], quant à elle, rapporte une corrélation positive entre la résistance à l’insuline et l’expression de ChREBPβ dans le foie de sujets obèses et résistants à l’insuline (BMI = 54). Au contraire, il a été rapporté que l’expression de ChREBP était corrélée de manière négative à la résistance à l’insuline dans une cohorte de patients atteints de stéatohépatite (NASH) (BMI = 31) [23]. L’ensemble de ces études ne permet pas de conclure de manière claire à la contribution de ChREBP dans l’établissement de la résistance à l’insuline dans le foie chez l’Homme, ou au contraire dans sa protection. Le fait que les résultats soient si disparates en fonction du degré d’obésité et/ou de l’index de résistance à l’insuline souligne l’importance d’apporter des données complémentaires en étudiant d’autres cohortes de patients. |
Un rôle insulino-protecteur dans le tissu adipeux Si les résultats obtenus dans le foie sont difficiles à interpréter, un consensus d’association positive entre l’expression de ChREBP dans le tissu adipeux blanc et l’insulino-sensibilité du tissu adipeux a été obtenu. L’étude récente de Herman et collaborateurs [23], outre qu’elle identifie l’isoforme β de ChREBP, suggère qu’une activation de la lipogenèse dans le tissu adipeux améliore la sensibilité à l’insuline et la tolérance au glucose (Figure 4B). En effet, des souris surexprimant le transporteur de glucose GLUT4 dans le tissu adipeux blanc (AG4OX) développent une obésité dissociée d’une résistance à l’insuline. Chez les souris, l’expression de ChREBP est significativement augmentée dans le tissu adipeux blanc ; de manière intéressante, la sensibilité à l’insuline et la tolérance au glucose de ces souris sont améliorées par rapport aux souris témoins. De plus, lorsque les souris AG4OX sont croisées avec des souris invalidées pour ChREBP (AG4OX-ChREBPKO), la voie de la lipogenèse dépendante de ChREBP est abolie et l’effet bénéfique sur la sensibilité à l’insuline perdu, révélant le rôle protecteur de ChREBP dans ce phénotype. L’effet bénéfique sur la sensibilité à l’insuline pourrait être lié à la sécrétion d’adipokines et/ou de lipokines protectrices pour la signalisation insuline et dépendantes de la voie de la lipogenèse (Figure 4B). Les auteurs suggèrent que seule l’isoforme ChREBPβ serait prédictive de la sensibilité à l’insuline dans ce modèle. En effet, alors que l’expression de l’isoforme α n’est pas modifiée, une diminution très significative de l’expression de ChREBPβ a été observée dans le tissu adipeux de souris rendues insulino-résistantes par une alimentation riche en lipides [23]. Des études de cohortes ont pu mettre en évidence un lien entre l’expression de ChREBPβ dans le tissu adipeux blanc et la sensibilité à l’insuline chez l’Homme. En effet, une corrélation négative entre l’expression de ChREBPβ dans le tissu adipeux sous-cutané et l’indice de résistance à l’insuline a été observée pour des individus de corpulence identique (37,4 < BMI < 38,5) dans une cohorte d’adolescents pré-diabétiques [30]. De la même façon, une corrélation inverse entre l’expression de ChREBPβ dans le tissu adipeux viscéral de patients obèses (BMI = 51,4) et la résistance à l’insuline a pu être également mise en évidence [31]. Il est important de noter que si les corrélations sont nettes pour ChREBPβ dans ces deux études, elles le sont beaucoup moins pour ChREBPα. Néanmoins, dans le tissu adipeux de sujets normo-glycémiques, la sensibilité à l’insuline est corrélée de manière positive avec l’expression de ChREBP α et β dans l’étude de Herman et collaborateurs [23]. L’ensemble de ces études de cohortes met en évidence l’existence d’une corrélation positive entre l’expression de ChREBP (et en particulier celle de l’isoforme β) dans les tissus adipeux sous-cutanés et viscéraux de patients obèses et la sensibilité à l’insuline des patients. |
Le facteur de transcription ChREBP joue un rôle déterminant dans le maintien de l’homéostasie glucido-lipidique en relayant les effets du glucose sur ses gènes cibles impliqués dans le contrôle de la glycolyse et de la lipogenèse. Ses multiples voies de régulation par le métabolisme du glucose à travers notamment des modifications post-traductionnelles renforce la complexité de sa régulation par le glucose. Malgré son rôle majeur dans la synthèse des acides gras de novo par la voie de la lipogenèse, ChREBP semble associé à des effets protecteurs chez la souris dans le foie et le tissu adipeux et uniquement dans le tissu adipeux chez l’Homme. La contribution de ChREBP au développement de la résistance à l’insuline dans le foie de patients stéatosés et obèses reste cependant à déterminer. Enfin, la récente identification d’une nouvelle isoforme de ChREBP, ChREBPβ, ouvre des perspectives intéressantes quant à la compréhension de sa fonction et de sa régulation dans le tissu adipeux et le foie. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les auteurs souhaitent remercier l’ensemble des membres de l’équipe « signalisation de l’insuline et du glucose, glucotoxicité » de l’Institut Cochin (Inserm U1016) et en particulier T. Issad pour la représentation du modèle du LID/GRACE. A. Poupeau a reçu le soutien financier de la Région Île-de-France (CORDDIM) pendant sa thèse. Les auteurs remercient les soutiens financiers de l’équipe : ANR (Crisalis, ObeliP, Hepacol, JC), FRM, FP7 (Florinash), Ville de Paris et Servier.
|
1.
Donnelly
KL
,
Smith
CI
,
Schwarzenberg
SJ
, et al.
Sources of fatty acids stored in liver and secreted via lipoproteins in patients with nonalcoholic fatty liver disease . J Clin Invest.
2005; ; 115 : :1343.–1351. 2.
Byrne
CD
. Ectopic fat, insulin resistance and non-alcoholic fatty liver disease . Proc Nutr Soc.
2013; ; 14 mai : :1.–8. 3.
Filhoulaud
G
,
Guilmeau
S
,
Dentin
R
, et al.
Novel insights into ChREBP regulation and function . Trends Endocrinol Metab.
2013; ; 24 : :257.–268. 4.
Dentin
R
,
Pegorier
JP
,
Benhamed
F
, et al.
Hepatic glucokinase is required for the synergistic action of ChREBP and SREBP-1c on glycolytic and lipogenic gene expression . J Biol Chem.
2004; ; 279 : :20314.–20326. 5.
Iizuka
K
,
Bruick
RK
,
Liang
G
,
Horton
JD
,
Uyeda
K
. Deficiency of ChREBP reduces lipogenesis as well as glycolysis . Proc Natl Acad Sci USA.
2004; ; 101 : :7281.–7286. 6.
H
Yamashita
,
M. Takenoshita
,
M. Sakurai
, et al.
A glucose-responsive transcription factor that regulates carbohydrate metabolism in the liver . Proc Natl Acad Sci USA.
2001; ; 98 : :9116.–9121. 7.
Ma
L
,
Tsatsos
NG
,
Towle
HC
. Direct role of ChREBP/Mlx in regulating hepatic glucose-responsive genes . J Biol Chem.
2005; ; 280 : :12019.–12027. 8.
Kawaguchi
T
,
Takenoshita
M
,
Kabashima
T
,
Uyeda
K
. Glucose and cAMP regulate the L-type pyruvate kinase gene by phosphorylation dephosphorylation of the ChREBP . Proc Natl Acad Sci USA.
2001; ; 98 : :13710.–13715. 9.
MV
Li
,
W
Chen
,
N
Poungvarin
, et al.
Glucose-mediated transactivation of carbohydrate response element-binding protein requires cooperative actions from Mondo conserved regions and essential trans-acting factor 14–3-3 . Mol Endocrinol.
2008; ; 22 : :1658.–1672. 10.
Kabashima
T
,
Kawaguchi, T
,
Wadzinski
BE
,
Uyeda
K
. Xylulose 5-phosphate mediates glucose-induced lipogenesis by xylulose 5-phosphate-activated protein phosphatase in rat liver . Proc Natl Acad Sci USA.
2003; ; 100 : :5107.–5112. 11.
Dentin
R
,
Tomas-Cobos
L
,
Foufelle
F
, et al.
Glucose 6-phosphate, rather than xylulose 5-phosphate, is required for the activation of ChREBP in response to glucose in the liver . J Hepatol.
2012; ; 56 : :199.–209. 12.
Li
MV
,
Chen
W
,
Harmancey
RN
, et al.
Glucose-6-phosphate mediates activation of the ChREBP . Biochem Biophys Res Comm.
2010; ; 395 : :395.–400. 13.
Li
M
,
Chang
B
,
Imamura
M
,
Poungvarin
N
,
Chan
L
. Glucose-dependent transcriptional regulation by an evolutionarily conserved glucose-sensing module . Diabetes.
2006; ; 55 : :1179.–1189. 14.
lizuka
K
,
Horikawa
Y
. Regulation of lipogenesis via BHLHB2/DEC1 and ChREBP feedback looping . Biochem Biophys Res Commun.
2008; ; 374 : :95.–100. 15.
Bricambert
J
,
Miranda
J
,
Benhamed
F
, et al.
Salt-inducible kinase 2 links transcriptional coactivator p300 phosphorylation to the prevention of ChREBP-dependent hepatic steatosis in mice . J Clin Invest.
2010; ; 120 : :4316.–4331. 16.
Guinez
C
,
Filhoulaud
G
,
Benhamed
F
, et al.
O-GlcNAcylation increases ChREBP protein content and transcriptional activity in the liver . Diabetes.
2011; ; 60 : :1399.–1413. 17.
Sakiyama
H
,
Fujiwara
N
,
Noguchi
T
, et al.
The role of O-linked GlcNAc modification on the glucose response of ChREBP . Biochem Biophys Res Commun.
2010; ; 402 : :784.–789. 18.
Issad
T
,
Kuo
M
. O-GlcNAc modification of transcription factors, glucose sensing and glucotoxicity . Trends Endocrinol Metab.
2008; ; 19 : :380.–389. 19.
Kuo
M
,
Zilberfarb
V
,
Gangneux
N
, et al.
O-glycosylation of FoxO1 increases its transcriptional activity towards the glucose 6-phosphatase gene . FEBS Lett.
2008; ; 582 : :829.–834. 20.
Housley
MP
,
Rodgers
JT
,
Udeshi
ND
, et al.
O-GlcNAc regulates FoxO activation in response to glucose . J Biol Chem.
2008; ; 283 : :16283.–16292. 21.
Dentin
R
,
Hedrick
S
,
Xie
J
, et al.
Hepatic glucose sensing via the CREB coactivator CRTC2 . Science.
2008; ; 319 : :1402.–1405. 22.
Housley
MP
,
Udeshi
ND
,
Rodgers
JT
, et al.
A PGC-1alpha-O-GlcNAc transferase complex regulates FoxO transcription factor activity in response to glucose . J Biol Chem.
2009; ; 284 : :5148.–5157. 23.
Herman
MA
,
Peroni
OD
,
Villoria
J
, et al.
A novel ChREBP isoform in adipose tissue regulates systemic glucose metabolism . Nature.
2012; ; 484 : :333.–338. 24.
Sun
Z
,
Lazar
MA
. Dissociating fatty liver and diabetes . Trends Endocrinol Metab.
2013; ; 24 : :4.–12. 25.
Dentin
R
,
Benhamed
F
,
Hainault
I
, et al.
Liver-specific inhibition of ChREBP improves hepatic steatosis and insulin resistance in ob/ob mice . Diabetes.
2006; ; 55 : :2159.–2170. 26.
Iizuka
K
,
Miller
B
,
Uyeda
K
. Deficiency of a carbohydrate-activated transcription factor ChREBP prevents obesity and improves plasma glucose control in leptin deficient (ob/ob) mice . Am J Physiol.
2006; ; 291 : :E358.–E364. 27.
Benhamed
F
,
Denechaud
PD
,
Lemoine
M
, et al.
The lipogenic transcription factor ChREBP dissociates hepatic steatosis from insulin resistance in mice and humans . J Clin Invest.
2012; ; 122 : :2176.–2194. 28.
Cherniske
EM
,
Carpenter
TO
,
Klaiman
C
, et al.
Multisystem study of 20 older adults with Williams syndrome . Am J Med Genet A.
2004; ; 131 : :255.–264. 29.
Hurtado del Pozo
C
,
Vesperinas-Garcia
G
,
Rubio
MA
, et al.
ChREBP expression in the liver, adipose tissue and differentiated preadipocytes in human obesity . Biochim Biophys Acta.
2011; ; 1811 : :1194.–1200. 30.
Kursawe
R
,
Caprio
S
,
Giannini
C
, et al.
Decreased transcription of ChREBP-alpha/beta isoforms in abdominal subcutaneous adipose tissue of obese adolescents with prediabetes or early type 2 diabetes : associations with insulin resistance and hyperglycemia . Diabetes.
2013; ; 62 : :837.–844. 31.
Eissing
L
,
Scherer
T
,
Todter
K
, et al.
De novo lipogenesis in human fat, liver is linked to ChREBP-beta, metabolic health . Nat Commun.
2013; ; 4 : :1528.. 32.
Flamment
M
,
Foufelle
F
. Le stress du réticulum endoplasmique : de la physiologie à la pathogenèse du diabète de type 2 . Med Sci (Paris).
2013; ; 29 : :756.–764. 33.
Mancini
AD
,
Poitout
V
. Les récepteurs membranaires des acides gras de la cellule b : de nouvelles cibles thérapeutiques pour le traitement du diabète de type 2 . Med Sci (Paris).
2013; ; 29 : :715.–721. |