| |
| Med Sci (Paris). 2013 August; 29(8-9): 736–743. Published online 2013 September 5. doi: 10.1051/medsci/2013298012.Différenciation des cellules souches pluripotentes en cellules pancréatiques
Josué Kunjom Mfopou1* and Luc Bouwens1 1Unité de différenciation cellulaire, Centre de recherche sur le diabète, Vrije Universiteit Brussel (VUB), Laarbeeklaan 103, 1090Bruxelles, Belgique |
Les cellules souches pluripotentes sont actuellement représentées par deux grands groupes : les cellules souches embryonnaires (ESC, embryonic stem cells) et les cellules pluripotentes induites (iPSC, induced pluripotent stem cells). Elles sont essentiellement caractérisées par leur prolifération illimitée en tant que cellules souches d’une part, et leur capacité à générer les dérivés des trois couches germinales (endoderme, ectoderme, mésoderme) d’autre part [
1,
2]. Ces deux propriétés sont à la base de l’intérêt accordé de nos jours à la différenciation guidée de cellules souches en cellules différenciées fonctionnelles capables de remplacer les cellules défaillantes dans diverses maladies humaines, y compris le diabète sucré au cours duquel les cellules β sécrétrices d’insuline sont détruites dans le pancréas (diabète de type 1) ou fonctionnellement insuffisantes (diabète de type 2). L’utilisation de cellules β pancréatiques dérivées de cellules souches pluripotentes humaines constitue donc une vraie approche émergente pour le traitement du diabète, à condition que la première phase, qui consiste en la différenciation in vitro, s’opère de manière efficace [
3]. Plusieurs études visant à identifier les cellules souches/progénitrices résidant dans le pancréas, ou à induire la régénération de cellules β in situ demeurent non concluantes et parfois même contradictoires [
4-
6,
49,
50] (→).
(→) Voir les articles de B. Duvillié, et de A. Vieira et al., pages 744 et 749 de ce numéro
En revanche, les cellules souches pluripotentes ont permis une avancée considérable au cours des dix dernières années, ce qui nous rapproche de manière significative d’une application clinique [3,
7,
8]. Ce succès est en grande partie attribué à l’accumulation d’informations de base concernant le développement embryonnaire du pancréas (Tableau I) [
9-
11] et à leur implémentation (bien que partielle) dans la différenciation cellulaire in vitro, avec comme résultat la production de progéniteurs pancréatiques. Cependant, malgré ces véritables avancées, il n’est toujours pas possible d’induire la différenciation de cellules β fonctionnelles in vitro, bien que celles-ci ont été obtenues in vivo après transplantation de progéniteurs chez la souris. Nous allons exposer les grandes lignes soutenant ces avancées en nous limitant principalement aux cellules souches pluripotentes humaines, et en faisant état de l’expérience de notre laboratoire dans ce domaine.
Tableau I.
| Stades |
Facteurs |
Sources |
Fonctions |
|
Spécification
(E8,5-9,5) |
Wnt |
Mésoderme |
Inhibe intestin antérieur, pancréas, foie |
| Shh, Ihh, Dhh |
Endoderme |
Antipancréatique |
| Activine B, FGF2 |
Notochorde |
Réprime Hedgehog, propancréatique |
| Noggin |
Dmes |
Réprime BMP (Dend), propancréatique |
| FGF – BMP |
Cmes, LPM |
Prohépatique/antipancréatique (Vend) |
| RA |
LPM, Dmes |
Modèle intestin, induit Pdx1 et bourgeon pancréas |
|
|
Expansion
(E9,5-12,5) |
VEGF-A |
Aorte dorsale |
Induction Pdx1, Insuline, Ptf1a |
| FGF1-7-10 |
Pmes |
Prolifération épithélium, branchage |
| GCG |
Cellules α |
Induction cellule β de la transition primaire |
| EGF, bêtacelluline |
Pepi |
Prolifération épithélium, proendocrinien ? |
|
|
Différenciation
(E12,5-E15,5) |
Delta, Jagged |
Pnep |
Anti-endocrinien, prolifération progéniteurs |
| Activine A, B |
Endocrine |
Antiexocrine, proendocrinien (via Ngn3) |
| BMP4-5-7 |
– |
Différenciation cellule β ? |
| TGFβ1-2-3 |
Pepi, acini |
Proendocrinien, architecture îlots |
| RA |
Pmes |
Proendocrinien (induction Ngn3) |
| HGF |
Pmes, Pepi |
Différenciation cellule β |
| GDF11 (BMP11) |
Pepi |
Proendocrinien (régulation Ngn3) |
| Follistatine |
Pmes |
Proexocrine, anti-endocrinien |
| Wnt (7 membres) |
Pmes |
Contrôle prolifération ? |
|
|
Maintenance et fonction
(> E15,5) |
VEGF-A |
Îlots |
Vaisseaux dans îlots, fenestration endothélium |
| GDF11 (BMP11) |
Acini |
Proendocrinien ? |
| HB-EGF |
Canaux, îlots |
Architecture îlots ? |
| EGF, bêtacelluline |
– |
Prolifération cellule β ? |
| GCG, Glp1 |
Cellules α |
Procellule β, synthèse insuline |
| IHH |
Îlots |
Expression Pdx1 et insuline |
| Wnt |
– |
Croissance pancréas postnatal |
Facteurs de croissance impliqués dans le développement du pancréas. Le développement du pancréas est un processus très complexe et séquentiel, avec l’intervention de nombreux facteurs de croissance issus des structures avoisinantes ou du pancréas lui-même. Il serait utopique de penser à une intégration compléte de toutes ces informations dans la différenciation des ESC/iPSC en cellules pancréatiques, mais ses grandes lignes permettent actuellement de générer des progéniteurs pancréatiques de manière assez efficace. Pour une lecture plus approfondie, voir [ 9,
10]. Cmes : mésoderme cardiaque ; LPM : lame mésodermique latérale ( lateral plate mesoderm) ; Dmes : mésenchyme dorsal ; Pmes: mésenchyme pancréatique ; Pnep : progéniteurs endocriniens Ngn3-positifs ( pancreatic Ngn3-positive endocrine progenitor) ; Pepi : épithélium pancréatique ; RA : acide rétinoïque ; GCG : gène du proglucagon ; Glp1 : glucagon-like peptide 1 ; IHH : indian hedgehog. HB-EGF : heparin binding epidermal growth factor ; HGF : hepatocyte growth factor ; VEGF : vascular endothelial growth factor ; BMP : bone morphogenetic protein ; FGF : fibroblast growth factor ; TGF : transforming growth factor. Delta et Jagged sont des ligands des récepteurs Notch. |
|
Induction de l’endoderme définitif et des progéniteurs pancréatiques Les toutes premières études visant à produire des cellules pancréatiques à partir des ESC se sont heurtées à un très faible taux de réussite, en partie lié à la nature des modèles utilisés (corps embryoïdes ou EB, embryoid bodies), lesquels autorisent une différenciation stochastique et non synchronisée [
12,
13]. En se fondant sur les connaissances du développement embryonnaire du pancréas, des efforts ont été mis en œuvre pour initialement produire la couche germinale dont il est le dérivé, l’endoderme définitif (DE, definitive endoderm). À la suite des travaux réalisés un an auparavant avec les ESC de souris, D’Amour et al. [
14] ont démontré en 2005 que les ESC humaines stimulées en culture monocouche avec de l’activine A (ActA), une molécule de la famille des TGFβ (transforming growth factor β), se différencient préférentiellement en endoderme définitif [14,
15]. Ces résultats confirmaient le rôle précédemment assigné à ces molécules dans le développement de l’endoderme définitif chez les petits vertébrés, comme le poisson zèbre et la grenouille [
16,
17]. La voie de signalisation induite par l’ActA s’est révélée incontournable dans la dérivation de l’endoderme définitif à partir de différentes lignées ESC et iPSC. Sa combinaison avec le Wnt3a (wingless-type MMTV integration site family, member 3A), BMP4 (bone morphogenetic protein 4), FGF2 (fibroblast growth factor 2), VEGF (vascular endothelial growth factor) ou d’autres molécules de synthèse augmente considérablement son efficacité [3, 7, 8,
18]. Nous avons récemment démontré qu’au cours de l’induction de l’endoderme définitif, l’utilisation du sérum animal peut être abandonnée et remplacée par une stimulation temporelle de la voie MAPK (mitogen-activated protein kinase) par du FGF2. Cette approche permet d’envisager des modèles de différenciation qui sont cliniquement applicables et sans risque de transmission de zoonoses aux patients [
19]. L’équipe du Dr Baetge fut pionnière dans la détermination des combinaisons de facteurs de croissance et de molécules de synthèse permettant d’obtenir in vitro les différentes phases de développement pancréatique à partir de l’endoderme définitif dérivé des ESC [
20]. Cette technique a été progressivement raffinée par plusieurs autres investigateurs. Il apparaît actuellement que l’inhibition de la voie Hedgehog et de la voie TGFβ/BMP, ainsi que l’activation de la voie rétinoïde et de la voie FGF, sont fondamentales pour l’induction du lignage pancréatique à partir de l’endoderme définitif [
21-
27]. Nous avons à ce titre démontré que l’endoderme définitif dérivé de plusieurs lignées ESC est au minimum bipotent, avec la capacité de produire des cellules hépatiques ou des cellules pancréatiques en fonction du niveau d’activation de la voie BMP [
24]. C’est dire que les prérequis élémentaires pour une différenciation des cellules du lignage pancréatique sont actuellement connus et implémentés in vitro pour efficacement produire des progéniteurs pancréatiques (Figure 1) [3, 7]. Néanmoins, des différences persistent dans la capacité de lignées distinctes d’ESC ou d’iPSC à engendrer un type cellulaire particulier avec un modèle de différenciation donné [
25,
28], et la différenciation de cellules β fonctionnelles n’est actuellement toujours pas démontrée in vitro.
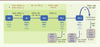 | Figure 1.
Modèles de différenciation des progéniteurs pancréatiques développés dans notre laboratoire. L’activation de la voie TGFβ est requise pour induire l’endoderme définitif, en combinaison avec l’activation de la voie Wnt ou FGF. Dans le deuxième cas, le sérum animal peut être éliminé de la procédure. L’inhibition des voies Hedgehog et BMP couplée à l’activation des voies rétinoïde et FGF permettent d’induire les progéniteurs pancréatiques (PDX1 + NKX6.1 +). L’implantation des progéniteurs pancréatiques en sous-cutané chez la souris donne lieu à une différenciation progressive vers le lignage endocrinien (NGN3 +). Les progéniteurs pancréatiques peuvent également être amplifiés in vitro avant leur différenciation en cellules pro-endocriniennes par inhibition de la voie Notch et activation de la voie rétinoïde (RA). A. Modèle initial permettant de réduire considérablement la différenciation vers le lignage hépatique [ 24]. B. Différenciation suivant le modèle A. et mise en évidence de la progression des progéniteurs pancréatiques type 1 (PP-1) vers le type 2 (PP-2) après transplantation chez la souris immunodéficiente NOD/SCID [
36]. C. Modèle révisé avec élimination du sérum pendant l’induction de l’endoderme définitif et mise en évidence de la différenciation endocrinienne in vivo [ 19]. D. Facteurs régulant la prolifération in vitro des PP-2 et leur différenciation en cellules pro-endocriniennes. Les facteurs de transcription permettant de marquer les différents lignages cellulaires sont mentionnés en bleu. ActA : activine A ; B27 : supplément B27 ; CpdE : inhibiteur de la voie Notch ; CY : cyclopamine ; DE : endoderme définitif ; ESC : cellules souches embryonnaires ; EX4 : exendine-4 ; NG : noggin ; PFG : portion caudale de l’intestin antérieur ; PP-1 et PP-2 : progéniteurs pancréatiques de type 1 (exprimant essentiellement PDX1) et de type 2 (exprimant PDX1 et NKX6.1) ; RA : acide rétinoïque ; SB : SB431542. |
|
Identité des progéniteurs pancréatiques induits in vitro et différenciation in vivo
Au cours du développement embryonnaire murin et humain, le facteur de transcription Pdx1 (pancreatic and duodenal homeobox 1) marque le domaine de l’endoderme destiné à devenir pancréatique, et l’absence de son gène entraîne une agénésie du pancréas [
29]. L’expression de Pdx1 étant plus étendue que le domaine pancréatique, c’est uniquement sa combinaison avec d’autres facteurs (Nkx6.1, Ptf1a [pancreas transcription factor 1a], Sox9 [(sex determining region y)-box 9], Hnf6 [hepatocyte nuclear factor 6] et Foxa2 [forkhead box A2]) qui définit le progéniteur pancréatique de manière indéniable [9]. Les travaux récents cherchent à démontrer la nature pancréatique des cellules PDX1-positives dérivées des ESC/iPSC en les marquant en plus avec un anticorps dirigé contre l’un des autres facteurs. Cependant, les limites actuelles des techniques d’immunofluorescence ne permettent pas une démonstration absolue de cette nature pancréatique in vitro, laquelle est seulement supposée sur la base de différentes analyses combinées [3,
30]. Néanmoins, ces techniques montrent que les modèles actuels de différenciation produisent des populations cellulaires fortement hétérogènes [
31], ce qui expliquerait la difficulté à générer in vitro de véritables cellules β disposant d’un système fonctionnel de sécrétion d’insuline induite par le glucose. Il est nécessaire que les cellules β générées in vitro disposent de ce système qui seul est en mesure de contrôler la glycémie de manière physiologique. Il est donc vraisemblable que les cellules productrices d’insuline détectées in vitro jusqu’alors, qui restent insensibles ou très peu sensibles à la stimulation par le glucose [20,
23, 25, 27,
32,
33], sont semblables à celles décrites au cours de la première transition du développement pancréatique dans l’embryon. La difficulté à obtenir in vitro des cellules β fonctionnelles, à l’instar de celles qui existent dans le pancréas humain, traduit le manque de connaissances exactes sur les dernières phases du développement des cellules endocrines du pancréas. Cette situation pourrait engendrer un doute quant à la nature pancréatique des progéniteurs PDX1-positifs obtenus in vitro par différenciation à partir des ESC/iPSC. Pour contourner cette difficulté, plusieurs investigateurs ont implanté les cellules PDX1-positives chez la souris et ont ainsi démontré que les dernières phases de la différenciation endocrine se poursuivent normalement après la transplantation, et nécessitent en général pas moins de douze semaines [
22,
26,
34], ce qui va de pair avec la cinétique du développement embryonnaire humain. Dans ces études, une augmentation des taux d’insuline ou de peptide-C humain a été détectée dans la circulation en réponse à une injection de glucose, et les souris ainsi traitées ont pu résister à l’effet diabétogène de la streptozotocine, une substance chimique toxique pour les cellules β des petits rongeurs [22,
35]. Notre expérience dans ce domaine montre que le site de transplantation peut avoir une influence considérable sur le devenir des cellules implantées, et que l’espace sous-cutané offre des avantages bénéfiques pour une application clinique (Tableau II) [36]. Toutes ces données permettent d’envisager la production de masse et la transplantation clinique de progéniteurs pancréatiques encapsulés qui pourront ainsi poursuivre leur différenciation en cellules β chez le patient diabétique tout en restant à l’abri des réactions immunitaires [34,
37]. Nous suivons également une autre piste de recherche qui vise à identifier les conditions requises pour amplifier les progéniteurs pancréatiques in vitro avant leur transplantation [31,
38].
Tableau II.
| Composition |
Site |
Moyen terme 2 semaines |
Long terme |
> 6 semaines |
| Formation cartilagineuse |
Épididyme |
0/3* |
0% |
5/9 |
56% |
| Sous-cutané |
0/5 |
0% |
0/10 |
0% |
|
| Cellules PDX1+
|
Épididyme |
2/3 |
67% |
0/9 |
0% |
| Sous-cutané |
5/5 |
100% |
10/10 |
100% |
|
| Cellules PDX1+ NKX6.1+
|
Épididyme |
0/3 |
0% |
0/9 |
0% |
| Sous-cutané |
0/5 |
0% |
5/10 |
50% |
Influence du site de transplantation sur le devenir des progéniteurs pancréatiques à moyen et à long terme. Les greffons préparés à partir de cellules PDX1 + dérivées de ESC humaines étaient transplantés dans le tissu adipeux épididymaire ou dans l’espace sous-cutané. Le nombre et le pourcentage de greffons avec une composition donnée étaient évalués deux semaines et plus de six semaines après la transplantation. *Nombre de greffons positifs pour la composition indiquée/nombre total d’animaux greffés. Le pourcentage de positivité est indiqué dans la colonne suivante. Pour plus d’informations, voir [ 36]. |
|
Marqueurs de surface pour la sélection des progéniteurs pancréatiques Les modèles de différenciation actuels ne permettent pas la production de cultures homogènes de progéniteurs pancréatiques. Des cellules non ou peu différenciées persistent et sont parfois initiatrices de tératomes après leur transplantation in vivo [22, 30, 35, 36]. La sélection de progéniteurs pancréatiques ou de cellules β devra donc représenter un axe majeur de recherche pour les prochaines années, et le succès dans ce domaine dépendra de l’existence de véritables marqueurs de surface spécifiques à ces cellules. Selon les travaux récents, les marqueurs CD24 (ou HSA, heat stable antigen), CD142 (ou facteur tissulaire), FZD3 (frizzled family receptor 3), GPCR50 (G protein-coupled receptor 50) et MMP16 (matrix metalloproteinase 16) sont exprimés par les cellules PDX1-positives, alors que CD200 (OX2) et CD318 (CUB domain-containing protein 1) le sont par les cellules endocrines [30,
39,
40]. Même si les premiers travaux ont démontré l’absence de tératome après transplantation de cellules CD142+ [30], la spécificité de certains de ces marqueurs n’a pas été confirmée par d’autres chercheurs [39,
41]. |
La place des molécules de synthèse dans la génération de progéniteurs pancréatiques La différenciation des ESC/iPSC en cellules pancréatiques se base sur le modèle de développement embryonnaire et utilise principalement des protéines recombinantes pour activer ou bloquer les récepteurs exprimés par les cellules en culture. Il se trouve que certaines de ces protéines ont un coût très onéreux ou présentent une faible stabilité dans le milieu de culture, ce qui préfigure de très gros efforts financiers pour la production de masse de progéniteurs pancréatiques et de cellules β en vue d’une application clinique. Au contraire des protéines recombinantes, les molécules de synthèse sont en général bon marché et leur stabilité est acceptable. Au cours des dernières années, quelques plate-formes de criblage de molécules de synthèse ont été mises sur pied, et les efforts consentis ont permis l’identification des composés qui activent ou inhibent les mêmes voies de signalisation que certaines protéines recombinantes. Tel est le cas de l’IDE1 et de l’IDE2 (inducer of definitive endoderm-1 et -2) qui permettent de dériver l’endoderme définitif à partir des ESC/iPSC en stimulant les effecteurs SMAD2/3 de la voie TGFβ [18]. La protéine recombinante Wnt3a a également été remplacée avec succès par les inhibiteurs de la GSK3β (glycogen synthase kinase 3β) [23,
42,
43]. D’autres molécules comme la wortmanine et le butyrate de sodium ont été utilisées en complément de l’activine-A pour induire l’endoderme définitif in vitro [21,
44]. Pour induire la différenciation des ESC/iPSC en progéniteurs pancréatiques et endocriniens, usage est fait de plusieurs molécules de synthèse dont la cyclopamine (inhibiteur de la voie Hedgehog), la dorsomorphine (inhibiteur de BMP), le SB431542 (inhibiteur de la voie TGFβ), l’inhibiteur de la FAK (focal adhesion kinase) et l’(-)-indolactam V [3]. Même si les données de la littérature montrent que les cellules pancréatiques n’ont pas encore été dérivées dans une « soupe chimique » au sens propre, les efforts actuels devraient porter sur des sytèmes utilisant le plus de molécules de synthèse et le moins de protéines recombinantes possible pour induire la différenciation de ces précurseurs pancréatiques. |
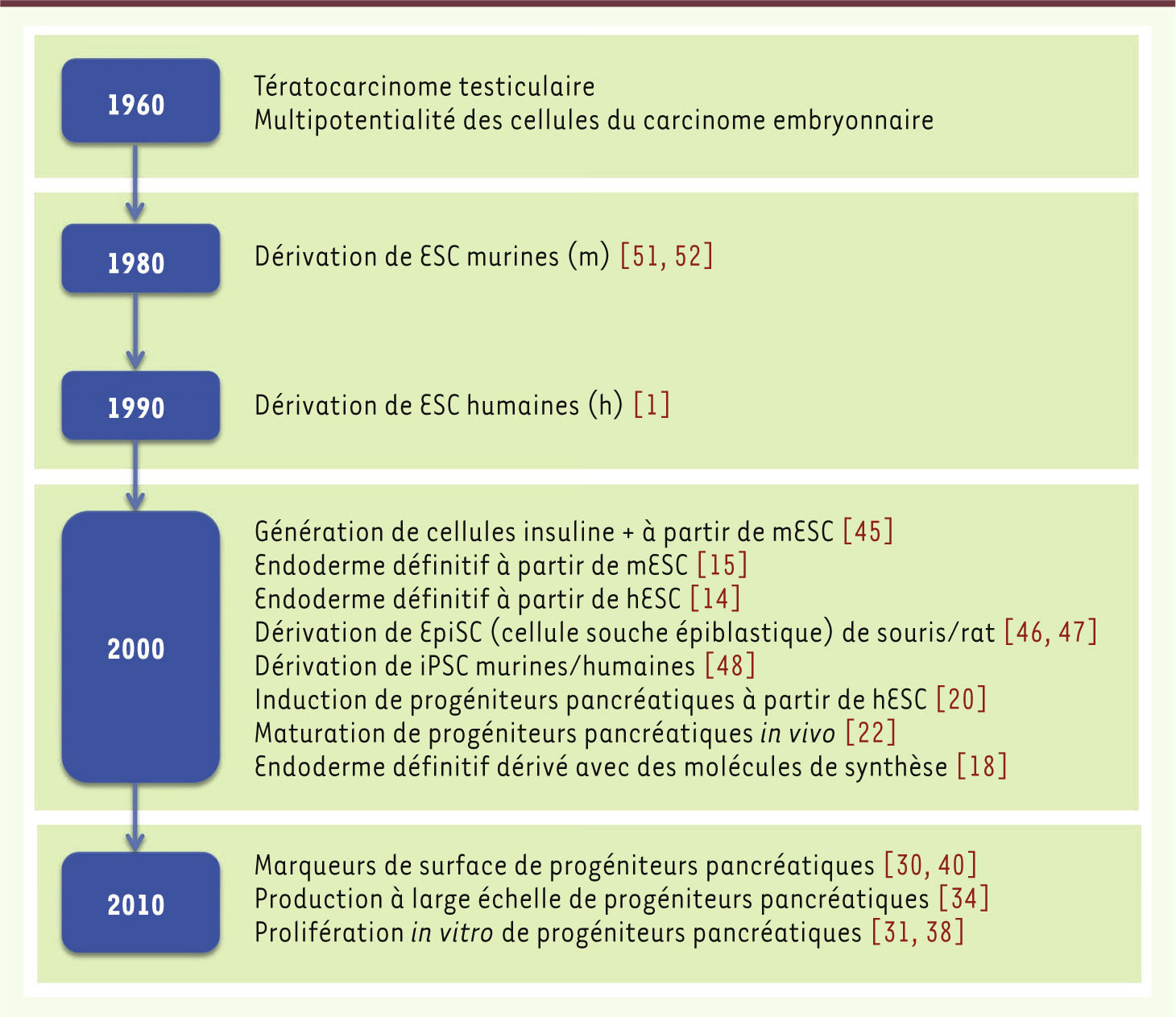
Conclusion et perspectives La recherche fondamentale qui vise à élucider les mécanismes de développement du pancréas a connu un essor considérable au cours des vingt dernières années. Elle a beaucoup bénéficié des nouvelles techniques de transgenèse appliquées à la souris. Outre ces connaissances, la biologie du développement a vu son horizon se transformer et s’élargir avec la dérivation de cellules souches pluripotentes. En effet, la nécessité de trouver de nouvelles alternatives aux sources actuelles de cellules humaines utilisées pour traiter certaines maladies a abouti à des avancées scientifiques majeures, que traduit l’explosion au cours des dix dernières années de travaux visant à guider la différenciation des cellules souches (Figure 2). À ce titre, il est aujourd’hui largement admis que les ESC/iPSC représentent une source intarissable de cellules aux fonctions particulières, à condition de guider efficacement leur différenciation in vitro en suivant le modèle du développement embryonnaire. Ceci constitue un enjeu majeur en ce qui concerne le traitement du diabète : les cellules β issues des ESC/iPSC pourront, dans les années à venir, remplacer les îlots de Langerhans qui, actuellement, proviennent de donneurs de pancréas dont le nombre diminue. Les résultats des recherches menées à travers le monde au cours des dix dernières années sont très encourageants et montrent qu’il est possible, en suivant le modèle du développement embryonnaire, d’arriver à cette fin. Les travaux à mener devront considérer l’étude approfondie des conditions requises pour la dérivation des cellules β fonctionnelles in vitro. Une des premières étapes devra être l’identification des facteurs pouvant efficacement convertir les progéniteurs pancréatiques en progéniteurs endocriniens. Dans l’un et l’autre cas, les modèles animaux de développement embryonnaire demeureront une source intarissable d’information et d’inspiration, alors que la différenciation des ESC/iPSC in vitro leur servira de champ d’application. Dans le même ordre d’idées, notre équipe utilise actuellement les données issues des recherches sur la différenciation pancréatique à partir des ESC/iPSC pour mieux explorer le potentiel des cellules exocrines du pancréas humain à être converties en cellules endocrines [50] (→).
 | Figure 2.
Historique du développement de la thérapie cellulaire du diabète à base de cellules souches pluripotentes. Le graphique présente uniquement les grands axes de recherche qui ont été décisifs dans le développement de la thérapie cellulaire du diabète à partir des cellules souches pluripotentes. À noter l’explosion des travaux au cours des dix dernières années, lesquels nous permettent de nous approcher de plus en plus des applications cliniques. |
(→) Voir l’article de A. Vieira et al., page 749 de ce numéro
Dans l’attente des résultats de tous ces axes de recherche, les premiers essais cliniques avec les progéniteurs pancréatiques encapsulés nous permettront de juger de la nécessité ou non de dériver absolument des cellules β fonctionnelles in vitro. Quoi qu’il en soit, l’on peut aujourd’hui affirmer avec plus d’assurance que le traitement du diabète à base de précurseur dérivés d’ESC/iPSC pourrait devenir réalité dans un avenir proche. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Thomson
JA
,
Itskovitz-Eldor
J
,
Shapiro
SS
, et al.
Embryonic stem cell lines derived from human blastocysts . Science.
1998; ; 282 : :1145.–1147. 2.
Takahashi
K
,
Tanabe
K
,
Ohnuki
M
, et al.
Induction of pluripotent stem cells from adult human fibroblasts by defined factors . Cell.
2007; ; 131 : :861.–872. 3.
Mfopou
JK
,
Chen
B
,
Sui
L
, et al.
Recent advances and prospects in the differentiation of pancreatic cells from human embryonic stem cells . Diabetes.
2010; ; 59 : :2094.–2101. 4.
Baeyens
L
,
Bouwens
L
. Cellular plasticity of the pancreas . Biol Chem.
2009; ; 390 : :995.–1001. 5.
Houbracken
I
,
Bouwens
L
. The quest for tissue stem cells in the pancreas and other organs, and their application in beta-cell replacement . Rev Diabet Stud.
2010; ; 7 : :112.–123. 6.
Scharfmann
R
. Du nouveau sur les cellules souches pancréatiques . Med Sci (Paris).
2004; ; 20 : :732.–734. 7.
Mfopou
JK
,
Bouwens
L
. Milestones of pancreatic beta cell differentiation from embryonic stem cells . Adv Gene Mol Cell Ther.
2007; ; 1 : :161.–171. 8.
Nostro
MC
,
Keller
G
. Generation of beta cells from human pluripotent stem cells: potential for regenerative medicine . Semin Cell Dev Biol.
2012; ; 23 : :701.–710. 9.
Gittes
GK
. Developmental biology of the pancreas: a comprehensive review . Dev Biol.
2009; ; 326 : :4.–35. 10.
Kim
SK
,
Hebrok
M
. Intercellular signals regulating pancreas development and function . Genes Dev.
2001; ; 15 : :111.–127. 11.
Grapin-Botton
A
. Les étapes du développement du pancréas : des pistes pour le traitement du diabète . Med Sci (Paris).
2002; ; 18 : :467.–473. 12.
Assady
S
,
Maor
G
,
Amit
M
, et al.
Insulin production by human embryonic stem cells . Diabetes.
2001; ; 50 : :1691.–1697. 13.
Segev
H
,
Fishman
B
,
Ziskind
A
, et al.
Differentiation of human embryonic stem cells into insulin-producing clusters . Stem Cells.
2004; ; 22 : :265.–274. 14.
D’Amour
KA
,
Agulnick
AD
,
Eliazer
S
, et al.
Efficient differentiation of human embryonic stem cells to definitive endoderm . Nat Biotechnol.
2005; ; 23 : :1534.–1541. 15.
Kubo
A
,
Shinozaki
K
,
Shannon
JM
, et al.
Development of definitive endoderm from embryonic stem cells in culture . Development.
2004; ; 131 : :1651.–1662. 16.
Osada
SI
,
Wright
CV
. Xenopus nodal-related signaling is essential for mesendodermal patterning during early embryogenesis . Development.
1999; ; 126 : :3229.–3240. 17.
Rodaway
A
,
Takeda
H
,
Koshida
S
, et al.
Induction of the mesendoderm in the zebrafish germ ring by yolk cell-derived TGF-beta family signals and discrimination of mesoderm and endoderm by FGF . Development.
1999; ; 126 : :3067.–3078. 18.
Borowiak
M
,
Maehr
R
,
Chen
S
, et al.
Small molecules efficiently direct endodermal differentiation of mouse and human embryonic stem cells . Cell Stems Cell.
2009; ; 4 : :348.–358. 19.
Sui
L
,
Mfopou
JK
,
Geens
M
, et al.
FGF signaling via MAPK is required early and improves activin A-induced definitive endoderm formation from human embryonic stem cells . Biochem Biophys Res Commun.
2012; ; 426 : :380.–385. 20.
D’Amour
KA
,
Bang
AG
,
Eliazer
S
, et al.
Production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells . Nat Biotechnol.
2006; ; 24 : :1392.–1401. 21.
Jiang
J
,
Au
M
,
Lu
K
, et al.
Generation of insulin-producing islet-like clusters from human embryonic stem cells . Stem Cells.
2007; ; 25 : :1940.–1953. 22.
Kroon
E
,
Martinson
LA
,
Kadoya
K
, et al.
Pancreatic endoderm derived from human embryonic stem cells generates glucose-responsive insulin-secreting cells in vivo
. Nat Biotechnol.
2008; ; 26 : :443.–452. 23.
Kunisada
Y
,
Tsubooka-Yamazoe
N
,
Shoji
M
,
Hosoya
M
. Small molecules induce efficient differentiation into insulin-producing cells from human induced pluripotent stem cells . Stem Cell Res.
2011; ; 8 : :274.–284. 24.
Mfopou
JK
,
Chen
B
,
Mateizel
I
, et al.
Noggin, retinoids, and fibroblast growth factor regulate hepatic or pancreatic fate of human embryonic stem cells . Gastroenterology.
2010; ; 138 : :2233.–2245. 25.
Nostro
MC
,
Sarangi
F
,
Ogawa
S
, et al.
Stage-specific signaling through TGFbeta family members and WNT regulates patterning and pancreatic specification of human pluripotent stem cells . Development.
2011; ; 138 : :861.–871. 26.
Rezania
A
,
Bruin
JE
,
Riedel
MJ
, et al.
Maturation of human embryonic stem cell-derived pancreatic progenitors into functional islets capable of treating pre-existing diabetes in mice . Diabetes.
2012; ; 61 : :2016.–2029. 27.
Zhang
D
,
Jiang
W
,
Liu
M
, et al.
Highly efficient differentiation of human ES cells and iPS cells into mature pancreatic insulin-producing cells . Cell Res.
2009; ; 19 : :429.–438. 28.
Osafune
K
,
Caron
L
,
Borowiak
M
, et al.
Marked differences in differentiation propensity among human embryonic stem cell lines . Nat Biotechnol.
2008; ; 26 : :313.–315. 29.
Stoffers
DA
,
Zinkin
NT
,
Stanojevic
V
, et al.
Pancreatic agenesis attributable to a single nucleotide deletion in the human IPF1 gene coding sequence . Nat Genet.
1997; ; 15 : :106.–110. 30.
Kelly
OG
,
Chan
MY
,
Martinson
LA
, et al.
Cell-surface markers for the isolation of pancreatic cell types derived from human embryonic stem cells . Nat Biotechnol.
2011; ; 29 : :750.–756. 31.
Sui
L
,
Geens
M
,
Sermon
K
, et al.
Role of BMP signaling in pancreatic progenitor differentiation from human embryonic stem cells . Stem Cell Rev Rep.
2013 ; DOI : 10.1007/s12015-013-9435-6. 32.
Jiang
W
,
Shi
Y
,
Zhao
D
, et al.
In vitro derivation of functional insulin-producing cells from human embryonic stem cells . Cell Res.
2007; ; 17 : :333.–344. 33.
Basford
CL
,
Prentice
KJ
,
Hardy
AB
, et al.
The functional and molecular characterisation of human embryonic stem cell-derived insulin-positive cells compared with adult pancreatic beta cells . Diabetologia.
2012; ; 55 : :358.–371. 34.
Schulz
TC
,
Young
HY
,
Agulnick
AD
, et al.
A scalable system for production of functional pancreatic progenitors from human embryonic stem cells . PLoS One.
2012; ; 7 : :e37004.. 35.
Eshpeter
A
,
Jiang
J
,
Au
M
, et al.
In vivo characterization of transplanted human embryonic stem cell-derived pancreatic endocrine islet cells . Cell Prolif.
2008; ; 41 : :843.–858. 36.
Sui
L
,
Mfopou
JK
,
Chen
B
, et al.
Transplantation of human embryonic stem cell-derived pancreatic endoderm reveals a site-specific survival, growth and differentiation . Cell Transplantation.
2012 ; DOI : http://dx.doi.org/10.3727/096368912X636812. 37.
Tuch
BE
,
Hughes
TC
,
Evans
MD
. Encapsulated pancreatic progenitors derived from human embryonic stem cells as a therapy for insulin-dependent diabetes . Diabetes Metab Res Rev.
2011; ; 27 : :928.–932. 38.
Sneddon
JB
,
Borowiak
M
,
Melton
DA
. Self-renewal of embryonic-stem-cell-derived progenitors by organ-matched mesenchyme . Nature.
2012; ; 491 : :765.–768. 39.
Fishman
B
,
Segev
H
,
Kopper
O
, et al.
Targeting pancreatic progenitor cells in human embryonic stem cell differentiation for the identification of novel cell surface markers . Stem Cell Rev.
2012; ; 8 : :792.–802. 40.
Jiang
W
,
Sui
X
,
Zhang
D
, et al.
CD24: a novel surface marker for PDX1-positive pancreatic progenitors derived from human embryonic stem cells . Stem Cells.
2011; ; 29 : :609.–617. 41.
Naujok
O
,
Lenzen
S
. A critical re-evaluation of CD24-positivity of human embryonic stem cells differentiated into pancreatic progenitors . Stem Cell Rev.
2012; ; 8 : :779.–791. 42.
Li
F
,
He
Z
,
Li
Y
, et al.
Combined activin A/LiCl/Noggin treatment improves production of mouse embryonic stem cell-derived definitive endoderm cells . J Cell Biochem.
2011; ; 112 : :1022.–1034. 43.
Sumi
T
,
Tsuneyoshi
N
,
Nakatsuji
N
,
Suemori
H
. Defining early lineage specification of human embryonic stem cells by the orchestrated balance of canonical Wnt/beta-catenin, activin/nodal and BMP signaling . Development.
2008; ; 135 : :2969.–2979. 44.
Phillips
BW
,
Hentze
H
,
Rust
WL
, et al.
Directed differentiation of human embryonic stem cells into the pancreatic endocrine lineage . Stem Cells Dev.
2007; ; 16 : :561.–578. 45.
Soria
B
,
Roche
E
,
Berná
G
, et al.
Insulin-secreting cells derived from embryonic stem cells normalize glycemia in streptozotocin-induced diabetic mice . Diabetes.
2000; ; 49 : :157.–162. 46.
Brons
IG
,
Smithers
LE
,
Trotter
MW
, et al.
Derivation of pluripotent epiblast stem cells from mammalian embryos . Nature.
2007; ; 448 : :191.–195. 47.
Tesar
PJ
,
Chenoweth
JG
,
Brook
FA
, et al.
New cell lines from mouse epiblast share defining features with human embryonic stem cells . Nature.
2007; ; 448 : :196.–199. 48.
Takahashi
K
,
Yamanaka
S
. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors . Cell.
2006;
126 : :663.–676. 49.
Duvillié
B
. Quelles cellules souches pour une réparation du pancréas endocrine ?
Med Sci (Paris).
2013; ; 29 : :744.–748. 50.
Vieira
A
,
Druelle
N
,
Courtney
M
, et al.
Reprogrammation des cellules pancréatiques en cellules β . Med Sci (Paris).
2013; ; 29 : :749.–755. 51.
Evans
MJ
,
Kaufman
MH
. Establishment in culture of pluripotential cells from mouse embryos . Nature.
1981; ; 292 : :154.–156. 52.
Martin
GR
. Isolation of pluripotent cell lines from early mouse embryos cultured in medium conditioned by teratocarcinomas stem cells . Proc Natl Acad Sci USA.
1981; ; 76 : :7634.–7638. |