| |
| Med Sci (Paris). 2013 August; 29(8-9): 691–693. Published online 2013 September 5. doi: 10.1051/medsci/2013298004.Implication de la flore fongique intestinale dans le développement de la maladie de Crohn Gautier Hoarau,1 Jean Frédéric Colombel,2 Daniel Poulain,1 and Boualem Sendid1* 1Inserm U995, université Lille 2, Faculté de médecine H. Warembourg, Pôle recherche, CHRU de Lille, place Verdun, 59037Lille, France 2Department of gastroenterology, Icahn school of medicine at Mount Sinai, New York, États-Unis MeSH keywords: Animaux, Anticorps antifongiques, analyse, Candida albicans, croissance et développement, Candidose, complications, Maladie de Crohn, immunologie, microbiologie, Champignons, Humains, Intestins, Métagénome, Saccharomyces cerevisiae |
La maladie de Crohn (MC) est une maladie inflammatoire chronique intestinale, touchant principalement les jeunes adultes [
1]. Sa prévalence est plus importante dans les pays industrialisés et son origine reste inconnue. Néanmoins, l’hypothèse la plus communément admise est qu’elle serait liée à une dérégulation de la réaction immunitaire muqueuse vis-à-vis d’un microbiote intestinal déséquilibré (dysbiose) sous l’influence de facteurs environnementaux (tabac, alimentation, etc.) et génétiques [1]. La flore intestinale contient une variété importante de microorganismes et joue un rôle prépondérant dans cet écosystème en maintenant une homéostasie. L’altération de cette flore pourrait être responsable d’un état de dysbiose [
2,
18] - qui désigne un déséquilibre entre la flore protectrice et la flore « pathogène » - favorisant la survenue de la maladie de Crohn. Les études métagénomiques ont permis de caractériser l’ensemble du microbiote bactérien intestinal, notamment les espèces non cultivables. Chez les patients atteints de maladie de Crohn, la diversité bactérienne est diminuée [2] (phylum des Bacteroidetes et des Firmicutes), ce qui pourrait favoriser l’implantation de souches d’Escherichia coli AIEC (adherent invasive Escherichia coli, E. coli LF82) [
3]. L’implication de Candida albicans, levure commensale du tube digestif et pathogène opportuniste, a été aussi suggérée dans le développement de la maladie, plusieurs études étayant cette hypothèse [
19]. |
Preuves cliniques de l’implication de la flore fongique dans la maladie de Crohn La colonisation de l’intestin par C. albicans [
4] est plus importante chez les patients atteints de maladie de Crohn et leurs parents sains du premier degré [4]. Le niveau de colonisation est également plus important durant la phase aiguë de la maladie [
5]. Par ailleurs, la prévalence d’anticorps dirigés contre les fragments glycanniques de la paroi des champignons (anti-Saccharomyces cerevisiae, ASCA ; anti-laminaribioside, ALCA ; anti-chitobioside, ACCA) ou certains antigènes bactériens (I2, OmpC, CBir1) est élevée dans le sérum des patients atteints de maladie de Crohn et leurs parents sains [4]. Le nombre et l’amplitude de ces biomarqueurs seraient corrélés à la sévérité de la maladie [
6,
7]. Par ailleurs, il existe une immunité muqueuse (IgA sécrétoires) vis-à-vis de ces mêmes fragments glycanniques [
8]. De façon anecdotique, on a pu observer empiriquement l’amélioration des symptômes de la maladie sous traitement antifongique. Par exemple, Samuel et al. [
9] rapportent une amélioration de la symptomatologie digestive de patients atteints de maladie de Crohn traités par itraconazole pour une histoplasmose. Il reste cependant à explorer l’origine de cet effet : est-il lié à une réduction de la flore fongique ou à un autre mécanisme (anti-inflammatoire/anti-angiogénique). Ces données témoignent, au moins partiellement, de l’implication de la flore fongique dans le déséquilibre immunitaire menant à une réaction inflammatoire non contrôlée. |
Preuves expérimentales de l’implication de la flore fongique dans la maladie de Crohn Un modèle murin de colite chimio-induite a suggéré l’activité pro-inflammatoire de C. albicans, liée à son implantation dans l’intestin. Inversement, l’inflammation intestinale augmente la colonisation par C. albicans [
10]. Par ailleurs, il existe une intrication forte entre le mycobiome intestinal et l’hôte par le biais de l’immunité innée. En effet, la susceptibilité génétique de l’hôte à la colonisation par C. albicans est variable, ce qui suggère la notion d’inégalité immunogénétique. En particulier, l’absence de récepteurs aux lectines (Dectin-1) favoriserait le développement d’une colite dans un modèle murin, amélioré par ailleurs par l’administration d’un traitement antifongique [
11]. D’autres polymorphismes génétiques ont été identifiés chez les patients atteints de maladie de Crohn. Il s’agit principalement des gènes PRR (pathogen recognition receptors) impliqués dans la reconnaissance des PAMP (pathogen associated molecular pattern), tels que la MBL (mannose binding lectin), la galectine-3, les TLR (Toll-like receptors) et les peptides antimicrobiens (β-défensines) [2]. De manière intéressante, certains de ces polymorphismes favorisent également la colonisation digestive par C. albicans, en particulier les mutations des gènes MBL-2 et TLR-1. Ces données suggèrent un rôle prépondérant de l’interaction de la flore fongique avec l’hôte dans le développement de maladies inflammatoires chroniques intestinales. Enfin, plusieurs observations expérimentales démontrent que la flore fongique pourrait jouer un rôle dans l’initiation d’une réponse immune excessive [
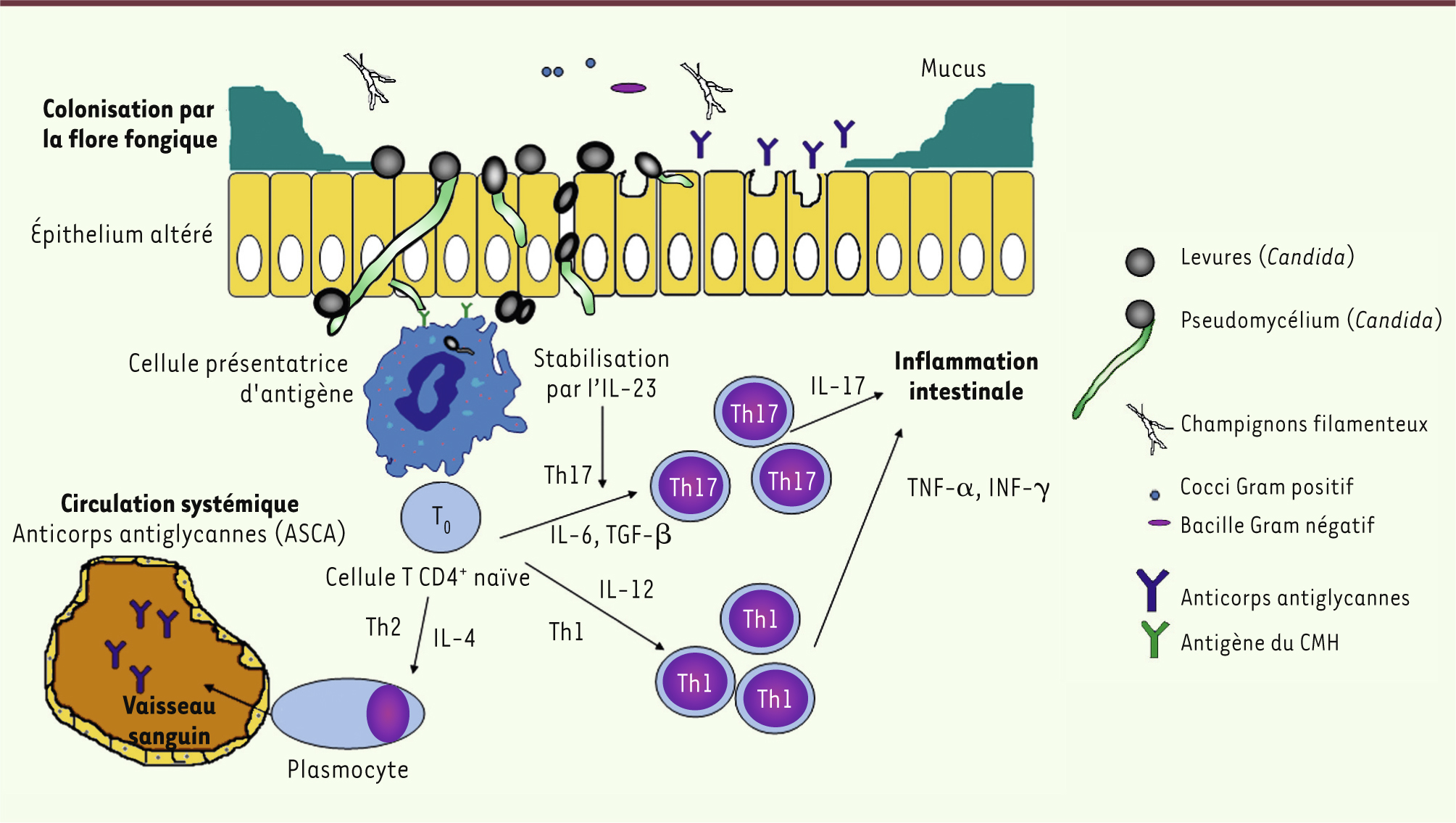
12]. Chez les patients atteints de maladie de Crohn, il y a un défaut de régulation de la réponse inflammatoire de la muqueuse, en particulier une orientation des lymphocytes T naïfs vers une réponse cellulaire Th1 et Th17 (Figure 1). Au cours de la maladie, l’interféron γ (IFN-γ) est sécrété de façon excessive au niveau de la muqueuse intestinale par les lymphocytes Th1, et ce en réponse à l’IL-12. L’axe Th17, induit par l’IL-6 et le TGF-β (transforming growth factor-b) et stabilisé par l’IL-23, aurait un rôle dans le déclenchement de la réponse inflammatoire intestinale [
13]. Il a été également démontré que C. albicans serait un puissant inducteur de la différenciation des cellules T helper vers la voie Th17, via un mécanisme impliquant un récepteur de lectine, Dectin-1 [
14]. Cet axe prend alors une dimension importante dans l’immunité antifongique [
15], et il a été montré dans des modèles murins [12] que la colonisation gastrique par C. albicans pourrait augmenter la production des cytokines IL-17 et IL-23. De ce fait, la colonisation fongique accrue de l’intestin pourrait favoriser une activité pro-inflammatoire exagérée, par le biais de la réponse Th17 [12]. La
Figure 1
récapitule l’implication potentielle de la flore fongique dans l’initiation de la maladie de Crohn.
 | Figure 1.
Schéma représentatif de l’implication de la flore fongique dans le processus immunopathogénique de la maladie de Crohn. La colonisation intestinale par la flore fongique et la dysbiose pourraient être impliquées dans la pathogenèse de la maladie de Crohn. Les éléments fongiques, après passage d’une barrière épithéliale intestinale altérée et perméable, seraient reconnus par les cellules présentatrices d’antigène, qui orienteraient, chez les sujets génétiquement susceptibles, les cellules T CD4+ naïves vers une réponse cellulaire Th1/Th17, responsable de l’inflammation intestinale. La réponse Th2 induirait la différenciation des lymphocytes B en plasmocytes, permettant la synthèse d’anticorps antiglycannes sériques (IgG, retrouvées chez plus de 60 % des malades) et tissulaires (IgA sécrétoires). CMH : complexe majeur d’histocompatibilité. |
|
Perspectives de recherche et conclusion Contrairement au microbiote bactérien, la flore fongique intestinale chez les patients atteints de la maladie de Crohn a été peu étudiée. Récemment, l’avènement des nouvelles techniques de séquençage à haut-débit [
16,
20] a permis de caractériser le mycobiome de la flore buccale [
17] et de révéler la présence de nombreuses espèces fongiques non cultivables et leurs implications potentielles dans la survenue de la maladie. La méthodologie décrite dans ces études princeps utilise une technologie innovante basée sur le pyroséquençage, en particulier la technologie 454 (technique de pyroséquençage, appareil GS-FLX 454 Roche) [16]. Cette approche a révolutionné l’analyse métagénomique, puisqu’elle s’affranchit des étapes de clonage. L’utilisation de cibles universelles fongiques ribosomales (ITS, internal transcribed spacer) permet une étude quasi exhaustive du métagénome. Le terme mycobiome a donc été consacré comme le pendant fongique du microbiome. Récemment, Iliev et al. [11] ont pu caractériser le mycobiome intestinal dans un modèle murin de colite chimio-induite et ont suggéré une augmentation des espèces fongiques pathogènes (Candida, Trichosporon) et une réduction du genre Saccharomyces (utilisé comme agent probiotique). L’existence de nombreuses espèces fongiques, non détectables par les techniques classiques de culture, laisse entrevoir un important champ d’investigation. En effet, la caractérisation du microbiote fongique par une approche métagénomique permettrait donc de mieux comprendre et de définir les mécanismes moléculaires de l’implication de la flore intestinale dans la MC, et sa participation dans la réponse immunitaire de l’hôte. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article
|
1.
Cosnes
J
,
Gower-Rousseau
C
,
Seksik
P
,
Cortot
A
. Epidemiology and natural history of inflammatory bowel diseases . Gastroenterology.
2011; ; 140 : :1785.–1794. 2.
Chassaing
B
,
Darfeuille-Michaud
A
. The commensal microbiota and enteropathogens in the pathogenesis of inflammatory bowel diseases . Gastroenterology.
2011; ; 140 : :1720.–1728. 3.
Boudeau
J
,
Glasser
AL
,
Masseret
E
, et al.
Invasive ability of an Escherichia coli strain isolated from the ileal mucosa of a patient with Crohn’s disease . Infect Immun.
1999; ; 67 : :4499.–4509. 4.
Standaert-Vitse
A
,
Sendid
B
,
Joossens
M
, et al.
Candida albicans colonization and ASCA in familial Crohn’s disease . Am J Gastroenterol.
2009; ; 104 : :1745.–1753. 5.
Gerard
R
,
Sendid
B
,
Techy
A
, et al.
Candida albicans colonization and anti-glycan antibodies in active and quiescent Crohn’s disease . Journal of Crohn’s and Colitis.
2013; ; 7 : :S290.–S2S1. 6.
Landers
CJ
,
Cohavy
O
,
Misra
R
, et al.
Selected loss of tolerance evidenced by Crohn’s disease-associated immune responses to auto- and microbial antigens . Gastroenterology.
2002; ; 123 : :689.–699. 7.
Sendid
B
,
Quinton
JF
,
Charrier
G
, et al.
Anti-Saccharomyces cerevisiae mannan antibodies in familial Crohn’s disease . Am J Gastroenterol.
1998; ; 93 : :1306.–1310. 8.
Tang
LY
,
Cai
H
,
Navaneethan
U
, et al.
Utility of fecal and serum anti-Saccharomyces cerevisiae antibodies in the diagnosis of Crohn’s disease-like condition of the pouch . Int J Colorectal Dis.
2012; ; 27 : :1455.–1463. 9.
Samuel
S
,
Loftus
EV
,
Sandborn
WJ
. The effects of itraconazole on inflammatory bowel disease activity in patients treated for histoplasmosis . Aliment Pharmacol Ther.
2010; ; 32 : :1207.–1209. 10.
Jawhara
S
,
Thuru
X
,
Standaert-Vitse
A
, et al.
Colonization of mice by Candida albicans is promoted by chemically induced colitis and augments inflammatory responses through galectin-3 . J Infect Dis.
2008; ; 197 : :972.–980. 11.
Iliev
ID
,
Funari
VA
,
Taylor
KD
, et al.
Interactions between commensal fungi and the C-type lectin receptor Dectin-1 influence colitis . Science.
2012; ; 336 : :1314.–1317. 12.
Kumamoto
CA
. Inflammation and gastrointestinal Candida colonization . Curr Opin Microbiol.
2011; ; 14 : :386.–391. 13.
Peyrin-Biroulet
L
,
Parmentier-Decrucq
E
,
Branche
J
,
Desreumaux
P
. L’IL-23R, un nouveau gène de susceptibilité dans les maladies inflammatoires chroniques intestinales . Med Sci (Paris).
2007; ; 23 : :250.–252. 14.
van der Meer
JW
,
van de Veerdonk
FL
,
Joosten
LA
, et al.
Severe Candida spp. infections: new insights into natural immunity . Int J Antimicrob Agents.
2010; ; 36 : :S58.–62. 15.
Drummond
RA
,
Brown
GD
. The role of Dectin-1 in the host defence against fungal infections . Curr Opin Microbiol.
2011; ; 14 : :392.–399. 16.
Siqueira
JF
,
Fouad
AF
, Rôças IN. Pyrosequencing as a tool for better understanding of human microbiomes . J Oral Microbiol.
2012 ; :4.. 17.
Ghannoum
MA
,
Jurevic
RJ
,
Mukherjee
PK
, et al.
Characterization of the oral fungal microbiome (mycobiome) in healthy individuals . PLoS Pathog.
2010; ; 6 : :e1000713.. 18.
Jobin
C
. Microbiome : un nouveau facteur de risque de cancer colorectal ?
Med Sci (Paris).
2013; ; 29 : :582.–585. 19.
Sendid
B
,
Jouault
T
,
Vitse
A
, et al.
Glycannes pariétaux de levures et anticorps spécifiques . Med Sci (Paris).
2009; ; 25 : :473.–482. 20.
Bernardo
P
,
Emmanuel Albina
E
,
Eloit
M
,
Roumagnac
P
. Métagénomique virale et pathologie - Une histoire récente . Med Sci (Paris).
2013; ; 29 : :501.–508. |