| |
| Med Sci (Paris). 2013 June; 29(6-7): 577–579. Published online 2013 July 12. doi: 10.1051/medsci/2013296008.Interleukine 22 Son rôle dans la maladie du greffon contre l’hôte Béatrice Gaugler,1* Baptiste Lamarthée,1 Mélanie Couturier,1 and Philippe Saas1 1Inserm UMR1098, Établissement français du sang (EFS) Bourgogne Franche-Comté, université de Bourgogne Franche-Comté, 1, boulevard Fleming, 25020Besançon, France MeSH keywords: Animaux, Maladie du greffon contre l'hôte, étiologie, Humains, Interleukines, physiologie |
L’allogreffe de cellules hématopoïétiques est une thérapeutique pour les patients atteints d’hémopathies malignes. Le nombre de ces allogreffes est en constante augmentation du fait, notamment, de la diversification des sources de greffon et de l’utilisation de conditionnements prégreffes ayant une toxicité réduite ce qui permet de les appliquer à des patients plus âgés [
1]. Cependant, la maladie du greffon contre l’hôte (GVHD) reste une complication majeure de ces greffes et entraîne une morbidité et une mortalité importantes [1]. La GVHD aiguë correspond à une réponse immune inflammatoire exacerbée qui conduit à la destruction des tissus sains du receveur par les cellules immunitaires du donneur. Les études pionnières de l’équipe de Ferrara [
2] ont proposé un modèle physiopathologique de la GVHD aiguë comprenant trois étapes, au cours desquelles les systèmes immunitaires inné et adaptatif interagissent : (1) l’activation des cellules présentatrices de l’antigène de l’hôte par les cytokines inflammatoires, (2) l’activation des lymphocytes T du donneur, et (3) la phase effectrice conduisant à la destruction des tissus cibles [2]. Les modèles expérimentaux animaux ont mis en évidence la contribution des lipopolysaccharides (LPS) bactériens qui sont libérés au niveau de la barrière intestinale lésée par le conditionnement prégreffe, et qui vont déclencher la cascade d’activation immunitaire [2]. |
L’interleukine-22 : des propriétés contrastées entre inflammation et protection des tissus L’interleukine 22 (IL-22) est une cytokine essentielle à la défense de l’organisme contre les pathogènes extracellulaires au niveau des muqueuses. Elle est produite aussi bien par des cellules de l’immunité innée qu’adaptative. Ainsi, les lymphocytes T CD4+ (Th1, Th17, Th22) [
3], les lymphocytes T γδ, les cellules NKT (natural killer T cells), ainsi que les cellules lymphoïdes de l’immunité innée CD3+ (innate lymphoid cells [ILC], et lymphoid tissue inducer [LTi]) sont autant de sources d’IL-22. L’IL-22 se lie à son récepteur IL-22R formé de l’IL-22R1 et IL-10R2, qui induit la cascade de signalisation de STAT3 (signal transducer and activator of transcription 3). Le récepteur IL-22R n’est pas exprimé sur les cellules hématopoïétiques ; il est exclusivement présent sur des cellules épithéliales de tissus comme la peau, l’intestin, le côlon et le poumon. D’un point de vue fonctionnel, l’IL-22 participe à l’homéostasie des tissus en permettant la prolifération des cellules épithéliales contribuant ainsi à maintenir ou restaurer l’intégrité de la barrière épithéliale. L’IL-22 induit la synthèse de protéines antimicrobiennes dans la peau et les muqueuses, comme par exemple les protéines S100, les bêta-défensines et les protéines REG (regenerating) [
4]. Enfin, l’IL-22 permet la production de médiateurs inflammatoires comme l’IL-6, IL-1β, le G-CSF (granulocyte colony-stimulating factor), ou des chimiokines CXCL1 et CXCL9. Une dérégulation de la signalisation de la cascade IL-22/IL-22R est impliquée dans plusieurs pathologies comme le psoriasis et des maladies inflammatoires de l’intestin [
5]. |
Quelle contribution de l’IL-22 au développement de la maladie du greffon contre l’hôte ? Compte tenu des propriétés de l’IL-22 dans les tissus qui sont le plus souvent la cible de la GVHD, nous avons évalué sa contribution au développement de cette maladie dans un modèle expérimental de GVHD aiguë. Les souris irradiées reçoivent de la moelle osseuse allogénique et des lymphocytes T capables d’induire la GVHD issus soit de souris sauvages, soit déficientes en IL-22. Il apparaît que les souris qui reçoivent des lymphocytes T déficients en IL-22 développent une maladie moins sévère, et leur mortalité est diminuée [
6]. L’IL-22 participe à la sévérité de la GVHD en favorisant l’inflammation systémique, mais aussi locale au niveau des organes cibles [6]. Dans ce modèle, la moindre sévérité de la maladie est associée à une augmentation des lymphocytes T régulateurs CD4+CD25+Foxp3+ (Treg) [6], ces derniers pouvant être responsables de l’effet protecteur observé en absence d’IL-22 dans les lymphocytes T du donneur. Une autre étude a montré que les ILC localisées dans l’intestin des souris receveuses persistent après greffe et sécrètent de l’IL-22 lorsqu’elles sont activées par l’IL-23 [
7]. Cette étude montre que la GVHD intestinale détruit les ILC qui participent à la protection des cellules souches intestinales, et que la disparition de ces cellules souches est plus accentuée en absence d’IL-22 dérivée de l’hôte [7]. Ainsi, l’IL-22 produite par les ILC intestinales du receveur permettrait de maintenir l’intégrité de l’épithélium intestinal dans un contexte inflammatoire et d’une réponse allogénique, et diminuerait la pathologie liée à la GVHD. Ces résultats confortent ceux décrivant le rôle protecteur de l’IL-22 dans les modèles de colites inflammatoires [
8]. Ainsi, l’IL-22 produite soit par les ILC du receveur, soit par les lymphocytes T du donneur, peut avoir des effets opposés dans le développement de la GVHD (Figure 1). Il est donc important de déterminer quel effet est dominant dans un contexte clinique d’allogreffe pour envisager une approche thérapeutique d’administration ou de neutralisation de l’IL-22. Cependant, les effets de l’IL-22 semblent multiples et complexes après la greffe, rendant difficile l’approche thérapeutique visant à neutraliser cette cytokine. En effet, une étude récente a montré que l’IL-22 produite par les cellules LTi RORγt+ (retinoid-related orphan receptor) CCR6+NKp46- du thymus est nécessaire pour induire la régénération thymique après une irradiation corporelle totale dans un modèle expérimental [
9,
10]. La neutralisation de l’IL-22 postgreffe pourrait avoir un impact direct sur la régénération du thymus potentiellement endommagé à la suite du conditionnement prégreffe, et influencer négativement la reconstitution immunitaire.
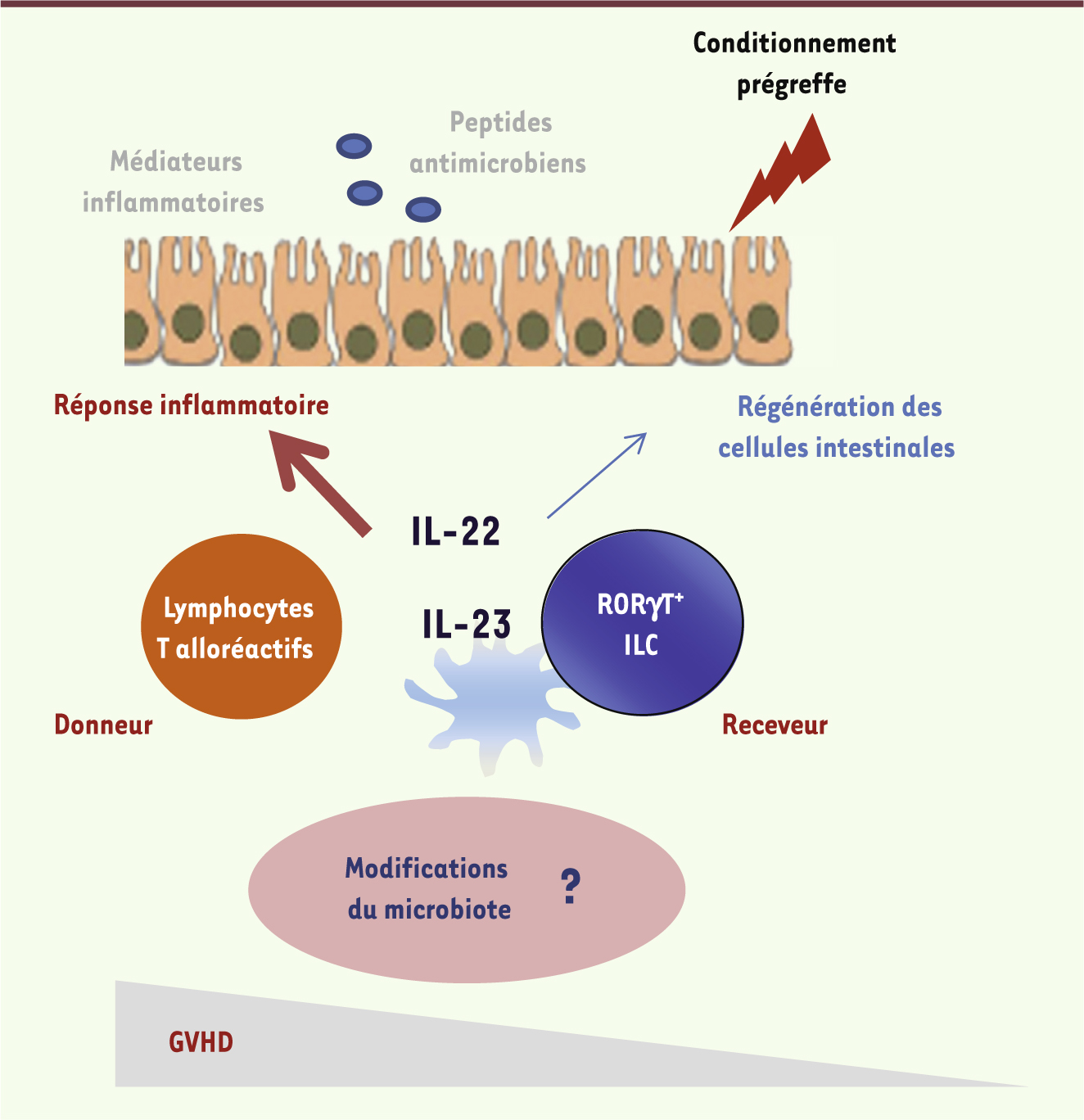
 | Figure 1.
Rôle de l’IL-22 dans la maladie digestive du greffon contre l’hôte. L’IL-22 est produite après la greffe par les ILC du receveur [ 7] ou par les lymphocytes T alloréactifs du donneur [ 6]. L’IL-22 sécrétée par les lymphocytes T du donneur au moment de la greffe participe à la réponse inflammatoire dans les tissus cibles de la GVHD (maladie du greffon contre l’hôte) et favorise l’alloréactivité. Cependant, l’IL-22 produite par les ILC radiorésistantes RORγt + du receveur pourrait aussi avoir des effets bénéfiques après la greffe en participant à la régénération de l’épithélium intestinal et du thymus. Le microbiote peut être modifié selon la présence ou non de l’IL-22 et influencer aussi la maladie. Il reste à déterminer comment sont intégrées ces fonctions antagonistes de l’IL-22 et quels effets dominent après la greffe. |
D’autre part, les effets de l’IL-22 peuvent être neutralisés in vivo grâce à l’expression de son récepteur soluble, l’IL-22 binding protein (IL-22BP). L’IL-22BP est exprimée dans les poumons, la peau, la rate et le côlon [
11], mais son importance et son rôle in vivo restent peu connus. Une étude récente montre que l’IL-22BP est fortement exprimée par les cellules dendritiques au niveau du côlon dans des conditions d’homéostasie, et qu’elle joue un rôle crucial dans le contrôle de l’inflammation et de la tumorigenèse qui est associée [
12]. Ces observations ajoutent un niveau de complexité supplémentaire dans la régulation fonctionnelle de l’IL-22 et pourraient rendre compte des résultats divergents rapportés dans les modèles de greffe allogénique de cellules hématopoïétiques et d’inflammation. L’expression de l’IL-22BP est régulée via l’IL-18 et l’inflammasome [12]. La participation de l’IL-22BP reste à explorer dans le contexte de GVHD. |
Rôle de l’interleukine-22 dans la GVHD : quelle influence du microbiote ? Le conditionnement prégreffe combinant chimiothérapies et irradiation contribue aux lésions de l’épithélium intestinal, favorisant l’exposition systémique aux produits microbiens normalement séquestrés au niveau de la lumière intestinale [2]. Des études récentes menées dans des modèles murins et chez l’homme ont montré que la GVHD est associée à une modification du microbiote en faveur des souches de la famille des lactobacilles [
13]. Cette modification du microbiote pourrait être le résultat de la destruction des cellules de Paneth qui produisent les peptides antimicrobiens [
14]. Il est probable que l’absence d’IL-22 favorise la colonisation d’espèces bactériennes différentes. Comme le microbiote est important dans la génération des réponses lymphocytaires Th17 et Treg au niveau intestinal [
15,
16], il reste à déterminer si la modification du microbiote en absence d’IL-22 pourrait favoriser l’expansion de Treg, modulant ainsi la sévérité de la maladie (Figure 1). L’implication de la réponse immunitaire innée dans le développement de la GVHD intestinale, le rôle du microbiote et les effets pro-inflammatoires ou protecteurs de l’IL-22 n’ont pas encore livré tous leurs secrets dans la physiopathologie de cette maladie. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Jouet
JP
. La greffe de moelle osseuse, d’un siècle à l’autre . Med Sci (Paris).
2010; ; 26 : :447.–448. 2.
Ferrara
JL
,
Levine
JE
,
Reddy
P
,
Holler
E
. Graft-versus-host disease . Lancet.
2009; ; 373 : :1550.–1561. 3.
Yssel
H
,
Bensussan
A
. Existe-t-il dans la peau une nouvelle population lymphocytaire Th22 distincte des lymphocytes Th17 ? . Med Sci (Paris).
2010; ; 26 : :12.–14. 4.
Wolk
K
,
Kunz
S
,
Witte
E
, et al.
IL-22 increases the innate immunity of tissues . Immunity.
2004; ; 21 : :241.–254. 5.
Sonnenberg
GF
,
Fouser
LA
,
Artis
D
. Border patrol: regulation of immunity, inflammation and tissue homeostasis at barrier surfaces by IL-22 . Nat Immunol.
2011; ; 12 : :383.–390. 6.
Couturier
M
,
Lamarthee
B
,
Arbez
J
, et al.
IL-22 deficiency in donor T cells attenuates murine acute graft-versus-host disease mortality while sparing the graft-versus-leukemia effect . Leukemia.
2013 ; doi: 10.1038/leu.39.. 7.
Hanash
AM
,
Dudakov
JA
,
Hua
G
, et al.
Interleukin-22 protects intestinal stem cells from immune-mediated tissue damage and regulates sensitivity to graft versus host disease . Immunity.
2012; ; 37 : :339.–350. 8.
Zenewicz
LA
,
Flavell
RA
. IL-22 and inflammation: leukin’ through a glass onion . Eur J Immun.
2008; ; 38 : :3265.–3268. 9.
Dudakov
JA
,
Hanash
AM
,
Jenq
RR
, et al.
Interleukin-22 drives endogenous thymic regeneration in mice . Science.
2012; ; 336 : :91.–95. 10.
Williams
L
,
Bosselut
R
. Interleukine 22–Une nouvelle piste vers la régénération thymique in vivo ? . Med Sci(Paris).
2013; ; 29 : :11.–14. 11.
Dumoutier
L
,
Lejeune
D
,
Colau
D
,
Renauld
JC
. Cloning and characterization of IL-22 binding protein, a natural antagonist of IL-10-related T cell-derived inducible factor/IL-22 . J Immunol.
2001; ; 166 : :7090.–7095. 12.
Huber
S
,
Gagliani
N
,
Zenewicz
LA
, et al.
IL-22BP is regulated by the inflammasome and modulates tumorigenesis in the intestine . Nature.
2012; ; 491 : :259.–263. 13.
Jenq
RR
,
Ubeda
C
,
Taur
Y
, et al.
Regulation of intestinal inflammation by microbiota following allogeneic bone marrow transplantation . J Exp Med.
2012; ; 209 : :903.–911. 14.
Eriguchi
Y
,
Takashima
S
,
Oka
H
, et al.
Graft-versus-host disease disrupts intestinal microbial ecology by inhibiting Paneth cell production of alpha-defensins . Blood.
2012; ; 120 : :223.–231. 15.
Atarashi
K
,
Tanoue
T
,
Shima
T
, et al.
Induction of colonic regulatory T cells by indigenous Clostridium species . Science.
2011; ; 331 : :337.–341. 16.
Bouladoux
N
,
Hand
TW
,
Naik
S
,
Belkaid
Y
. Microbiote et lymphocytes T : les meilleurs ennemis . Med Sci (Paris).
2013; ; 29 : :349.–352. |