| |
| Med Sci (Paris). 2013 May; 29(5): 455–457. Published online 2013 May 28. doi: 10.1051/medsci/2013295004.
Coxiella burnetii, l’agent de la fièvre Q, bloque la formation du phagolysosome Giovanna Mottola1,2,3 and Eric Ghigo1* 1CNRS UMR 7278, IRD198, Inserm U1095, université Aix-Marseille, 27, boulevard Jean Moulin, 13385Marseille Cedex 05, France 2Department of medical biochemistry and biotechnology university of Naples Federico II, via S. Pansini 5, 80131Naples, Italie 3Faculty of biotechnological sciences, university of Naples Federico II, via S. Pansini 5, 80131Naples, Italie MeSH keywords: Phénomènes physiologiques cellulaires, Coxiella burnetii, physiologie, Lipopolysaccharides, Phagosomes |
De nombreuses bactéries pathogènes possèdent un mode de vie intracellulaire qui les met à l’abri de la réponse immune. Différents types cellulaires peuvent être infectés par les bactéries intracellulaires, mais les monocytes et les macrophages sont des hôtes privilégiés. Les macrophages jouent un rôle essentiel dans la mise en place de la réponse immune, étant à la fois les initiateurs et les effecteurs de la lutte antibactérienne. La capacité phagocytaire des macrophages et leur longue durée de vie en font des hôtes privilégiés pour les microorganismes à développement intracellulaire. Ainsi, de façon paradoxale, les bactéries intracellulaires résident principalement dans des cellules normalement destinées à les détruire. Pour survivre et se multiplier dans des cellules hôtes dotées d’un tel pouvoir lytique, des agents pathogènes aussi variées que Mycobacterium tuberculosis, Legionella pneumophila, Listeria monocytogenes ont élaboré divers mécanismes d’échappement à la réponse immunitaire incluant l’altération du trafic intracellulaire [
1]. |
Coxiella burnetii, une bactérie intracellulaire stricte à gram négatif, est responsable chez l’homme de la fièvre Q. La fièvre Q est une anthropozoonose contractée par voie aérienne ou digestive. Elle se présente sous deux formes cliniques : une forme aiguë spontanément résolutive, caractérisée par des symptômes tels que fièvre, hépatite, pneumopathie et, plus rarement, méningoencéphalite ; et une forme chronique, pouvant survenir des années après la primo-infection et dont la manifestation principale est une endocardite de pronostic sévère [
2]. Une réponse immune à médiation cellulaire efficace rend compte du pronostic favorable de la forme aiguë de la fièvre Q. La forme chronique de la fièvre Q est, quant à elle, caractérisée par un déficit de la réponse à médiation cellulaire, avec en particulier une absence de prolifération lymphocytaire en réponse à l’antigène et l’incapacité à former des granulomes [2]. |
Vie intracellulaire de Coxiella burnetii
C. burnetii a longtemps été considérée comme une bactérie se multipliant dans les phagolysosomes. Les travaux ayant abouti à ces conclusions reposaient sur l’étude, d’une part, de cellules non microbicides permettant la réplication bactérienne et, d’autre part, sur l’utilisation de variants avirulents de C. burnetii [
3]. En outre, ces études relativement anciennes ne pouvaient tenir compte de données plus récentes concernant la distinction entre phagosome acide et phagolysosome. Nous avons réévalué ce champ il y quelques années. Il s’avère que C. burnetii survit dans les macrophages humains alors que ses variants avirulents y sont rapidement éliminés [
4]. L’étude de la dynamique du trafic intracellulaire de C. burnetii analysée par microscopie confocale après utilisation d’anticorps spécifiques de différents sous-compartiments cellulaires, a montré que C. burnetii survit dans une vacuole acidifiée par l’ATPase vacuolaire à protons, indépendamment de la virulence des bactéries. Ces résultats sont en accord avec les études précédentes [
5] qui avaient montré qu’un pH acide était nécessaire au métabolisme de C. burnetii. En revanche, le pH acide du compartiment dans lequel réside C. burnetii n’est pas responsable de la survie ou de l’élimination de C. burnetii, puisque les bactéries virulentes et avirulentes, bien que localisées dans un compartiment acide, ont un devenir intracellulaire différent. Nous avons également montré que les bactéries virulentes résident dans un compartiment incapable de fusionner avec les lysosomes : en effet, ce compartiment est colocalisé avec un marqueur des endosomes tardifs et des lysosomes, tel que LAMP-1 (lysosomal associated membrane protein-1), mais pas avec la cathepsine D, un marqueur des lysosomes. Ce défaut d’acquisition de la cathepsine D est associé à la virulence bactérienne puisque les variants avirulents de C. burnetii, ou les bactéries virulentes tuées par la chaleur, sont parfaitement colocalisées avec la cathepsine D [
6]. Il est probable que l’absence de recrutement de Rab7, une petite protéine G, par le phagosome de C. burnetii est associée à l’incapacité de l’organite à acquérir les hydrolases lysosomales. En effet, l’absence de Rab7 n’empêche pas la maturation du phagosome contenant des mycobactéries en phagosome tardif [
7]. En outre, le défaut d’acquisition de Rab7 par le phagosome contenant C. burnetii n’est pas dû à une accumulation de Rab5 et de EEA-1 (early endosome antigen-1), puisque ces marqueurs sont exprimés normalement par le phagosome contenant la bactérie. |
Le lipopolysaccharide de Coxiella burnetii
Pour analyser en profondeur la nature du défaut de maturation du phagosome de C. burnetii et, en particulier, l’absence d’acquisition de Rab7, nous avons étudié le rôle du lipopolysaccharide (LPS) de C. burnetii dans le trafic intracellulaire de cette bactérie [
8]. En effet, la composition du LPS des variants avirulents (avLPS) de C. burnetii est très différente de celle du LPS des bactéries virulentes (vLPS). En effet, le vLPS est plus long et composé de virenose et de dihydrohydroxystreptose [
9], deux sucres absents chez les autres bactéries à gram négatif. Nous avons supposé que cette différence majeure entre les deux formes de LPS de C. burnetii, qui se traduit par des différences du pouvoir endotoxinique, pourrait rendre compte des distinctions observées dans la nature du phagosome contenant les bactéries virulentes ou les variants avirulents de C. burnetii. Nous avons, dans un premier temps, caractérisé le trafic intracellulaire du LPS de C. burnetii, et nous l’avons comparé à celui des bactéries entières. Le vLPS, tout comme les bactéries virulentes, est localisé dans un compartiment incapable de fusionner avec les lysosomes (Figure 1), alors que le avLPS et les bactéries avirulentes fusionnent avec les lysosomes. Le fait que le vLPS soit incapable d’activer la MAP (mitogen activated protein) kinase p38α expliquerait que les bactéries virulentes ne sont pas dirigées vers le compartiment de dégradation. En effet, le défaut d’activation de la MAP kinase p38α, qui résulte d’une action antagoniste du vLPS sur TLR4 (toll-like receptor 4), a pour effet d’empêcher le recrutement de HOPS (homotypic fusion and vacuole protein sorting complex), un complexe de fusion et de tri vésiculaire. Nous avons en effet montré que le recrutement de HOPS requiert la phosphorylation de la protéine Vps41 (vacuolar protein sorting 41). La transfection de macrophages par un activateur de p38 et l’utilisation de mutants phosphomimétiques de Vps41 (Vps41-S796E) ont entraîné une restauration de la maturation du phagosome. Il apparaît ainsi que la MAP kinase p38α et son interaction avec Vps41 jouent un rôle central dans la maturation du phagosome de C. burnetii en phagolysosome [8]. La structure atypique du LPS permet ainsi à C. burnetii de se soustraire à la réponse protectrice dégradative de l’hôte [8].
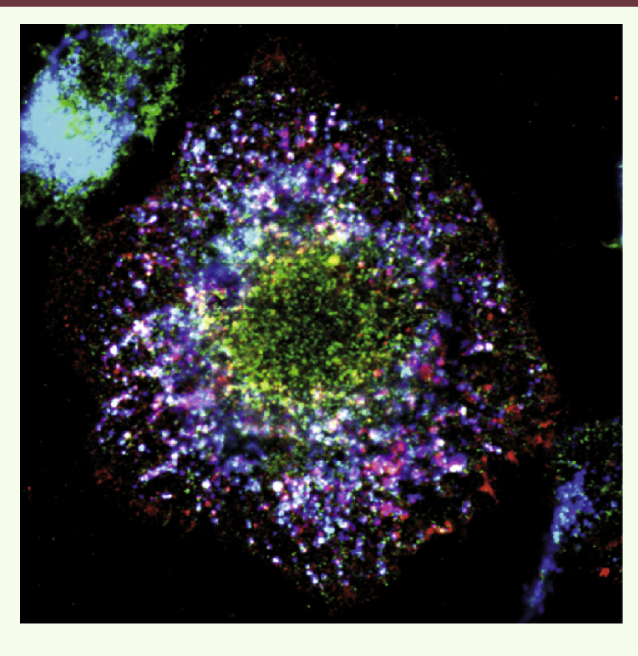
 | Figure 1.
Localisation du vLPS dans les endosomes tardifs. Les macrophages ont internalisé le LPS de C. burnetii, l’agent de la fièvre Q. Le LPS (en rouge) est localisé dans des endosomes tardifs (LAMP-1 en bleu), mais pas dans des lysosomes (cathepsine D en vert). Les endosomes tardifs contenant le LPS sont incapables de fusionner avec les lysosomes. |
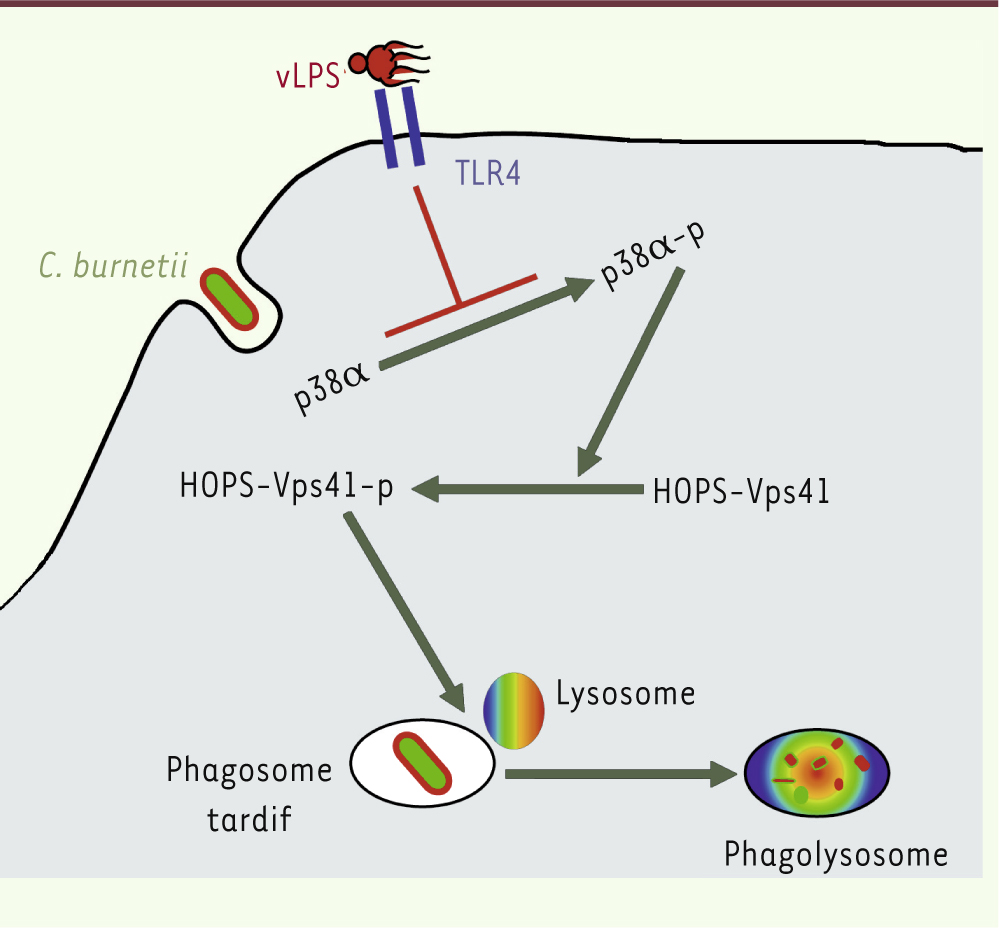
 | Figure 2.
Inhibition de la formation des phagolysosomes par Coxiella burnetii. Le LPS de C. burnetii ou la bactérie entière n’induise pas l’activation de la MAP kinase p38α. L’absence de phosphorylation de Vps41 qui en découle ne permet pas le recrutement du complexe HOPS et de Rab7. Il en résulte une absence de fusion entre les phagosomes et les lysosomes. Ce défaut de formation du phagolysosome permet à la bactérie de survivre dans les macrophages. p38α : MAP kinase p38α ; -p : groupement phosphate. |
|
Conclusion et perspectives Nous avons montré, pour la première fois, qu’un composant essentiel de la membrane externe des bactéries, le LPS, permet à C. burnetii de survivre au sein de sa cellule hôte. Les molécules identifiées comme des acteurs de la survie intracellulaire de C. burnetii pourraient constituer des cibles spécifiques pour de nouvelles approches diagnostiques de la fièvre Q. En effet, on observe chez les patients atteints d’une fièvre Q chronique un défaut d’activation de la MAP kinase p38α [
10]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ce travail a été financé par le CNRS (PICS 2012-2014, E. Ghigo).
|
1.
Flannagan
RS
,
Cosio
G
,
Grinstein
S
. Antimicrobial mechanisms of phagocytes and bacterial evasion strategies . Nat Rev Microbiol.
2009; ; 7 : :355.–366. 2.
Raoult
D
,
Marrie
T
,
Mege
J
. Natural history and pathophysiology of Q fever . Lancet Infect Dis.
2005; ; 5 : :219.–226. 3.
Barry
AO
,
Mege
JL
,
Ghigo
E
. Hijacked phagosomes and leukocyte activation: an intimate relationship . J Leukoc Biol.
2011; ; 89 : :373.–382. 4.
Capo
C
,
Lindberg
FP
,
Meconi
S
, et al.
Subversion of monocyte functions by Coxiella burnetii: impairment of the cross-talk between alphavbeta3 integrin and CR3 . J Immunol.
1999; ; 163 : :6078.–6085. 5.
Hackstadt
T
,
Williams
JC
. Biochemical stratagem for obligate parasitism of eukaryotic cells by Coxiella burnetii
. Proc Natl Acad Sci USA.
1981; ; 78 : :3240.–3244. 6.
Ghigo
E
,
Capo
C
,
Tung
CH
, et al.
Coxiella burnetii survival in THP-1 monocytes involves the impairment of phagosome maturation: IFN-gamma mediates its restoration and bacterial killing . J Immunol.
2002; ; 169 : :4488.–4495. 7.
Fratti
RA
,
Vergne
I
,
Chua
J
, et al.
Regulators of membrane trafficking and Mycobacterium tuberculosis phagosome maturation block . Electrophoresis.
2000; ; 21 : :3378.–3385. 8.
Barry
AO
,
Boucherit
N
,
Mottola
G
, et al.
Impaired stimulation of p38alpha-MAPK/Vps41-HOPS by LPS from pathogenic Coxiella burnetii prevents trafficking to microbicidal phagolysosomes . Cell Host Microbe.
2012; ; 12 : :751.–763. 9.
Narasaki
CT
,
Toman
R
. Lipopolysaccharide of Coxiella burnetii . Adv Exp Med Biol.
2012; ; 984 : :65.–90. 10.
Boucherit
N
,
Barry
AO
,
Mottola
G
, et al.
Effects of Coxiella burnetii on MAPKinases phosphorylation . FEMS Immunol Med Microbiol.
2011; ; 64 : :101.–103. |