| |
| Med Sci (Paris). 2013 April; 29(4): 349–352. Published online 2013 April 26. doi: 10.1051/medsci/2013294005.Microbiote et lymphocytes T Les meilleurs ennemis Nicolas Bouladoux,1* Timothy W. Hand,1** Shruti Naik,1** and Yasmine Belkaid1 1Mucosal immunology section, Laboratory of parasitic diseases, National institute of allergy and infectious diseases, National institutes of health, 4 Center drive, Bethesda, MD20892, États-Unis MeSH keywords: Animaux, Numération des lymphocytes CD4, Lymphocytes T CD4+, immunologie, Humains, Muqueuse intestinale, microbiologie, Métagénome, physiologie, Lymphocytes T, Toxoplasma, Toxoplasmose |
Les cellules de notre corps coexistent en permanence avec une flore microbienne extrêmement dense et variée. Ce microbiote colonise dès la naissance la surface de notre peau et de la plupart de nos muqueuses, en particulier la muqueuse intestinale. Chez un sujet sain, la flore microbienne du tube digestif compte un nombre de bactéries équivalent à au moins 10 fois le nombre de ses propres cellules [
1]. Ces bactéries, qualifiées de commensales, forment un écosystème complexe avec lequel se sont établies, au cours de l’évolution, des relations mutualistes progressant du commensalisme à une véritable symbiose. En effet, bien que les bactéries du microbiote intestinal utilisent à leur profit les ressources disponibles chez leur hôte, elles exercent aussi des effets physiologiques bénéfiques pour celui-ci. Notamment, elles apportent des activités enzymatiques non codées par le génome de leur hôte qui sont cruciales pour extraire l’énergie provenant de l’alimentation de ce dernier, et modifient ainsi son métabolisme [
2]. Le microbiote intestinal favorise également la maturation de l’intestin et celle du système immunitaire intestinal [2]. |
Les lymphocytes T CD4 + interviennent dans la réponse immunitaire intestinale Les lymphocytes T CD4+ auxiliaires, aussi appelés T helper, sont une composante essentielle de la réponse immunitaire adaptative. Ces cellules sont présentes au niveau de la muqueuse intestinale et contribuent à la protection de l’hôte contre les agents pathogènes susceptibles de pénétrer la barrière formée par cette muqueuse. Au cours d’une infection, la reconnaissance de l’antigène étranger présenté par les cellules dendritiques entraîne l’activation des lymphocytes T CD4+ naïfs spécifiques de ce pathogène et induit leur prolifération et leur différenciation en cellules T CD4+ auxiliaires. Une particularité des lymphocytes T CD4+ réside dans leur capacité à se différencier en plusieurs sous-populations de lymphocytes T auxiliaires effecteurs. Celles-ci sont caractérisées par différents profils de sécrétion cytokinique et sont adaptées à la genèse d’une réponse immunitaire permettant d’assurer l’élimination rapide et efficace de l’agent infectieux. Ainsi, au cours d’une infection par des pathogènes intracellulaires tels que Leishmania major ou Toxoplasma gondii, les lymphocytes T CD4+ auxiliaires sécrètent majoritairement de l’interféron (IFN)-γ, une cytokine pro-inflammatoire qui stimule l’activité antimicrobienne des macrophages, assurant l’éradication de ces parasites. D’une manière distincte, les pathogènes extracellulaires, tels que la bactérie Citrobacter rodentium, induisent la production d’interleukine (IL)-17 par les lymphocytes T CD4+. Cette cytokine permet le recrutement et l’activation des polynucléaires neutrophiles qui jouent un rôle important dans le contrôle de cette infection bactérienne. Une fois l’agent infectieux éliminé, le nombre de lymphocytes T CD4+ spécifiques de ce pathogène diminue fortement, et seule une petite fraction demeure, formant les lymphocytes T CD4+ mémoires. Ces cellules sont capables de réagir plus rapidement et plus efficacement que les lymphocytes T CD4+ naïfs lors d’une rencontre ultérieure avec le même pathogène, permettant ainsi une protection à long terme de l’hôte. |
La flore commensale module la fonction des lymphocytes T CD4 +
Plusieurs études récentes ont mis en évidence l’aptitude de la flore commensale à moduler la différenciation, la maturation et les fonctions effectrices des lymphocytes T CD4+ au niveau de la muqueuse intestinale, en situation d’homéostasie et au cours d’une infection [
3–
5]. Les bactéries commensales favorisent ainsi la mise en place des défenses immunitaires innées et adaptatives à la surface de la muqueuse intestinale. Cependant, elles représentent aussi un danger potentiel pour l’hôte, car elles sont susceptibles d’induire des réactions inflammatoires délétères pour l’intestin. Ce paradoxe s’explique par le fait que les microbes commensaux et les pathogènes partagent les mêmes motifs capables d’induire une réponse inflammatoire. Le système immunitaire intestinal doit donc maintenir en permanence un état de tolérance vis-à-vis de la flore commensale, tout en étant capable d’induire des réponses immunes pro-inflammatoires protectrices contre les pathogènes gastro-intestinaux. Le maintien d’un tel équilibre repose sur l’existence de mécanismes de régulation garantissant une réactivité réduite du système immunitaire intestinal vis-à-vis des bactéries commensales inoffensives. Une déficience de ces mécanismes résulte en une inflammation anormale du tube digestif aboutissant au développement de maladies inflammatoires chroniques de l’intestin, telles que la maladie de Crohn et la rectocolite hémorragique (colite ulcéreuse) [
6]. |
Rupture de la barrière intestinale au cours d’une infection à T. gondii et conséquences sur l’immunité
Toxoplasma gondii est un parasite intracellulaire transmis par voie orale qui infecte la muqueuse intestinale avant de disséminer dans tout l’organisme. L’infection par T. gondii se caractérise chez certaines souris de laboratoire par une réponse immunitaire pro-inflammatoire au niveau de l’intestin, dont la conséquence majeure est une destruction de la muqueuse intestinale. L’intégrité de cette dernière est alors compromise, permettant ainsi la translocation des bactéries commensales à travers la muqueuse intestinale et leur dissémination vers d’autres organes. Dans une telle situation, le système immunitaire est-il toujours capable de distinguer les bactéries commensales inoffensives ayant traversé la muqueuse intestinale de l’agent infectieux, et de répondre de façon adéquate à ces deux types de micro-organismes ? Notre laboratoire s’intéresse depuis plusieurs années à la réponse des cellules T vis-à-vis des antigènes commensaux au cours des infections gastro-intestinales. Dans une étude récente [
7], nous avons ainsi analysé la population de lymphocytes T CD4+ spécifiques de la flagelline, une protéine présente à la surface de certaines bactéries commensales appartenant au genre Clostridium et faisant partie du microbiote intestinal murin. Chez les souris non infectées, ces bactéries inoffensives restent confinées au niveau de la lumière intestinale, et les cellules T CD4+ qui leur sont spécifiques demeurent dans un état dormant ou naïf. Au cours de l’infection par T. gondii, les bactéries commensales sont détectées en dehors de la lumière intestinale, notamment dans plusieurs organes lymphoïdes comme les ganglions mésentériques et la rate. Cette migration bactérienne entraîne l’activation des lymphocytes T CD4+ spécifiques de la flagelline. Ces derniers prolifèrent et se différencient de manière tout à fait semblable aux lymphocytes T CD4+ spécifiques des antigènes de T. gondii. En particulier, ils deviennent capables de produire de l’IFN-γ. Ainsi, bien que spécifiques des antigènes des bactéries commensales extracellulaires, ces cellules acquièrent, au cours de l’infection par T. gondii, des fonctions effectrices caractéristiques des lymphocytes de type Th1 et adaptées à l’élimination des pathogènes intracellulaires. Comme pour les lymphocytes spécifiques de T. gondii, un nombre restreint de lymphocytes T CD4+ mémoires spécifiques de la flagelline sont détectés chez la souris plusieurs mois après l’élimination du parasite et le rétablissement de l’intégrité de la barrière intestinale. Ainsi, nos travaux révèlent pour la première fois que le système immunitaire est incapable de faire la distinction entre antigènes commensaux et pathogènes au cours d’une infection gastro-intestinale. La rupture de la barrière intestinale faisant suite à la prolifération de l’agent infectieux entraîne une perte de tolérance vis-à-vis de la flore commensale et une activation des lymphocytes T spécifiques des antigènes commensaux, qui survivent à long terme en tant que cellules T mémoires une fois l’infection résolue (Figure 1).
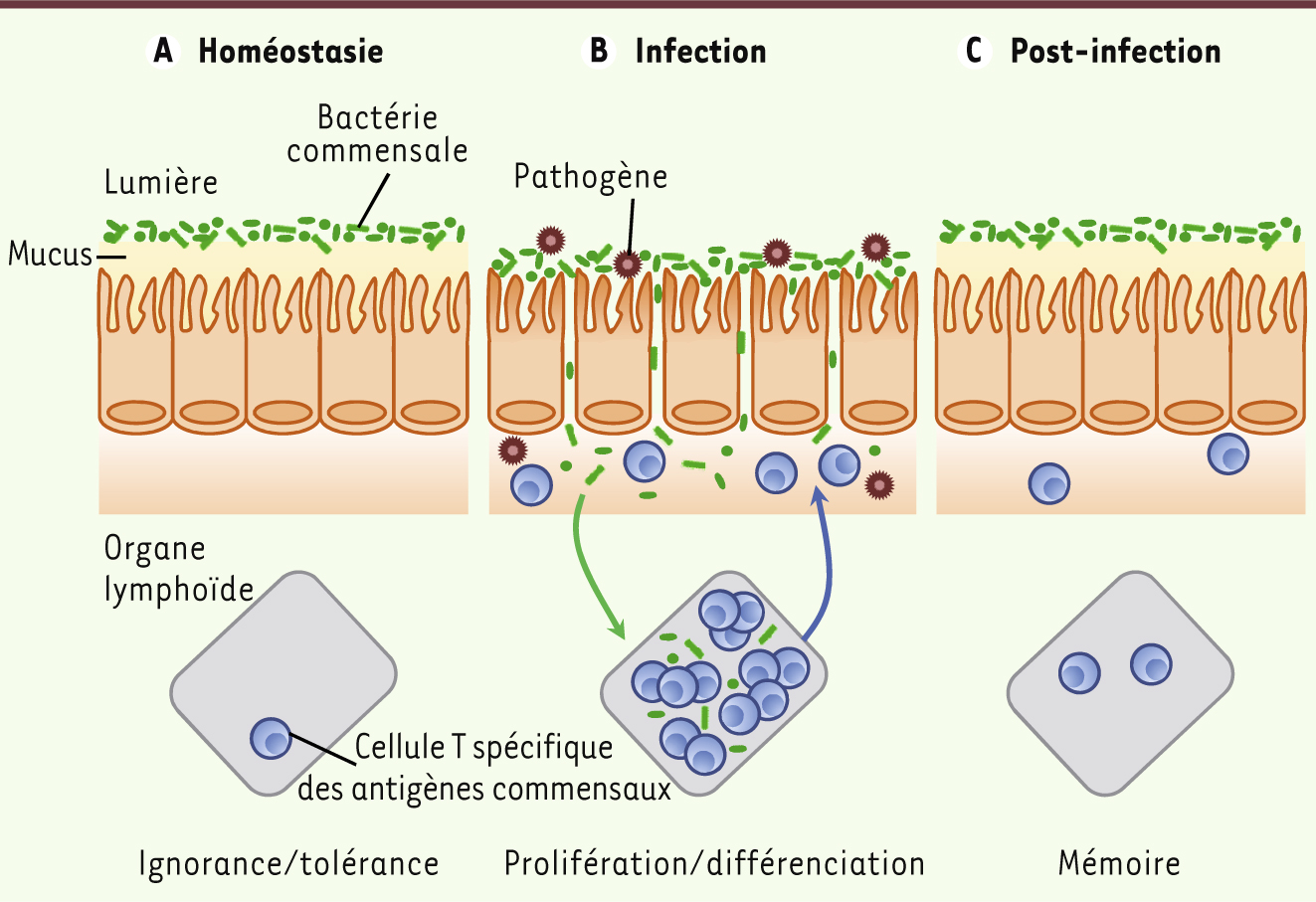
 | Figure 1.
La rupture de la barrière intestinale entraîne une perte de tolérance vis-à-vis du microbiote intestinal. La lumière intestinale est peuplée par un grand nombre de bactéries non pathogènes, appelées bactéries commensales. A. En conditions d’homéostasie, certains lymphocytes T CD4+ présents dans les organes lymphoïdes, tels que la rate ou les ganglions lymphatiques, sont spécifiques des antigènes commensaux. Cependant, la plupart du temps, ces cellules T ignorent la présence des bactéries commensales et demeurent donc dans un état naïf. B. À la suite de l’infection par un pathogène gastro-intestinal, l’intégrité de la muqueuse intestinale peut être compromise, permettant la translocation des bactéries commensales vers d’autres organes. Ceci a pour conséquence l’activation et la prolifération des lymphocytes T spécifiques du pathogène (non representés sur cette figure), mais aussi celles des cellules T spécifiques des bactéries commensales. Ces cellules migrent alors depuis les organes lymphoïdes vers la muqueuse intestinale. C. Après l’élimination de l’agent infectieux et le rétablissement de la barrière intestinale, une population de lymphocytes T spécifiques des antigènes commensaux persiste au niveau de la muqueuse intestinale en tant que cellules T mémoires. |
Cependant, malgré la persistance des lymphocytes T CD4+ activés et spécifiques de la flore commensale, nous n’avons jamais observé le développement de symptômes typiques des maladies inflammatoires de l’intestin chez les souris après l’élimination de T. gondii. Nos résultats soulèvent plusieurs questions concernant l’impact des infections gastro-intestinales sur la capacité du système immunitaire à maintenir un état de tolérance pour le microbiote intestinal. Ainsi, il est essentiel d’étudier les mécanismes et les molécules impliqués dans le contrôle de l’activité des lymphocytes T spécifiques des antigènes commensaux chez les individus sains ayant été exposés au cours de leur vie à des pathogènes gastro-intestinaux. De même, il apparaît indispensable d’évaluer dans quelle mesure un dérèglement de ces cellules et/ou de la barrière intestinale pourrait être à l’origine du développement des maladies inflammatoires chroniques de l’intestin. |
Flore commensale cutanée et immunité de la peau Le tractus gastro-intestinal constitue l’habitat du corps humain le plus riche en flore microbienne commensale. Cependant, la muqueuse intestinale n’est pas le seul tissu dont la surface est peuplée par une flore microbienne [
8,
9]. La peau est également le siège d’un écosystème microbien riche et divers, dont la densité et la composition varient selon le site anatomique [9]. Si l’influence du microbiote intestinal sur la réponse immunitaire au niveau local et systémique a été l’objet de nombreuses études [
4,
10], l’effet sur le système immunitaire de la flore commensale au niveau des autres surfaces épithéliales du corps humain reste relativement méconnu. De plus, on ne sait pas si les mécanismes assurant le dialogue réciproque entre système immunitaire et bactéries commensales sont identiques ou distincts selon l’environnement tissulaire. Dans un travail récent [
11], nous avons étudié le rôle du microbiote de la peau dans le développement des réponses immunitaires cutanées et la protection de l’hôte contre les infections. Tirant parti de l’utilisation de souris dépourvues de tout germe (axéniques), nous avons découvert que la flore commensale est absolument nécessaire au développement de l’immunité de la peau. Ainsi, les souris axéniques sont incapables de développer une réponse immunitaire protectrice vis-à-vis de l’infection cutanée induite par le parasite Leishmania major. En particulier, les lymphocytes T purifiés à partir du derme des souris axéniques sécrètent très peu de cytokines pro-inflammatoires, cruciales pour l’élimination de L. major. La colonisation des souris axéniques par Staphylococcus epidermidis, une bactérie résidente de la flore cutanée, suffit à rétablir une réponse immunitaire protectrice contre L. major. À l’inverse, la colonisation par les bactéries filamenteuses segmentées (SFB) qui peuplent naturellement le tube digestif, ne protège pas les souris axéniques contre l’infection avec L. major. La flore cutanée favorise donc la mise en place des défenses immunitaires, spécifiquement au niveau de la peau, en modulant localement les fonctions effectrices des lymphocytes T. Nos travaux nous ont permis d’identifier certains mécanismes permettant la modulation de l’immunité cutanée par le microbiote de la peau. Ainsi, la production de la cytokine IL-1 dans le derme est absolument nécessaire pour permettre aux lymphocytes T, présents localement, d’acquérir la capacité à sécréter des cytokines pro-inflammatoires. De plus, la flore cutanée amplifie l’effet de l’IL-1 sur les lymphocytes T (Figure 2). Au contraire, la sécrétion de cytokines pro-inflammatoires par les cellules T CD4+ présentes dans la muqueuse intestinale ne requiert pas la présence d’IL-1. Ceci suggère que les mécanismes impliqués dans le dialogue entre les cellules du système immunitaire et le microbiote sont distincts selon les tissus.
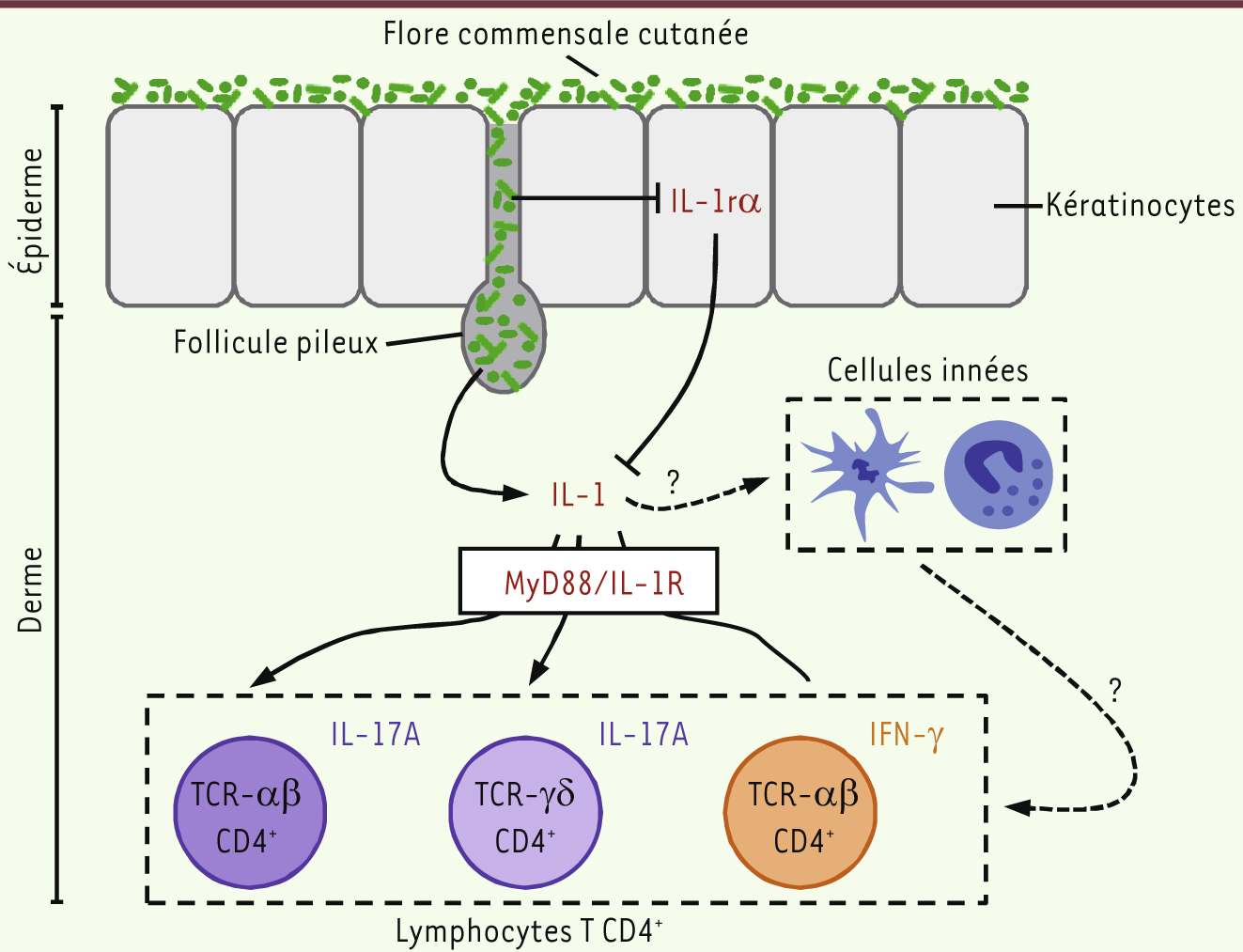
 | Figure 2.
La flore commensale cutanée influence les fonctions effectrices des lymphocytes T présents dans la peau en modulant les effets de l’IL-1. La production de cytokine pro-inflammatoires par les lymphocytes T CD4+ présents dans le derme nécessite la présence d’IL-1. L’IL-1 agit directement (ou indirectement par l’intermédiaire des cellules de l’immunité innée) sur les cellules T CD4+ qui expriment le récepteur pour cette cytokine (IL-1R). La molécule MyD88 (myeloid differentiation primary response 88) est cruciale pour la transduction intracellulaire du signal induit par la liaison de l’IL-1 sur son récepteur à la surface des cellules. La flore cutanée amplifie les effets de l’IL-1, non seulement en modulant positivement la sécrétion de cette dernière, mais aussi en régulant négativement la production par les kératinocytes de l’antagoniste du récepteur pour l’IL-1, IL-1rα, inhibiteur naturel de l’interaction de l’IL-1 avec son récepteur. |
Dans l’ensemble, nos observations illustrent l’importance des microbiotes qui peuplent les niches épithéliales autres que la muqueuse intestinale, telles que la peau, dans la régulation de l’immunité tissulaire locale. En particulier, elles démontrent que les bactéries commensales cutanées ne sont pas simplement des acteurs passifs qui protègent la peau vis-à-vis des pathogènes en occupant la surface de l’épiderme. Ces bactéries participent aussi activement à la mise en place de l’immunité cutanée et contribuent au rôle de barrière protectrice de la peau contre les agressions extérieures. Plusieurs études suggèrent l’existence d’une relation entre les perturbations dans la composition du microbiote de la peau et le développement de troubles cutanés, tels que le psoriasis et la dermatite atopique. Les recherches futures devront donc aborder de manière approfondie le rôle joué par le microbiote dans les maladies inflammatoires de la peau, afin de confirmer ou non cette hypothèse. |
Nos récents travaux mettent en évidence la relation à double tranchant entre l’hôte et ses partenaires microbiens. La flore commensale apporte d’énormes bénéfices, en particulier en permettant le maintien d’un statut immunologique adéquat à la surface des muqueuses. En revanche, la présence d’une population microbienne si vaste et diverse peut aussi avoir de nombreux inconvénients, y compris l’induction par les antigènes commensaux de réponses immunitaires inadaptées et délétères. Il apparaît donc essentiel de comprendre comment l’hôte contrôle et maintient cet équilibre fragile avec son microbiote. Une telle compréhension nous fournira des informations cruciales sur l’impact de la flore commensale sur notre santé, et offrira la possibilité de pouvoir manipuler cette dernière pour mieux prévenir ou traiter certaines maladies. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Qin
J
,
Li
R
,
Raes
J
, et al.
A human gut microbial gene catalogue established by metagenomic sequencing . Nature.
2010; ; 464 : :59.–65. 2.
Kau
AL
,
Ahern
PP
,
Griffin
NW
, et al.
Human nutrition, the gut microbiome and the immune system . Nature.
2011; ; 474 : :327.–336. 3.
Hall
JA
,
Bouladoux
N
,
Sun
CM
, et al.
Commensal DNA limits regulatory T cell conversion and is a natural adjuvant of intestinal immune responses . Immunity.
2008; ; 29 : :637.–649. 4.
Ivanov
II
,
Frutos Rde
L
,
Manel
N
, et al.
Specific microbiota direct the differentiation of IL-17-producing T-helper cells in the mucosa of the small intestine . Cell Host Microbe.
2008; ; 4 : :337.–349. 5.
Gaboriau-Routhiau
V
,
Rakotobe
S
,
Lecuyer
E
, et al.
The key role of segmented filamentous bacteria in the coordinated maturation of gut helper T cell responses . Immunity.
2009; ; 31 : :677.–689. 6.
Saleh
M
,
Elson
CO
. Experimental inflammatory bowel disease: insights into the host-microbiota dialog . Immunity.
2011; ; 34 : :293.–302. 7.
Hand
TW
,
Dos Santos
LM
,
Bouladoux
N
, et al.
Acute gastrointestinal infection induces long-lived microbiota-specific T cell responses . Science.
2012; ; 337 : :1553.–1556. 8.
Costello
EK
,
Lauber
CL
,
Hamady
M
, et al.
Bacterial community variation in human body habitats across space and time . Science.
2009; ; 326 : :1694.–1697. 9.
Grice
EA
,
Kong
HH
,
Conlan
S
, et al.
Topographical and temporal diversity of the human skin microbiome . Science.
2009; ; 324 : :1190.–1192. 10.
Wu
HJ
,
Ivanov
II
,
Darce
J
, et al.
Gut-residing segmented filamentous bacteria drive autoimmune arthritis via T helper 17 cells . Immunity.
2010; ; 32 : :815.–827. 11.
Naik
S
,
Bouladoux
N
,
Wilhelm
C
, et al.
Compartmentalized control of skin immunity by resident commensals . Science.
2012; ; 337 : :1115.–1119. |