| |
| Med Sci (Paris). 2013 March; 29(3): 273–278. Published online 2013 March 27. doi: 10.1051/medsci/2013293013.Neurotoxicité des pesticides Quel impact sur les maladies neurodégénératives ? Steeve H. Thany,1* Pascal Reynier,2 and Guy Lenaers3 1Laboratoire récepteurs et canaux ioniques membranaires, UPRES EA 2647-USC INRA 1330, Université d’Angers, UFR sciences, 2, boulevard Lavoisier, 49045Angers, France 2Biologie neurovasculaire et mitochondriale intégrée, UMR CNRS 6214-Inserm 1083, département de biochimie et génétique, CHU d’Angers, 4, rue Larrey, 49933Angers Cedex 9, France 3Institut des Neurosciences de Montpellier, neuropathies optiques héréditaires et déficits mitochondriaux, Université de Montpellier I et II, Inserm U1051, hôpital Saint-Éloi, 34091Montpellier Cedex, France |

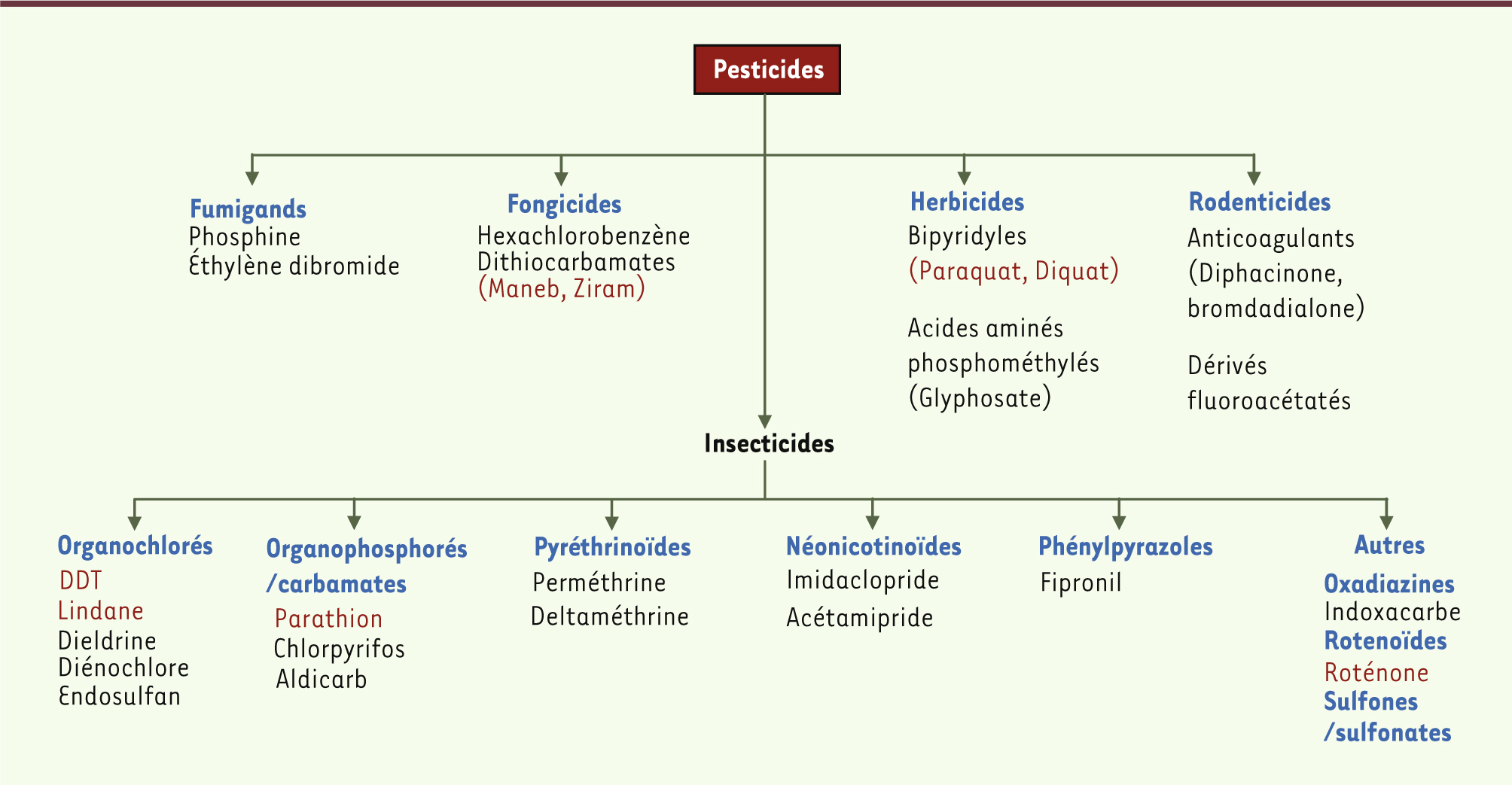
Les pesticides sont des molécules largement disséminées dans l’environnement. Ils sont toxiques pour les insectes et, dans une moindre mesure, pour les organismes aquatiques et les mammifères. De ce fait, ils sont couramment classés en fonction des organismes ciblés et/ou de leur mode d’utilisation. Ils regroupent cinq familles de molécules dont les modes d’action sont très variés : dont les fumigants, les fongicides, les herbicides, les rodenticides et les insecticides (Figure 1). On peut également y ajouter les acaricides et les molluscides. Chaque famille inclut des sous-familles de produits et des métabolites avec des compositions chimiques différentes, ce qui augmente la complexité des modes d’action. À ce jour, peu d’études ont évalué l’effet neurotoxique des pesticides chez l’homme. Néanmoins, des études épidémiologiques ont suggéré un lien entre la survenue des maladies neurodégénératives et le fait d’être agriculteur, et/ou de travailler ou de vivre au voisinage d’une exploitation agricole utilisant des pesticides. Les cas d’empoisonnement aigu avec ces molécules démontrent leur caractère hautement neurotoxique. De plus, la mise en évidence post mortem de taux élevés de pesticides dans des structures cérébrales comme le noyau caudé chez les individus parkinsoniens [
1,
2] suggère un réel problème d’exposition chronique de ces populations. Ces dernières années, le nombre de publications illustrant les effets neurotoxiques des pesticides chez l’homme n’a cessé d’augmenter ; les études concernent essentiellement la neurotoxicité des herbicides, comme le paraquat, et des insecticides. La majorité des insecticides, y compris les organophosphorés, les carbamates, les organochlorés, les fongicides et les fumigants, sont neurotoxiques. Ce sont les organochlorés, puis les organophosphorés qui les ont remplacés, qui ont entraîné le plus de polémique en santé humaine ; citons notamment les effets du DDT (1,1,1-trichloro-2,2-bis(4-chlorophényl) éthane), du lindane (encore utilisé pour des applications restreintes) et de la chlordécone, compte tenu de leur persistance et de leur rémanence dans les sols, jusqu’à plusieurs décennies après leur utilisation. Bien qu’interdites dans la plupart des pays développés, certaines de ces molécules, comme le DDT, sont réutilisées pour le contrôle du vecteur de la malaria dans les zones endémiques.
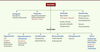 | Figure 1.
Les différentes familles de pesticides. En rouge, quelques molécules pour lesquelles l’effet neurotoxique chez les mammifères a été mis en évidence. |
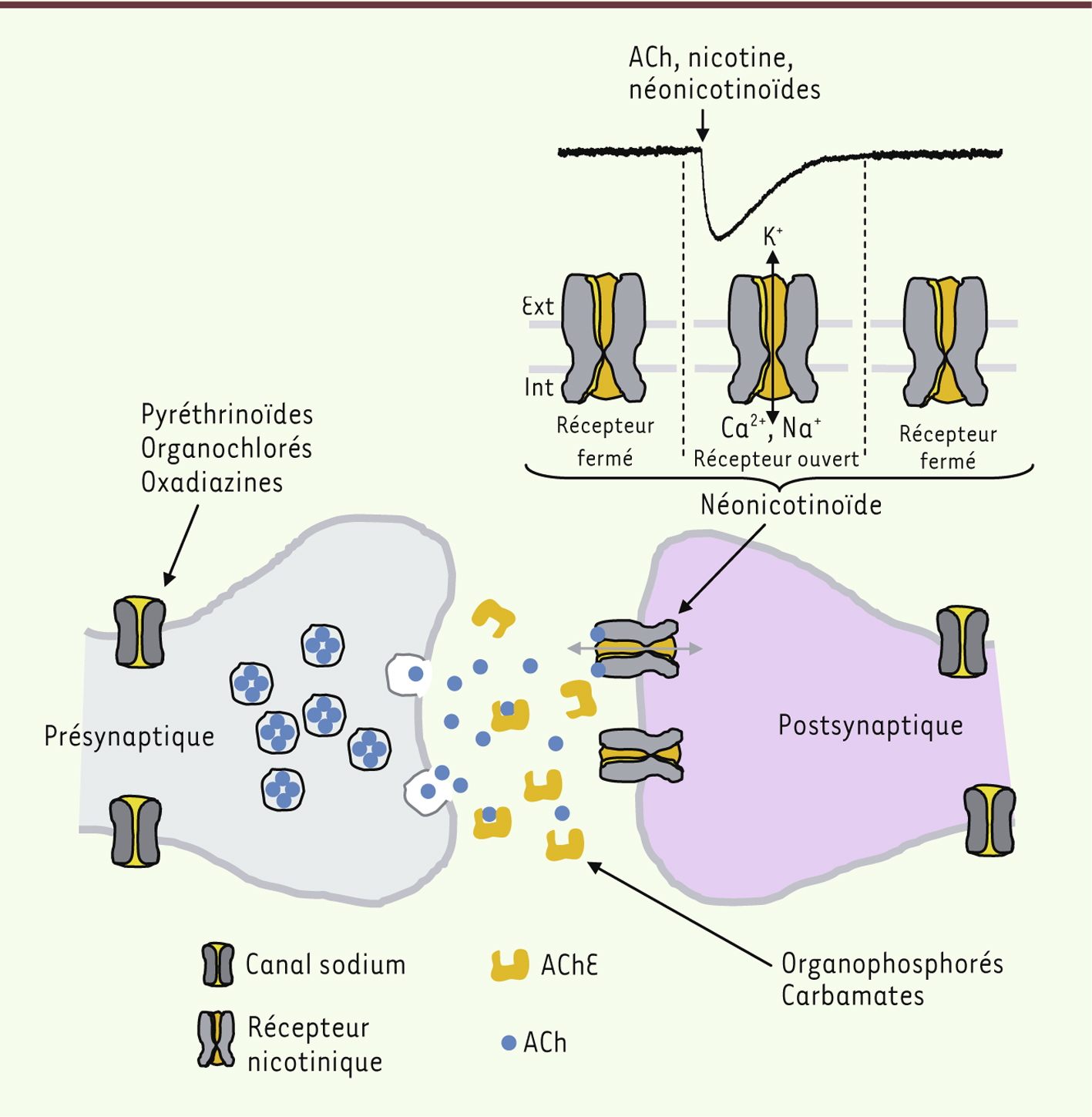
Les effets neurotoxiques peuvent être classés en quatre groupes principaux : (1) ceux qui causent une perte des neurones par apoptose ou nécrose (neuropathies) ; (2) ceux qui entraînent une dégénérescence des axones (axonopathies) ; (3) ceux qui altèrent la structure de la myéline (myélinopathies) ; et (4) ceux qui affectent la neurotransmission, en interférant avec la libération ou la recapture des neurotransmetteurs, ou en agissant comme agoniste/antagoniste de récepteurs. La quasi-totalité des insecticides ciblent le système nerveux central des insectes, en agissant comme agonistes des récepteurs de l’acétylcholine (ACh) de type nicotinique, ou comme inhibiteurs des récepteurs de l’acide γ-aminobutyrique (GABA), en perturbant la transmission synaptique par une action sur les canaux dépendant du sodium et du voltage, ou encore en bloquant l’action de l’acétylcholinestérase (AChE) (Figure 2). Ces effets ubiquitaires sont à l’origine de leurs actions sur les récepteurs des mammifères, et expliquent leur nocivité chez l’homme. Les organophosphorés ne ciblent pas uniquement l’AChE. Certains sont capables de phosphoryler une protéine du système nerveux central, la neuropathy target esterase (NTE) et d’inhiber son activité catalytique. La NTE est une sérine estérase isolée à partir de cerveau de poulet. Fortement exprimée chez plusieurs espèces [
3], elle est sensible à des concentrations micromolaires de mipafox et de chlorpyriphos. Sa mutation entraîne des déficits moteurs au niveau périphérique, et plusieurs études suggèrent que son activité est inhibée par les organophosphorés conduisant à des polyneuropathies d’apparition retardée. Le chlorpyriphos, par exemple, est associé à des polyneuropathies d’apparition retardée par démyélinisation des nerfs périphériques [
4,
5]. Ainsi, le chlorpyriphos et le mipafox, contrairement au paraoxon qui n’affecte pas la protéine NTE, sont considérés comme des inducteurs de neuropathies. Dans ce contexte, certaines études ont retrouvé des signes d’atrophie cérébrale diffuse après intoxication aux organophosphorés. La toxicité des insecticides sur le système nerveux central suggère aussi qu’ils peuvent induire certaines maladies neurodégénératives comme la maladie de Parkinson, la maladie d’Alzheimer ou la sclérose latérale amyotrophique (SLA). Pour la maladie d’Alzheimer et la SLA, les études épidémiologiques ne sont pas encore assez nombreuses pour attester d’un lien réel. Mais il a été montré que l’exposition chronique aux pesticides induit une altération des performances cognitives et psychomotrices associée à une atteinte neuronale chez l’homme [
6,
7].
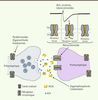 | Figure 2.
Effets des insecticides sur la synapse cholinergique. Les organophosphorés et les carbamates inhibent l’activité de l’acétylcholinestérase (AChE), responsable de la dégradation de l’acétylcholine (ACh), ce qui cause l’accumulation de l’ACh au niveau synaptique, avec une hyperstimulation du système cholinergique. De la même manière, les néonicotinoïdes agissent sur le système cholinergique, mais comme agonistes des récepteurs à l’ACh de type nicotinique. Leur fixation sur le récepteur entraîne un courant entrant comme avec l’ACh et la nicotine, ce qui se traduit par le passage des ions Na+, K+ et Ca2+ au travers du récepteur. Leur persistance prolongée au niveau de la synapse induit une hyperstimulation du système. Les canaux sodium (Na+) sont la cible des organochlorés, des oxadiazines et des pyréthrinoïdes. Il existe deux types de pyréthrinoïdes (type I et II) agissant sur ces canaux sodium. |
|
Les mécanismes de neurotoxicité cellulaire des pesticides : les modèles de la roténone et du paraquat La quantité de produits disponibles sur le marché, le type d’exposition (aiguë ou chronique), la durée de l’exposition et les populations concernées (les plus jeunes pouvant être beaucoup plus sensibles aux effets neurotoxiques des pesticides) font qu’il est très difficile de décrire le mode d’action de ces molécules et de définir des modèles de toxicité. À ce jour, les modèles de neurotoxicité utilisant la roténone et le paraquat demeurent les seuls qui permettent d’appréhender les mécanismes de toxicité intracellulaire des pesticides (Figure 3). La roténone est un insecticide naturel de la famille des isoflavones, extrait de légumineuses tropicales comme Derris elliptica et Lonchocarpus nicou, qui est utilisée à la fois comme insecticide et acaricide. Très lipophile, elle est capable de traverser la barrière hémato-encéphalique et d’atteindre une concentration maximale dans le système nerveux. La roténone est couramment utilisée pour induire des affections multisystémiques de type syndrome parkinsonien dans des modèles animaux. Bien que la sévérité des dégénérescences neuronales soit variable d’un modèle à l’autre, on peut observer, dans certains neurones, la présence des corps de Lewy qui sont des inclusions éosinophiles apparaissant précocement dans la maladie de Parkinson, ainsi qu’une hyperphosphorylation de la protéine Tau [
8–
10]. Des réductions de 35 % de la densité des protéines de transport de la sérotonine dans le striatum, de 26 % du nombre des neurones noradrénergiques dans le locus coeruleus et de 29 % de celui des neurones cholinergiques dans le noyau pédonculopontique sont aussi associées à l’exposition à la roténone [
11]. Contrairement à la roténone, l’herbicide paraquat (N,N-diméthyl-4-4-bipyridium), interdit en Europe depuis 2007, n’est pas capable de traverser librement la barrière hémato-encéphalique. Mais, plusieurs hypothèses ont été avancées afin d’expliquer sa neurotoxicité. Le paraquat utiliserait les systèmes de transport des acides aminés neutres, probablement celui de la leucine, afin de traverser la barrière hémato-encéphalique [
12]. Une fois dans le milieu extracellulaire, il pourrait entraîner une réaction inflammatoire qui activerait les cellules gliales et prédisposerait les neurones dopaminergiques à une mort cellulaire prématurée, en cas d’expositions répétées [
13,
14]. Dans tous les cas, bien que les mécanismes de neurotoxicité de la roténone et du paraquat demeurent encore débattus, il semble que la surproduction d’espèces réactives oxygénées (ERO) contribue, elle aussi, au caractère neurotoxique.
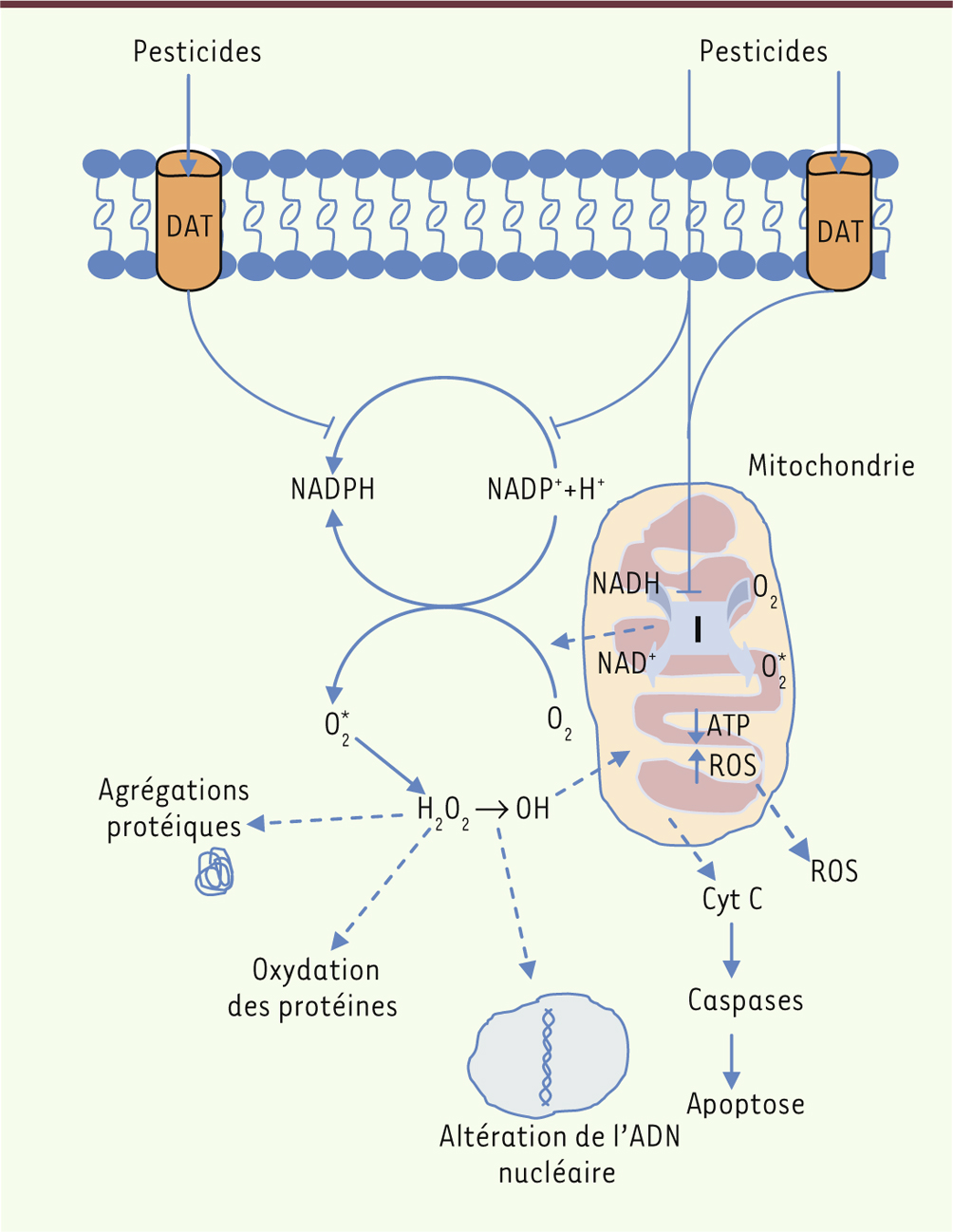
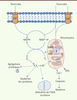 | Figure 3.
Effets des pesticides sur la mitochondrie et conséquences au niveau cellulaire. Plusieurs hypothèses suggèrent que les pesticides pourraient pénétrer dans les cellules directement au travers de la membrane ou grâce à des mécanismes de transport. Ainsi, ils pourraient agir directement sur l’équilibre NADH/NAD+ en augmentant les espèces réactives oxygénées (ROS, reactive oxygen species) qui perturberaient le fonctionnement mitochondrial. Mais ils pourraient également agir directement sur le complexe I de la chaîne respiratoire entraînant une augmentation des ERO, une induction des mécanismes apoptotiques par une libération du cytochrome c (Cyt c) et une activation des caspases, une altération de l’ADN nucléaire, ainsi qu’une oxydation et une agrégation des protéines, telles que l’α-synucléine. |
La mitochondrie, une cible de choix des pesticides neurotoxiques ? Le métabolisme énergétique et la dynamique mitochondriale sont fréquemment affectés dans les maladies neurodégénératives. Le rôle crucial des mitochondries dans la physiologie neuronale en fait l’une des principales cibles des insecticides. Un argument de poids en faveur de cette hypothèse est apporté par les études réalisées chez des toxicomanes ayant consommé une drogue de synthèse, le 1-méthyl-4-phényl-1,2,3,6-tétrahydropyridine (MPTP). Il a été montré que la consommation de cette drogue provoquait l’apparition d’un syndrome parkinsonien lié à la présence du métabolite du MPTP, le 1-méthyl-4-phénylpyridinium (MPP +) [
15], qui se trouve être un herbicide, le cyperquat. Cette neurotoxine, dont la structure chimique est proche de celle du paraquat, est un puissant inhibiteur du complexe I de la chaîne respiratoire mitochondriale. Ainsi, la ressemblance structurale entre le paraquat et le MPP + a conduit à l’idée que ces deux composés puissent avoir des mécanismes similaires de neurotoxicité. Comme le MPP +, le paraquat (PQ) serait transformé par les monoamines oxydases dans les cellules gliales. Sous sa forme réduite, le PQ + pénètrerait dans les neurones dopaminergiques grâce aux protéines transportant la dopamine et conduirait à la mort cellulaire par une inhibition du complexe I couplée à une induction d’un stress oxydatif. Cependant, la différence de polarité entre le PQ et le MPTP (le PQ possède deux charges positives) fait que les deux molécules ne peuvent pas traverser la barrière hémato-encéphalique de la même manière ; les deux composés sont ainsi différemment distribués dans le cerveau des rats testés [
16,
17]. D’autres études montrent également que le paraquat est capable d’induire une augmentation des ERO par l’intermédiaire du complexe III de la chaîne respiratoire [
18,
19]. L’inhibition du complexe I par la roténone est également bien documentée. L’altération de l’activité de ce complexe chez des rats ou des souris exposés à des doses chroniques de roténone réduit la production énergétique, la diminution de la production d’ATP étant à l’origine d’une dépolymérisation des microtubules [
20–
22]. La perturbation du flux d’électrons au sein du complexe I de la chaîne respiratoire expliquerait la surproduction des ERO également observée lors de ces expositions chroniques. En parallèle, le changement des états d’oxydoréduction du couple NADH/NAD + entraînerait un déséquilibre redox pouvant stimuler la mort cellulaire. À noter qu’un mécanisme similaire affectant le complexe I a été observé in vitro et in vivo pour d’autres pesticides dont un acaricide, le pyridaben, ce qui suggère que l’inhibition du complexe I pourrait représenter un mécanisme de neurotoxicité commun à plusieurs familles de pesticides. Une susceptibilité accrue aux pesticides dans les formes génétiques rares de la maladie de Parkinson ? La maladie de Parkinson est la maladie neurodégénérative la plus fortement suspecte d’être reliée à l’exposition aux pesticides. Seize locus ont été associés ( Park1-16) à des formes héréditaires rares de cette maladie [
23]. L’α-synucléine (Park1) est une protéine soluble, à l’origine exprimée sur les terminaisons synaptiques, et dont le rôle exact demeure inconnu. Trois mutations principales, A30P, E46K et A53T, sont associées à une forme de transmission autosomique dominante de la maladie de Parkinson [
24–
26]. En conditions physiologiques, l’α-synucléine protégerait les cellules dopaminergiques contre la neurotoxicité des insecticides, maintenant un faible taux de production d’ERO, préservant les fonctions mitochondriales et inhibant les mécanismes apoptotiques. Les formes mutées réduiraient cet effet protecteur, entraînant l’accumulation dans les neurones d’agrégats d’α-synucléine, une désorganisation du centrosome, une rétraction des neurites et une déstabilisation des microtubules [
27]. Des mutations dans les gènes DJ-1 ( Park7), Pink1 et Parkin, impliqués dans d’autres formes héréditaires autosomiques récessives de la maladie, ont également été associées à la susceptibilité aux pesticides. L’effet combiné de la suppression de la Parkin et d’une exposition à la roténone reproduit les déficits cellulaires observés dans la maladie de Parkinson dans des cellules primaires issues de souris [
28]. DJ-1 semble être un inducteur de la mort cellulaire produite par les insecticides [ 23], et la neurotoxicité du paraquat et de la roténone serait paradoxalement diminuée dans des cellules d’embryons de souris n’exprimant pas la protéine DJ-1. Cet effet serait associé à une diminution de l’expression de protéines impliquées dans les mécanismes apoptotiques, comme la procaspase-3 et la polymérase ADP-ribose [
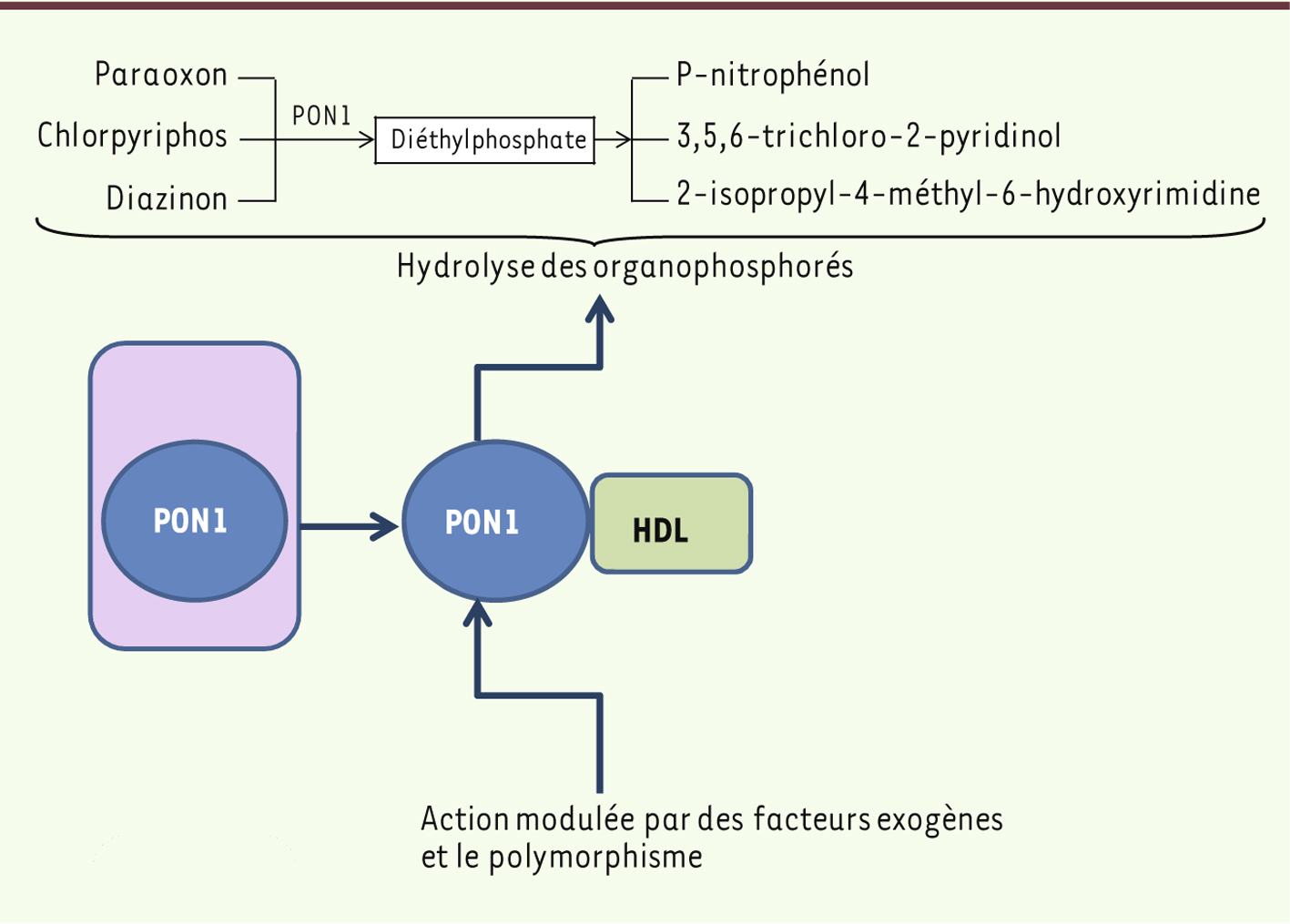
29]. Vers une neurotoxicogénétique des pesticides ? La plupart des insecticides sont, après absorption, soit activés sur le plan de leur toxicité, soit détoxifiés par des oxydases, des hydrolases, ou des transférases hépatiques, dont les activités pourraient être augmentées ou réduites en fonction de l’expression de polymorphismes génétiques. Une susceptibilité génétique individuelle a été récemment associée à la famille des gènes codant pour les paraoxonases (PON). La paraoxonase 1 (PON1) est une estérase/lactonase sérique synthétisée par le foie et exprimée exclusivement à la surface des lipoprotéines de haute densité (HDL). Cette protéine est connue pour sa capacité à hydrolyser les composés organophosphorés (Figure 4). Plusieurs études suggèrent que PON1 joue un rôle crucial sur la prédisposition génétique au développement des maladies neurodégénératives dues aux expositions aux pesticides [
30,
31]. En effet, les insecticides organophosphorés, en inhibant l’acétylcholine estérase, entraînent une exocytose importante d’acétylcholine, d’où une hyperstimulation des récepteurs cholinergiques, qui peut aboutir à la mort de la cellule par excitotoxicité. Dans les conditions physiologiques, PON1 dégrade les organophosphorés et protège l’organisme contre l’hypersécrétion d’acétylcholine. Cependant, des données récentes, obtenues in vitro, ont démontré que le système cholinergique n’était pas le seul atteint puisque certains organophosphorés, comme le chlorpyriphos et le diazinon, peuvent être toxiques à des faibles concentrations sans affecter la sécrétion cholinergique. PON1 joue un rôle important dans la détoxification des organophosphorés, comme le parathion et le chlorpyriphos. Chez l’homme, il existe un polymorphisme génétique important de PON1. Plusieurs variants, comme L55M et Q192R, se sont imposés comme les allèles les plus intéressants. PON1-L55M serait associé à une diminution de la concentration de l’enzyme, alors que PON1-Q192R affecterait l’activité hydrolytique de l’enzyme. Le variant PON1-L55M entraîne un défaut de détoxification qui pourrait augmenter la susceptibilité aux organophosphorés [
32,
33]. Par ailleurs, il existe trois paralogues du gène PON, localisés sur le chromosome 7, dont les protéines exercent une activité hydrolytique sur de nombreux xénobiotiques [
34]. Bien que des données contradictoires aient été publiées, certaines études suggèrent que des variants de PON1, PON2 et PON3 pourraient être associés à la maladie d’Alzheimer et à la sclérose latérale amyotrophique.
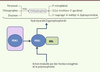 | Figure 4.
Effet de la paraoxonase (PON1) sur l’hydrolyse des pesticides. PON1 est exprimée de manière prédominante dans le foie, puis sécrétée dans le plasma où elle va prévenir la formation de LDL oxydés en les inhibant. L’activité de PON1 peut être modulée par des composés exogènes, modifiant ainsi l’hydrolyse de pesticides comme les organophosphorés (chlorpyriphos, diazinon, paraoxon). |
|
Des études épidémiologiques ont suggéré un impact des pesticides sur la survenue de maladies neurodégénératives. Bien que le constat soit clair quant au risque sanitaire lié à l’utilisation de ces produits, les données scientifiques actuelles restent très contradictoires et ne permettent pas de conclure définitivement sur le mode d’action des pesticides. C’est particulièrement vrai pour la maladie de Parkinson puisque plusieurs mécanismes intracellulaires aboutissant à une neurotoxicité des pesticides ont été décrits. Certains pesticides, comme la roténone, le paraquat et le maneb peuvent induire une pathologie parkinsonienne. Leur effet passe certainement, au moins en partie, par une augmentation du stress oxydatif, une exacerbation de certains processus intracellulaires comme l’agrégation de l’α-synucléine, et une altération des fonctions énergétiques mitochondriales. Cependant, il est encore très difficile à ce jour de tirer des conclusions sur d’autres pesticides parmi les plus répandus, tels que les pyréthrinoïdes et les néonicotinoïdes. Compte tenu des problèmes de santé publique et des polémiques autour de l’usage des pesticides, il devient urgent de développer des études de toxicité chronique pour identifier les mécanismes précis qui pourraient associer l’exposition aux pesticides et la survenue de pathologies neurodégénératives chroniques. Un deuxième objectif serait de stimuler la recherche de nouvelles molécules ciblant plus spécifiquement les insectes et dénuées d’effets toxiques chez l’homme. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Corrigan
FM
,
Murray
L
,
Wyatt
CL
,
Shore
RF.
Diorthosubstituted polychlorinated biphenyls in caudate nucleus in Parkinson’s disease . Exp Neurol.
1998; ; 150 : :339.–342. 2.
Corrigan
FM
,
Wienburg
CL
,
Shore
RF
, et al.
Organochlorine insecticides in substantia nigra in Parkinson’s disease . J Toxicol Environ Health A.
2000; ; 59 : :229.–234. 3.
Lush
MJ
,
Li
Y
,
Read
DJ
, et al.
Neuropathy target esterase and a homologous Drosophila neurodegeneration-associated mutant protein contain a novel domain conserved from bacteria to man . Biochem J.
1998; ; 332 : :1.–4. 4.
Sanchez-Santed
F
,
Canadas
F
,
Flores
P
, et al.
Long-term functional neurotoxicity of paraoxon and chlorpyrifos oxon: behavioral and pharmacological evidence . Neurotoxicol Teratol.
2004; ; 26 : :304.–317. 5.
Lotti
M
,
Moretto
A.
Organophosphate-induced delayed polyneuropathy . Toxicol Rev.
2005; ; 24 : :37.–49. 6.
Kamel
F
,
Rowland
AS
,
Park
LP
, et al.
Neurobehavioral performance and work experience in Florida farmworkers . Environ Health Perspect.
2003; ; 111 : :1765.–1772. 7.
Starks
SE
,
Hoppin
JA
,
Kamel
F
, et al.
Peripheral nervous system function and organophosphate pesticide use among licensed pesticide applicators in the Agricultural Health Study . Environ Health Perspect.
2012; ; 120 : :515.–520. 8.
Sherer
TB
,
Kim
JH
,
Betarbet
R
,
Greenamyre
JT.
Subcutaneous rotenone exposure causes highly selective dopaminergic degeneration and alpha-synuclein aggregation . Exp Neurol.
2003; ; 179 : :9.–16. 9.
Hoglinger
GU
,
Oertel
WH
,
Hirsch
EC.
The rotenone model of parkinsonism-the five years inspection . J Neural Transm Suppl.
2006; ; ((70)) : :269.–272. 10.
Chaves
RS
,
Melo
TQ
,
Martins
SA
,
Ferrari
MF.
Protein aggregation containing beta-amyloid, alpha-synuclein, hyperphosphorylated tau in cultured cells of hippocampus, substantia nigra, locus coeruleus after rotenone exposure . BMC Neurosci.
2010; ; 11 : :144.. 11.
Hoglinger
GU
,
Feger
J
,
Prigent
A
, et al.
Chronic systemic complex I inhibition induces a hypokinetic multisystem degeneration in rats . J Neurochem.
2003; ; 84 : :491.–502. 12.
McCormack
AL
,
Di Monte
DA.
Effects of L-dopa and other amino acids against paraquat-induced nigrostriatal degeneration . J Neurochem.
2003; ; 85 : :82.–86. 13.
Purisai
MG
,
McCormack
AL
,
Cumine
S
, et al.
Microglial activation as a priming event leading to paraquat-induced dopaminergic cell degeneration . Neurobiol Dis.
2007; ; 25 : :392.–400. 14.
Peng
J
,
Stevenson
FF
,
Oo
ML
,
Andersen
JK.
Iron-enhanced paraquat-mediated dopaminergic cell death due to increased oxidative stress as a consequence of microglial activation . Free Radic Biol Med.
2009; ; 46 : :312.–320. 15.
Smeyne
RJ
,
Jackson-Lewis
V.
The MPTP model of Parkinson’s disease . Brain Res Mol Brain Res.
2005; ; 134 : :57.–66. 16.
Richardson
JR
,
Quan
Y
,
Sherer
TB
, et al.
Paraquat neurotoxicity is distinct from that of MPTP and rotenone . Toxicol Sci.
2005; ; 88 : :193.–201. 17.
Ramachandiran
S
,
Hansen
JM
,
Jones
DP
, et al.
Divergent mechanisms of paraquat, MPP+, and rotenone toxicity: oxidation of thioredoxin and caspase-3 activation . Toxicol Sci.
2007; ; 95 : :163.–171. 18.
Castello
PR
,
Drechsel
DA
,
Patel
M.
Mitochondria are a major source of paraquat-induced reactive oxygen species production in the brain . J Biol Chem.
2007; ; 282 : :14186.–14193. 19.
Drechsel
DA
,
Patel
M.
Differential contribution of the mitochondrial respiratory chain complexes to reactive oxygen species production by redox cycling agents implicated in parkinsonism . Toxicol Sci.
2009; ; 112 : :427.–434. 20.
Zhang
Y
,
Dawson
VL
,
Dawson
TM.
Oxidative stress and genetics in the pathogenesis of Parkinson’s disease . Neurobiol Dis.
2000; ; 7 : :240.–250. 21.
Sherer
TB
,
Richardson
JR
,
Testa
CM
, et al.
Mechanism of toxicity of pesticides acting at complex I: relevance to environmental etiologies of Parkinson’s disease . J Neurochem.
2007; ; 100 : :1469.–1479. 22.
Choi
WS
,
Palmiter
RD
,
Xia
Z
. Loss of mitochondrial complex I activity potentiates dopamine neuron death induced by microtubule dysfunction in a Parkinson’s disease model . J Cell Biol.
2011; ; 192 : :873.–882. 23.
Thomas
B
,
Flint
B.
Molecular insights into Parkinson’s disease . F1000 Reports Med.
2011; ; 3 : :7.–15. 24.
Kruger
R
,
Kuhn
W
,
Muller
T
, et al.
Ala30Pro mutation in the gene encoding alpha-synuclein in Parkinson’s disease . Nat Genet.
1998; ; 18 : :106.–108. 25.
Polymeropoulos
MH
,
Lavedan
C
,
Leroy
E
, et al.
Mutation in the alpha-synuclein gene identified in families with Parkinson’s disease . Science.
1997; ; 276 : :2045.–2047. 26.
Zarranz
JJ
,
Alegre
J
,
Gomez-Esteban
JC
, et al.
The new mutation, E46K, of alpha-synuclein causes Parkinson and Lewy body dementia . Ann Neurol.
2004; ; 55 : :164.–173. 27.
Diaz-Corrales
FJ
,
Asanuma
M
,
Miyazaki
I
, et al.
Rotenone induces aggregation of gamma-tubulin protein and subsequent disorganization of the centrosome: relevance to formation of inclusion bodies and neurodegeneration . Neuroscience.
2005; ; 133 : :117.–135. 28.
Casarejos
MJ
,
Menendez
J
,
Solano
RM
, et al.
Susceptibility to rotenone is increased in neurons from parkin null mice and is reduced by minocycline . J Neurochem.
2006; ; 97 : :934.–946. 29.
Kwon
HJ
,
Heo
JY
,
Shim
JH
, et al.
DJ-1 mediates paraquat-induced dopaminergic neuronal cell death . Toxicol Lett.
2011; ; 202 : :85.–92. 30.
Costa
LG.
Current issues in organophosphate toxicology . Clin Chim Acta.
2006; ; 366 : :1.–13. 31.
Tsatsakis
AM
,
Zafiropoulos
A
,
Tzatzarakis
MN
, et al.
Relation of PON1 and CYP1A1 genetic polymorphisms to clinical findings in a cross-sectional study of a Greek rural population professionally exposed to pesticides . Toxicol Lett.
2009; ; 186 : :66.–72. 32.
Zintzaras
E
,
Hadjigeorgiou
GM.
Association of paraoxonase 1 gene polymorphisms with risk of Parkinson’s disease: a meta-analysis . J Hum Genet.
2004; ; 49 : :474.–481. 33.
Manthripragada
AD
,
Costello
S
,
Cockburn
MG
, et al.
Paraoxonase 1, agricultural organophosphate exposure, and Parkinson disease . Epidemiology.
2010; ; 21 : :87.–94. 34.
Draganov
DI
,
Teiber
JF
,
Speelman
A
, et al.
Human paraoxonases (PON1, PON2, and PON3) are lactonases with overlapping and distinct substrate specificities . J Lipid Res.
2005; ; 46 : :1239.–1247. |