| |
| Med Sci (Paris). 2013 February; 29(2): 144–146. Published online 2013 February 28. doi: 10.1051/medsci/2013292010.Un nouveau concept de mécanisme de clairance respiratoire ? Camille Ehré1* 1Cystic fibrosis Center/Pulmonary medicine, University of North Carolina at Chapel Hill, 7027 Thurston Bowles Bldg, Chapel Hill, NC, 27599, États-Unis MeSH keywords: Liquides biologiques, métabolisme, Formation de concepts, Gels, Humains, Modèles biologiques, Clairance mucociliaire, génétique, physiologie, Mucus, composition chimique, sécrétion, Broncho-pneumopathie chronique obstructive, étiologie, anatomopathologie, Appareil respiratoire |
Dans toutes les muqueuses, respiratoire, gastro-intestinale ou encore celle des voies génitales, la présence d’un film viscoélastique de mucus est nécessaire pour protéger l’organisme contre l’invasion d’agents pathogènes, qu’il s’agisse de virus, bactéries ou autres polluants. Ce mucus est constitué principalement de larges glycoprotéines, appelées mucines, qui doivent être parfaitement hydratées pour maintenir les propriétés viscoélastiques du mucus. Dans les voies respiratoires, la couche de mucus séquestre les agents inhalés et progresse, grâce aux battements ciliaires des cellules sous-jacentes, vers la glotte. Le mucus est continuellement avalé ou expectoré, ce qui définit le mécanisme de clairance pulmonaire. Depuis des décennies, le dogme veut que les cellules ciliées battent librement dans un milieu aqueux et propulsent le mucus qui flotte sur l’épithélium respiratoire, mais nous avons récemment réfuté ce concept dans une étude publiée dans Science [
1]. En effet, l’ancienne notion ne permet pas d’expliquer l’incidence des plaques de mucus observées dans les maladies caractérisées par l’obstruction pulmonaire (par exemple : bronchite chronique, mucoviscidose ou asthme). Notre étude montre que l’espace périciliaire est en fait occupé par de larges glycoprotéines organisées de manière spécifique en un réseau ayant une densité supérieure à celle de la couche mobile de mucus sus-jacente. Ce réseau dense de macromolécules est attaché aux cellules ciliées et possède les mêmes propriétés qu’un gel. |
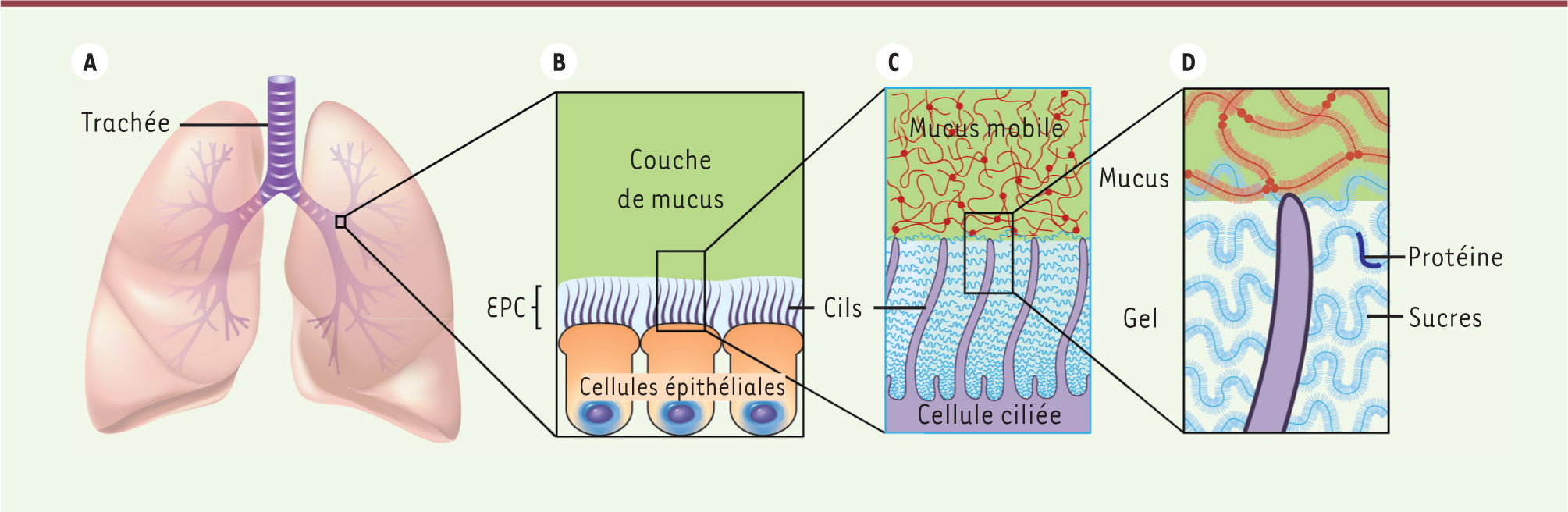
Le milieu périciliaire est un gel et non pas un fluide Le concept erroné d’un milieu périciliaire fluide repose sur plusieurs données : des observations histopathologiques acquises avec des techniques anciennes et montrant un milieu cristallin, dépourvu de toute structure, mais aussi la perception intuitive qu’un milieu liquide serait plus adapté aux battements ciliaires. Cependant une analyse détaillée des propriétés biophysiques de polymères révèle que ce système de clairance pulmonaire ne pourrait pas être fonctionnel sans la présence de macromolécules capables de retenir l’eau occupant l’espace périciliaire. En l’absence de telles molécules, la couche de mucus, qui exerce une certaine pression osmotique, entraînerait l’assèchement du milieu périciliaire, car les mouvements d’eau vont vers le milieu le plus concentré (la couche de mucus) ce qui déclencherait l’effondrement du milieu périciliaire, rendant les cils inaptes au battement. Nous avons donc émis l’hypothèse selon laquelle des mucopolysaccharides pourraient directement émaner de la membrane apicale des cellules ciliées, des microvillosités et des cils pour former un gel protecteur dans l’espace périciliaire. Les mucines de surface semblaient être de bons candidats pour jouer ce rôle grâce à leur domaine transmembranaire et à leur composition. Ces mucines sont capables de retenir l’eau et les charges associées à leurs chaînes d’oligo-saccharides permettraient la séparation et la lubrification des cils, une propriété nécessaire aux battements ciliaires. Nous démontrons donc que la couche de mucus repose sur un gel, principalement composé de mucines de surface, émanant des cils et occupant le milieu périciliaire (Figure 1). Nos conclusions viennent d’une étude approfondie de cultures primaires de cellules épithéliales bronchiques humaines et de tissu pulmonaire fraîchement collecté. Cette étude se fonde sur l’imagerie confocale (plan XZ) : celle-ci confirme que de larges billes de polystyrène (> 40 nm de diamètre) sont exclues de la région périciliaire malgré l’immobilisation des cils, alors que des billes de diamètre inférieur pénètrent progressivement cet espace. Une combinaison de microscopie électronique et de marquage immunologique révèle la présence d’un réseau fibreux émanant des cils, en partie composé de mucines de surfaces (MUC1, MUC4). En élevant la concentration en particules solides, et donc la pression osmotique du mucus mobile, nous avons observé et reproduit la compression et l’immobilisation des cils. De telles expériences simulent l’effet de la déshydratation des secrétions pulmonaires. L’introduction de ce modèle est importante car il permet d’expliquer le processus d’accumulation de mucus dans les voies respiratoires souvent observé dans les maladies pulmonaires et offre des opportunités pour concevoir de nouvelles cibles thérapeutiques pour y remédier. Une autre étude récente [
2] de notre équipe montre que les mucines et autres mucopolysaccharides attachés à la paroi apicale des cellules ciliées sont agencées de manière précise ; leur densité augmente au fur et à mesure que l’on se rapproche de la région apicale des cils. Cet agencement permet de maintenir les particules inhalées hors du milieu périciliaire, minimisant le contact entre l’épithélium et les agents infectieux dont le diamètre excèderait 40 nm (par exemple les bactéries, les levures parasites ou les larges particules virales) ; il permet aussi d’exclure les mucines sécrétées qui se concentrent alors dans la couche mobile de mucus et peuvent être ainsi propulsées hors des poumons.
 | Figure 1.
Mécanisme de clairance respiratoire. A. Un film de mucus est constamment produit dans les voies aériennes et progresse continuellement vers la trachée, puis vers la glotte où il sera avalé ou expectoré. B. La couche de mucus mobile, principalement composée de mucines sécrétées, se déplace le long de l’épithélium respiratoire grâce aux mouvements coordonnés des cils des cellules sous-jacentes qui battent librement dans l’espace périciliaire (EPC). C. Les mucines de surfaces sont attachées aux cils et rigoureusement agencées dans l’espace périciliaire. D. Les charges associées aux sucres (ou oligosaccharides) décorant les chaînes peptidiques se repoussent permettant l’intercalation des mucines de surface dans le gel, la séparation des cils et la lubrification qui est nécessaire au mouvement ciliaire. |
|
Le gel périciliaire explique la formation des plaques de mucus et l’arrêt de la clairance dans les maladies pulmonaires chroniques Le concept d’un milieu périciliaire occupé par de telles macromolécules permet d’expliquer la cascade d’événements qui aboutit à la formation de plaques de mucus, aux infections bactériennes et à l’inflammation chronique dans les poumons. Dans des conditions normales, la couche de mucus est parfaitement hydratée (composée de 2 % de particules solides), la distance entre chaque mucine est élevée, la pression osmotique du gel périciliaire est alors supérieure à celle de la couche de mucus sus-jacente. Mucus et particules inhalées progressent donc librement le long de l’épithélium respiratoire. Lorsque la concentration de la couche de mucus augmente jusqu’à une certaine valeur critique de 5 % de particules solides, l’eau qui était normalement retenue dans le milieu périciliaire est alors mobilisée pour rééquilibrer le gradient osmotique. Cet événement est directement lié à la déshydratation des sécrétions luminales. Au-delà de cette valeur critique, la concentration dans la couche de mucus devient trop élevée, le milieu périciliaire est asséché, la couche de mucus commence à pénétrer le milieu périciliaire, et la clairance ralentit. À la concentration catastrophique de 8 % de particules solides, les cils s’effondrent, la clairance pulmonaire s’arrête, les mucines sécrétées et de surface adhèrent les unes aux autres, expliquant ainsi le phénomène d’adhésion et d’accumulation du mucus dans les voies aériennes. La déshydratation du mucus peut être due à un problème directement lié au transport d’eau à travers la paroi épithéliale comme c’est le cas dans la mucoviscidose où le gène CFTR régulant la sécrétion d’ions Cl- est défectif, ou dans les bronchites chroniques fréquemment induites par l’exposition chronique à la fumée de cigarette, qui réduit la fonction du canal CFTR, ou encore liée aux infections virales et bactériennes stimulant la sécrétion de mucines au rôle protecteur [
3]. Une sécrétion abondante de mucines a aussi été observée chez des patients atteints d’asthme, submergeant le système par l’afflux soudain de mucus et pouvant s’expliquer par un retard de mobilisation d’eau pour hydrater ce mucus. Ce phénomène étant directement ou indirectement lié à la bronchoconstriction mais qui reste typique du patient asthmatique. Le mécanisme d’adhésion que nous décrivons n’est valable que pour les cellules ciliées et n’explique pas le rôle des cellules de Clara productrices d’antiprotéases et de surfactant, ou des cellules en gobelet, productrices de mucines. Ces cellules en forme de dôme possèdent aussi un agencement sophistiqué de macromolécules, exprimant MUC16 (la plus large mucine de surface), MUC1 et d’autres mucopolysaccharides couvrant leur surface [2]. Cependant la formation de plaques de mucus est souvent observée dans les régions ciliées de l’épithélium dans les modèles animaliers [
4,
5], qui pourraient représenter une région susceptible à la formation de plaques de mucus créées par l’ancrage du mucus dans les cils. Ce nouveau modèle de gel périciliaire a la capacité d’expliquer l’exclusion des pathogènes chassés hors de l’espace périciliaire, de comprendre la redistribution d’eau à l’interface couche de mucus /espace périciliaire pour le bon fonctionnement de la clairance respiratoire et d’élucider un mécanisme commun aux maladies obstructives des poumons qui aboutit à l’arrêt de la clairance, aux infections bactériennes et à l’inflammation. Ce modèle permet de mesurer les changements de la couche de mucus (qu’ils soient liés à la distance séparant les mucines, la pression osmotique, ou la proportion de particules solides) et de prévoir le changement de la vitesse de clairance. éventuellement ce modèle pourrait ouvrir la recherche sur de nouvelles cibles thérapeutiques pour améliorer la clairance respiratoire pour les nombreux patients atteints de maladies pulmonaires. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nous remercions le Dr Liheng Cai pour sa contribution à la réalisation de la figure de cet article.
|
1.
Button
B
,
Cai
LH
,
Ehre
C
, et al.
A periciliary brush promotes the lung health by separating the mucus layer from airway epithelia . Science.
2012; ; 337 : :937.–941. 2.
Kesimer
M
,
Ehre
C
Burns
KA
et al.
Molecular organization of the mucins and glycocalyx underlying mucus transport over mucosal surfaces of the airways . Mucosal Immunol.
2013 ( sous presse.). 3.
Ehre
C
,
Worthington
EN
,
Liesman
RM
, et al.
Overexpressing mouse model demonstrates the protective role of Muc5ac in the lungs . Proc Natl Acad Sci U S A.
2012; ; 109 : :16528.–16533. 4.
Mall
M
,
Grubb
BR
,
Harkema
JR
, et al.
Increased airway epithelial Na+ absorption produces cystic fibrosis-like lung disease in mice . Nat Med.
2004; ; 10 : :487.–493. 5.
Ostedgaard
LS
,
Meyerholz
DK
,
Chen
JH
, et al.
The ΔF508 mutation causes CFTR misprocessing and cystic fibrosis-like disease in pigs . Sci Transl Med.
2011; ; 3 : :74ra24.. |